不同水分条件下葡萄临界氮稀释曲线模型的建立及氮素营养诊断*
李佳帅,杨再强,2**,李永秀,2,江梦圆,赵和丽,韦婷婷,张旭然
不同水分条件下葡萄临界氮稀释曲线模型的建立及氮素营养诊断*
李佳帅1,杨再强1,2**,李永秀1,2,江梦圆1,赵和丽1,韦婷婷1,张旭然1
(1.南京信息工程大学气象灾害预报预警与评估协同创新中心,南京 210044;2.江苏省农业气象重点实验室,南京 210044)
以1a生葡萄植株“红提”为试材,在Venlo型试验温室内进行土壤水分和施氮量双因素区组试验。试验设置4个灌水水平,分别为正常灌溉量W1(田间最大持水量的70%~80%)、轻度水分胁迫W2(60%~70%)、中度水分胁迫W3(50%~60%)和重度水分胁迫W4(30%~40%);设置4个施氮水平,分别为1.5倍推荐施氮量(N1,25.5g×plant−1)、正常推荐施氮量(N2,17g×plant−1)、0.5倍推荐施氮量(N3,8.5g×plant−1)和不施用氮肥(N4,0g×plant−1)。每10d观测一次植株体内氮浓度和植株地上部生物量,利用不同水分条件下葡萄植株在一定生长时期内所获最大生物量时对应的最小氮浓度值即临界氮浓度(Nc)构建葡萄临界氮浓度稀释曲线模型,并在此基础上建立氮素吸收模型(Nupt)和氮素营养指数模型(NNI),对不同水分条件下葡萄氮营养状况进行定量诊断。结果表明:设施葡萄植株临界氮浓度与地上部生物量存在幂函数关系,随着灌水量的增加,葡萄植株临界氮浓度值增大,氮素吸收量及地上部生物量也呈增加趋势;在W1、W2水分条件下,葡萄植株生物量随施氮量增加而增加,而W3和W4处理葡萄生物量随施氮量增加呈先增后降的趋势;在相同水分条件下,氮浓度随施氮量增加而增加,随葡萄生长进程而降低;利用Nupt和NNI模型可对植株体内氮营养元素亏缺与否进行有效诊断。
葡萄;临界氮浓度;氮素营养指数;氮素吸收;干物质积累
葡萄()属多年生落叶藤本植物,在全世界果品生产中,其总产量及栽培面积均居首位。设施葡萄栽培尤以其经济效益高,发展前景广阔,随着市场需求逐渐加大,其栽培面积也逐渐增加。截至2014年,中国设施葡萄栽培面积达13.3万hm2,居世界第一[1]。江苏省葡萄种植面积近4万hm2,以鲜食葡萄为主[2]。目前,施用过量氮肥以获取更高产量的做法不仅浪费资源、增加成本,还会造成对土壤环境的破坏,给持续生产带来严重威胁。因此,判断氮肥施用量是否合理尤为重要,诊断作物体内氮素盈亏状况的基本方法之一,是确定作物的临界氮浓度值[3],临界氮浓度为在一定生长时期内获得最大生物量时的最小氮浓度[4],其对实时了解作物氮营养状况,提高作物品质及产量,避免肥料浪费具有重要意义。
目前,许多国内外学者已对部分作物的氮素营养做出了合理诊断。Lemaire等[5]于1984年首次提出牧草的临界氮浓度稀释曲线模型,表明牧草在不受氮素限制时,地上部干物质量与氮浓度存在幂函数关系,土壤含氮量成为作物干物质量累积的主要限制因素之一。随后Justes等[6]在1994年建立了冬小麦临界氮浓度稀释曲线模型Nc=5.35×DM−0.442,Sheehy等[7]对热带水稻的研究结果为Nc=5.35×DMM−0.5,随后该模型在冬油菜[8]、玉米[9]、向日葵[10]、番茄[11]、包心菜[12]、马铃薯[13]、高粱[14]、甜椒[15]等作物上均有应用。这些研究所得到的模型形式一致,但参数大多不同。国内也有许多学者对作物临界氮浓度稀释曲线进行研究,薛晓萍等[16]构建了不同地区棉花的临界、最低和最高氮浓度稀释曲线模型,并得出该作物的最佳施氮量;梁效贵等[17−18]构建了不同地区夏玉米的临界氮稀释曲线模型并在此基础上建立了氮营养指数模型,氮营养指数可准确诊断作物体内氮素状况。向友珍等[19]对甜椒的研究发现,随着土壤水分提高,植株的氮素吸收量和地上部干物质量呈先增大后减少的变化趋势,各水分条件下最佳施氮量均介于150~225kg·hm−2。杨慧等[20]构建了番茄植株的临界和边界氮浓度稀释曲线模型,并发现在相同灌溉水平下,植株氮浓度随施氮量增加而增加,随生长进程而降低,随土壤水分增加植株体内氮浓度整体提高。
前人研究表明,临界氮浓度稀释曲线模型、氮营养指数模型和氮素吸收模型可诊断植株氮营养状况,明确植株需氮量。植株体内氮浓度受水分供应影响,适宜水分会促进干物质累积,当氮供应不足时,会稀释植株体内氮浓度。而前人在构建临界氮浓度稀释曲线模型时仅考虑氮素因素,关于水分氮素双因素对该模型的影响鲜有报道。因此,本研究拟通过水氮耦合的全面试验,建立设施葡萄植株临界氮浓度稀释曲线模型、氮素营养指数模型和氮素吸收模型,并检验其可靠性,探究利用此模型来指导设施葡萄氮素营养诊断,以期为设施葡萄的氮素合理利用提供理论依据和技术支持。
1 材料与方法
1.1 试验地概况
试验于2018年3−8月在地处亚热带季风气候区的南京信息工程大学农试站Venlo型试验温室(32.20°N,118.71°E)内进行。该地海拔28m,年平均气温为15.6℃。试验期间正值春夏季,温室内整体日平均气温呈上升趋势,平均空气相对湿度为74.5%,平均日光合有效辐射累计值为3.22MJ·m−2。温室顶高5.0m,肩高4.5m,宽9.6m,长30.0m,南北走向,采用自动天窗和侧通风口通风。供试土壤为中壤土,土壤肥力均一,pH为7.4,有机质含量为18.32g·kg−1,全氮0.86g·kg−1,全磷0.75g·kg−1,土壤体积含水量32.45%。
1.2 试验设计
以1a生“红提”苗木为供试葡萄品种进行盆栽试验,盆的上口直径41.5cm,底部直径26.5cm,深31cm。设置水和氮两个因素,每个因素均四个水平,四个水分梯度[21]分别:正常水分W1(田间最大持水量的70%~80%)、轻度胁迫W2(田间最大持水量的60%~70%)、中度胁迫W3(田间最大持水量的50%~60%)、重度胁迫W4(田间最大持水量的30%~40%)。通过EM50(Decagon Device,USA)采集土壤深度25cm处水分数据,获取每小时的土壤水分数据。查阅文献并计算出葡萄推荐施氮量,葡萄生长初期的推荐施氮量[22−23]为纯氮17g×plant−1,因此,设置四个氮素指标分别为:1.5倍推荐施肥(N1)、正常推荐施肥(N2)、0.5倍推荐施肥(N3)、不施用氮肥(N4)。试验共16个处理,设置如表1,每个处理重复6次,其中3次的数据均值用于建模,另外3次的数据均值用于检验。采集葡萄植株鲜样均控制在9:00−11:00进行,试验期间共取样9次。当日样品于液氮速冻,并收集于−20℃冰箱中备用,采样全部结束后,统一测定相关指标。试验期间,除控制变量外,其它管理措施正常。
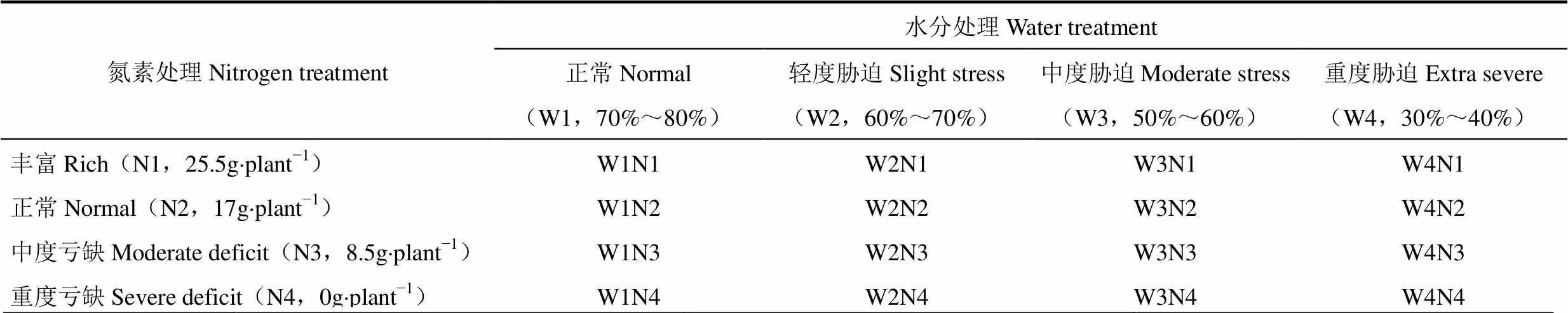
表1 葡萄植株水氮处理设置
1.3 项目测定
地上部生物量:处理后每10d每个处理选6株,试验期间共采样9次。将葡萄植株茎和叶用水洗净擦干后,在105℃杀青30min,再于85℃恒温烘干至恒重,用精度为0.001g电子天平分别测定植株地上部干物质量。
植株氮浓度:将烘干样品粉碎后用H2SO4−H2O2消化,最后用凯氏法蒸馏测定全氮浓度[24]。
各器官氮累积量[19]=器官氮浓度×器官干物质量 (1)
植株地上部氮累积量[19]=茎氮累积量+叶氮累积量 (2)

1.4 模型描述
1.4.1 临界氮浓度稀释曲线模型
临界氮浓度(NC)指植物在一定生长时期内获得最大生物量时对应的最小氮浓度[4]。在植株生长发育过程中,若地上部氮浓度处于临界值以下,或增加施氮量时,植株干物质量显著增加,说明作物的生长将受制于氮元素;反之,处于临界值以上,或增加施氮量植株地上部干物质量并无明显变化,说明作物的生长不受制于氮元素,因此,地上部氮浓度值与临界氮浓度相同时的施氮量最适宜。
构建基于植株生物量的临界氮浓度稀释曲线模型,首先需确定临界氮浓度值,构建临界氮稀释曲线模型的步骤[6,16]如下:
(1)通过方差分析将不同时段观测的植株地上部干物质量和对应地上部氮浓度数据,按植株生长发育受氮元素限制与否进行分类;
(2)将植株生长受限于氮素的地上部干物质量(横坐标)与氮浓度(纵坐标)间的关系进行曲线拟合;
(3)当植株生长不受限于氮素影响时,干物质量的最大值用其地上部干物质量平均值来代表;
(4)每个理论临界氮浓度值,即在最大干物质量处作横坐标的垂线,垂线与上述拟合曲线交点对应的纵坐标值;
(5)曲线拟合:利用回归拟合方程法以临界氮浓度值Nc(g·kg−1)为因变量,以植株地上部最大干物质量DMmax(t·hm−2)为自变量,建立临界氮浓度稀释曲线模型,即

式中,a为植株地上部干物质量为1t·hm−2时的临界氮浓度,b为决定临界氮浓度稀释曲线斜率的参数[25]。
1.4.2 氮素营养指数模型
为更精确地反映设施葡萄植株氮营养情况,采用氮营养指数模型来定量评估葡萄植株体内氮素情况[5]。即

式中,Nt为葡萄植株氮浓度实测值(g·kg−1),Nc为模拟值(g·kg−1)。NNI=1表明植株体内氮营养最适,NNI>1表明氮营养过多,NNI<1表明氮营养缺乏。
1.4.3 氮素吸收模型
植株氮吸收量(Nupt,kg·hm−2)与地上部最大干物质量(DMmax,t·hm−2)之间的关系[16]为
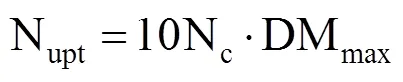
将式(1)代入式(3),得到葡萄植株临界氮吸收模型为

1.5 模型的检验
采用均方根误差(RMSE)分析模拟值与实测值的拟合度,RMSE越小,说明误差越小,模拟值拟合效果越好,即模型的模拟精度越高;同时,用模拟值与实测值之间1:1图来显示模型的精度[26]。
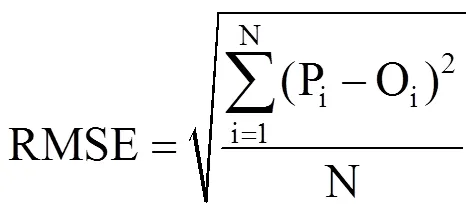
式中,Pi为实测值,Oi为模拟值,N为样本数量。
1.6 数据处理
采用Microsoft Excel 2010进行数据处理和作图,采用SPSS20.0软件进行数据的方差分析。
2 结果与分析
2.1 不区分水分条件下氮浓度稀释曲线
所有处理每10d观测数据显示,试验过程中,设施葡萄植株地上部生物量的变化范围在0.10~11.29t·hm−2,氮浓度的变化范围在0.52~8.61g·kg−1,不同阶段两者关系见图1。由图1a可见,当地上部生物量小于1t·hm−2(取样数n=42)时,生物量和氮浓度的数据波动较大,二者无显著关系。当地上部生物量大于1t·hm−2时(图1b,n=102),氮浓度随生物量增加呈下降趋势即存在氮稀释现象,二者的关系可表示为Nc=3.66DW−0.46,方程的决定系数为0.0583,说明当地上部生物量大于1t·hm−2时,氮浓度与地上部生物量存在幂函数关系。
2.2 不同水分条件下临界氮稀释曲线模型的构建与验证
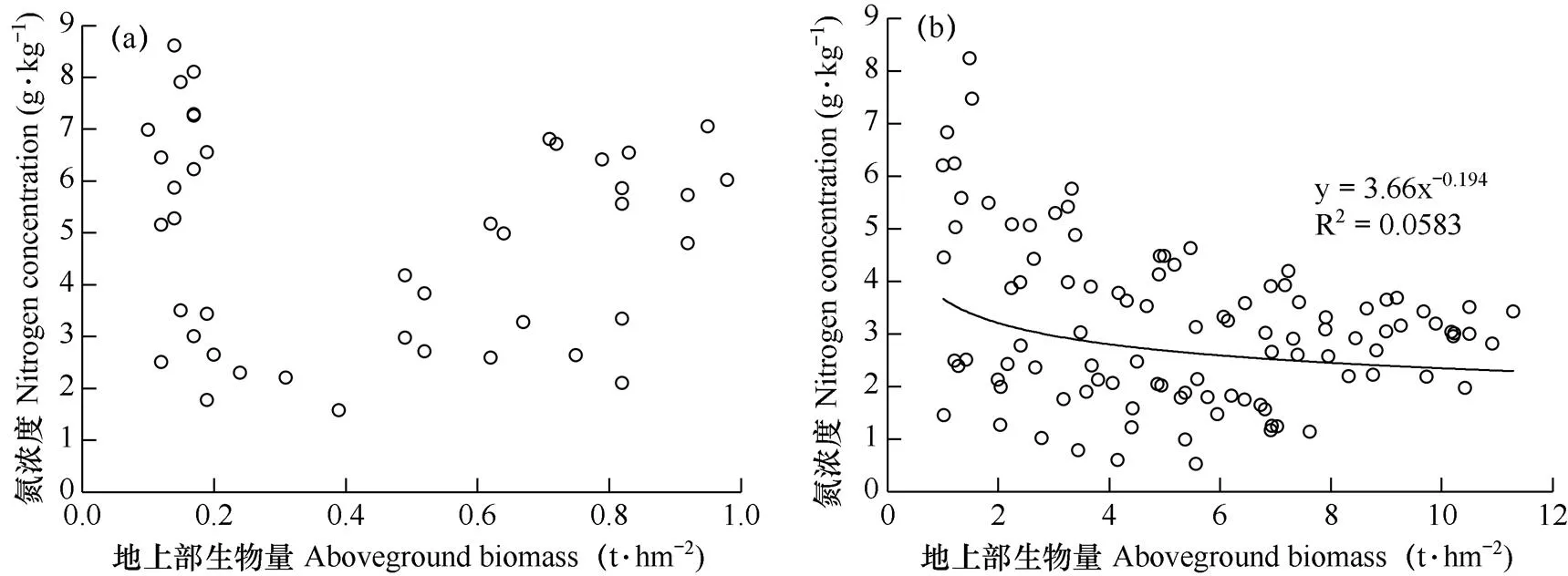
图1 葡萄植株氮浓度与地上部生物量的关系
注:图a表示地上部生物量小于1t·hm−2(n=42),图b表示地上部生物量大于1t·hm−2(n=102)。
Note: Fig.a indicates that the aboveground biomass is less than 1t·ha−1(n=42). Fig. b indicates that the aboveground biomass is more than 1t·ha−1(n=102).

图2 葡萄植株地上部生物量小于1t·hm−2(1)和大于1t·hm−2(2)时不同水分条件下氮浓度与地上部生物量的关系
注:W1、W2、W3和W4分别表示田间最大持水量的70%~80%、60%~70%、50%~60%和30%~40%水分处理。下同。
Note : W1, W2, W3 and W4 is 70%−80%, 60%−70%, 50%−60% and 30%−40% of maximum water capacity in the field, respectively. The same as below.
2.2.1 模型构建
当生物量小于1.00t·hm−2时,设施葡萄植株地上部氮浓度值随生物量增加无明显下降趋势,因此,该阶段的氮浓度值不进行模拟。当地上部生物量大于1.00t·hm−2时,由于各试验地土壤湿度不同,故将数据分为4组:正常灌溉W1(田间最大持水量的70%~80%)、轻度胁迫W2(60%~70%)、中度胁迫W3(50%~60%)、重度胁迫W4(30%~40%)。根据式(1)对植株氮浓度及对应的地上部生物量数据进行拟合,得到4个水分条件下设施葡萄植株的临界氮浓度稀释曲线模型,并分别选取最大、最小氮浓度实测值模拟得出氮浓度稀释边界模型(图2),且由式(3)和式(4)得出临界氮吸收模型,两个模型参数见表2。分析实测数据得出,不同水氮条件下葡萄植株地上部干物质积累过程存在显著差异,总体上表现为:土壤湿度越小,植株干物质积累越少。正常供水情况下(W1)植株地上部干物质累积整体水平较高(0.14~11.29t·hm−2);随着土壤湿度的降低,W2和W3处理中植株干物质量分别降至0.12~10.92t·hm−2、0.10~10.42t·hm−2水平;在严重缺水情况下(W4),植株干物质量仅0.12~7.62t·hm−2,显著低于其它灌水处理(P<0.05),干物质积累量小于1.00t·hm−2的情况也逐渐增多。同时,土壤含水量对葡萄植株氮浓度的影响也较大,土壤中水分越少植株吸收的氮也越少,且各水分处理间差异显著。正常水分条件下(W1),地上部植株体内氮浓度整体水平较高(1.23~8.61g·kg−1);随着土壤湿度的降低,W2、W3处理中植株氮浓度分别降至1.16~7.90g·kg−1、0.52~6.98g·kg−1水平;在严重缺水情况下(W4),植株氮浓度仅0.59~3.50g·kg−1,显著低于其它灌水处理(P<0.05)。同时,在正常供水情况下,随着地上部生物量的增加,植株氮浓度有降低的趋势,但在相对缺水条件下,这种降低趋势逐渐减弱,植株氮浓度均处于较低水平。说明在水分供应充足时植株对氮素营养吸收能力强,体内氮含量相对较高,在干旱条件下,设施葡萄植株受水分制约导致氮吸收能力降低,从而植株氮浓度下降。
由表2可以看出,不同水分条件下设施葡萄植株临界、最低和最高氮浓度稀释曲线参数a不同,且随着土壤含水量的减少各参数均呈减小趋势,说明土壤水分适宜可提高葡萄植株临界氮浓度,增强植株对氮的吸收能力。可能是由于在缺水条件下,葡萄植株长势减弱,导致对氮的容纳能力减弱,因此,植株体内氮浓度下降。其次,参数b在不同水分条件下也不同,其随着水分胁迫加重呈先减小后增加再减少的趋势,说明轻度水分胁迫下葡萄植株氮浓度随地上部生物量增加平缓降低,葡萄具有一定的耐旱性能,而到中度水分胁迫时,由于水分亏缺使得氮浓度随植株增长迅速下降,重度水分胁迫条件下b值低是由于其植株初始氮浓度较低,降低幅度也因此较小。
2.2.2 模型验证
采用另外3组重复的数据(n=80)对临界氮浓度稀释曲线经验模型进行验证,如图3所示,W1(正常水分条件)、W2(轻度水分胁迫)、W3(中度水分胁迫)和W4(重度水分胁迫)4种水分条件下,模型RMSE分别为0.273、0.263、0.277、0.283,R2分别为0.893、0.828、0.923、0.958,综合RMSE和R2可以看出,模拟效果整体较好,说明该模型精度较高,可用于进一步氮素营养诊断。

表2 不同水分条件下葡萄临界氮浓度稀释模型和氮素吸收模型参数值
注:Nmax和Nmin分别为模拟出的最高和最低氮浓度稀释曲线模型(氮浓度稀释边界模型),Nuptmax和Nuptmin分别为最高和最低氮素吸收模型。
Note: Nmaxand Nminare the maximum and minimum nitrogen concentration dilution curve models by simulated (nitrogen concentration dilution boundary model). Nuptmaxand Nuptminare the highest and lowest nitrogen absorption models.
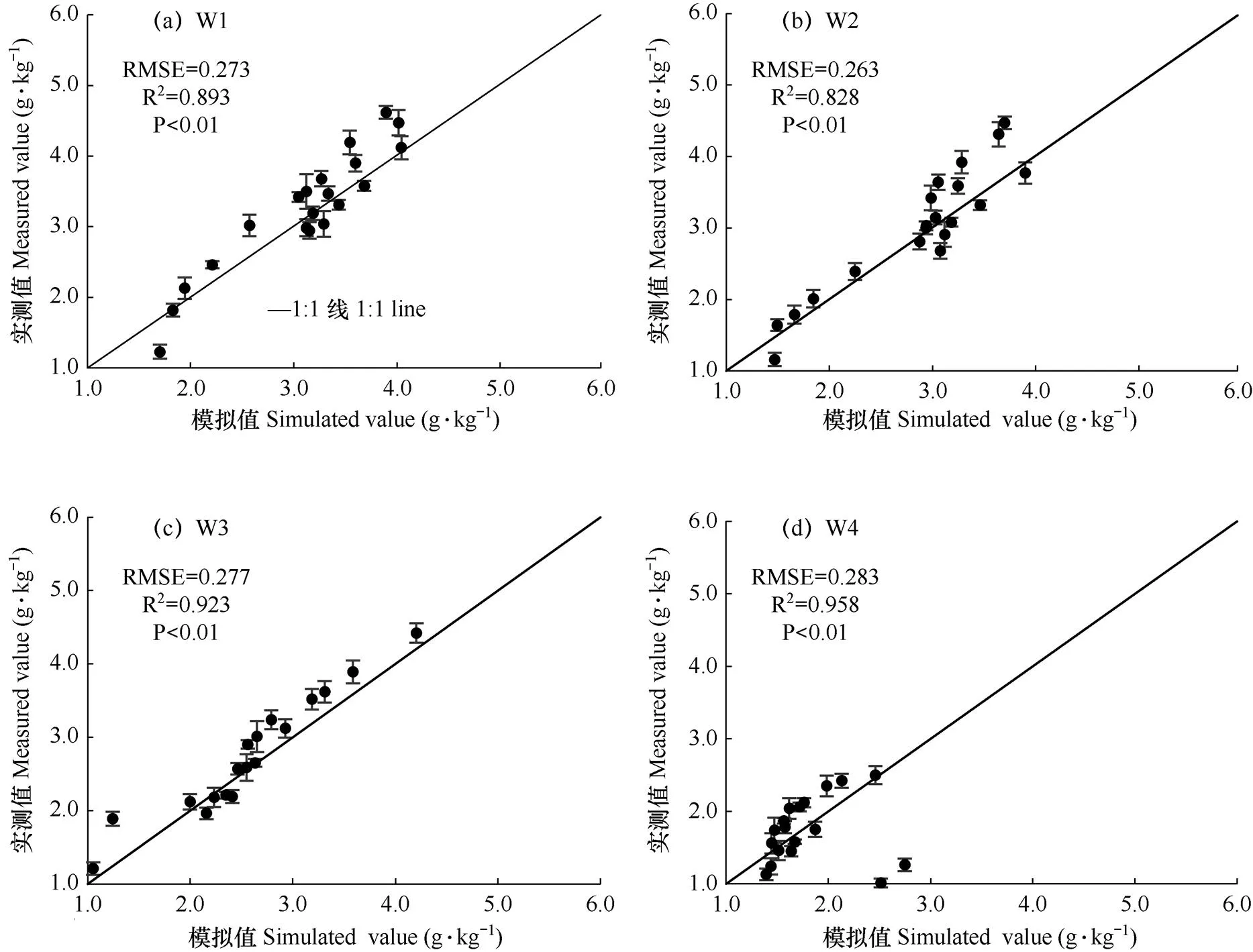
图3 不同水分条件下葡萄临界氮浓度稀释模型模拟值与观测值的关系
注:短线表示均方误。下同。
Note : The short bar is mean square error.The same as below.
2.3 不同水分条件下临界氮稀释曲线模型的应用
2.3.1 氮营养状况诊断
图4表示不同水分条件下设施葡萄植株在不同施氮水平处理下的营养指数(NNI)动态变化。由图可知,植株的NNI随施氮量增加而上升,且随生长时间延长大体呈减小趋势,表明处理后期植株对氮的需求量较大,W1(正常水分条件)、W2(轻度水分胁迫)、W3(中度水分胁迫)和W4(重度水分胁迫)水平下NNI变化区间分别为0.39~1.17、0.40~1.23、0.22~1.27和0.41~1.39,说明NNI随土壤水分减少大致呈增加趋势,在W1条件下N1(1.5倍施氮量)处理NNI>1,表明葡萄植株氮营养过剩;N2(正常施氮量)处理下前80d NNI>1,之后NNI<1,表明N2处理在前期氮营养充足,后期需氮量增加,导致营养不足;N3(0.5倍施氮量)和N4(无施氮)处理均为NNI<1,说明氮肥不足抑制了葡萄植株干物质量的累积,增施氮肥后NNI明显升高。在W2、W3条件下,NNI值呈现的变化规律大体与W1一致,且略大于W1条件下,在W4条件下,N1和N2处理时NNI>1,而N3和N4处理时 NNI<1,表明N1和N2处理下氮营养过剩,而N3和N4处理氮营养不足。因此经综合考虑得设施葡萄植株的较适施氮量应在N1−N3之间,且更接近于N2。
2.3.2 氮吸收的营养诊断
由图5可见,设施葡萄植株氮吸收量随着施氮量和地上部生物量的增加呈增长趋势,W1(正常水分条件)下植株氮吸收量整体较高,其后依次是W2(轻度水分胁迫)、W3(中度水分胁迫)和W4(重度水分胁迫),说明水分不足导致葡萄植株对氮的吸收量降低。由图5a发现,临界氮吸收量曲线(Nupt)处于N1(1.5倍施氮量)和N2(正常施氮量)曲线之间,这与NNI的诊断一致,说明灌溉量适宜时有助于葡萄植株对氮营养的吸收利用;由图5b可得,相同灌溉条件下,N2处理植株氮吸收量低于N1处理,而地上部生物量高于N1处理,说明施氮量适宜时有助于葡萄植株地上部干物质的累积,施氮量过多则适得其反,N3(0.5倍施氮量)和N4(无施氮)低于临界氮吸收量,说明施氮不足导致作物基本的氮营养需求无法得到满足,因此地上部干物质量累积较慢,对葡萄植株生长产生抑制作用。
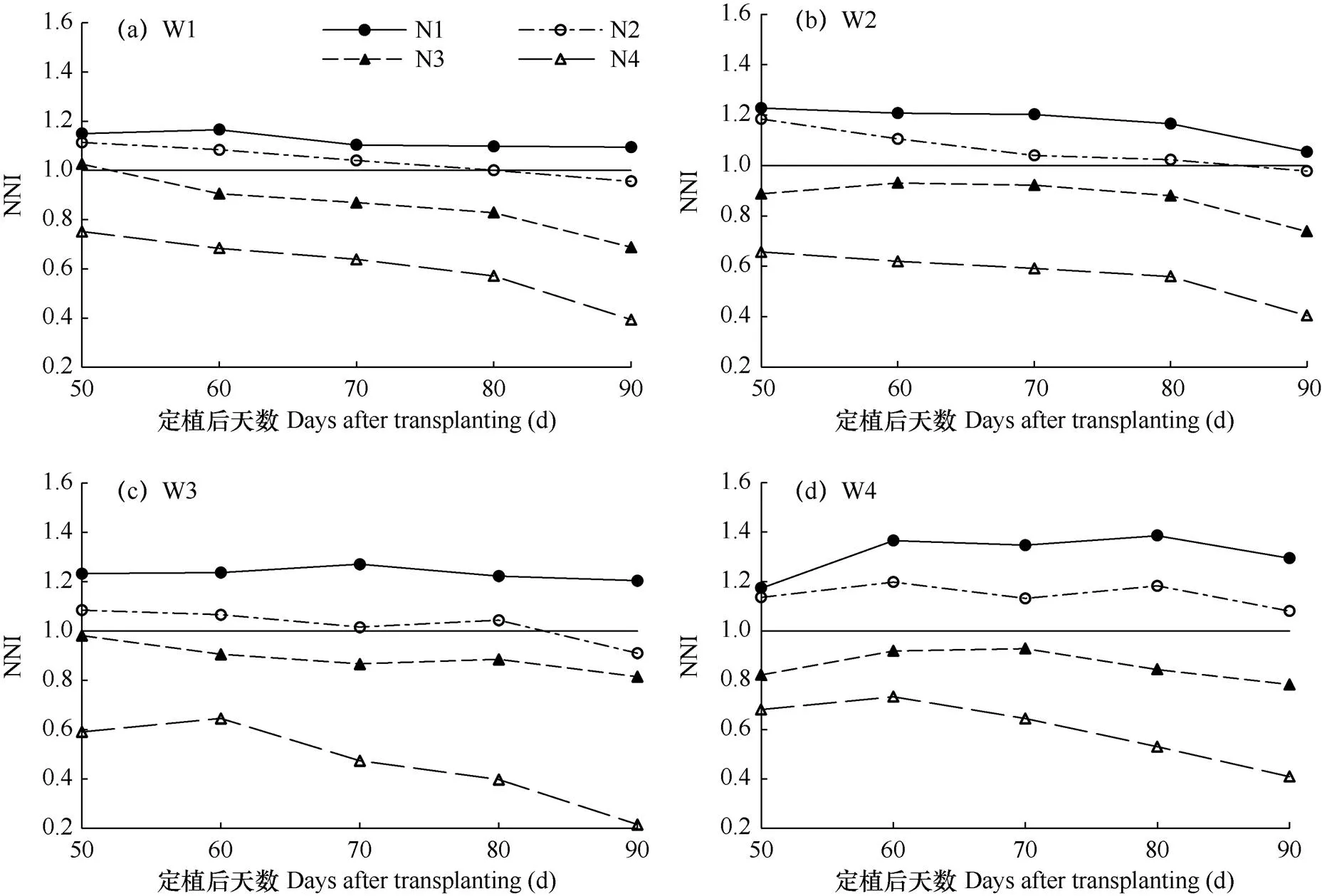
图4 不同水氮条件下葡萄植株营养指数(NNI)的动态变化
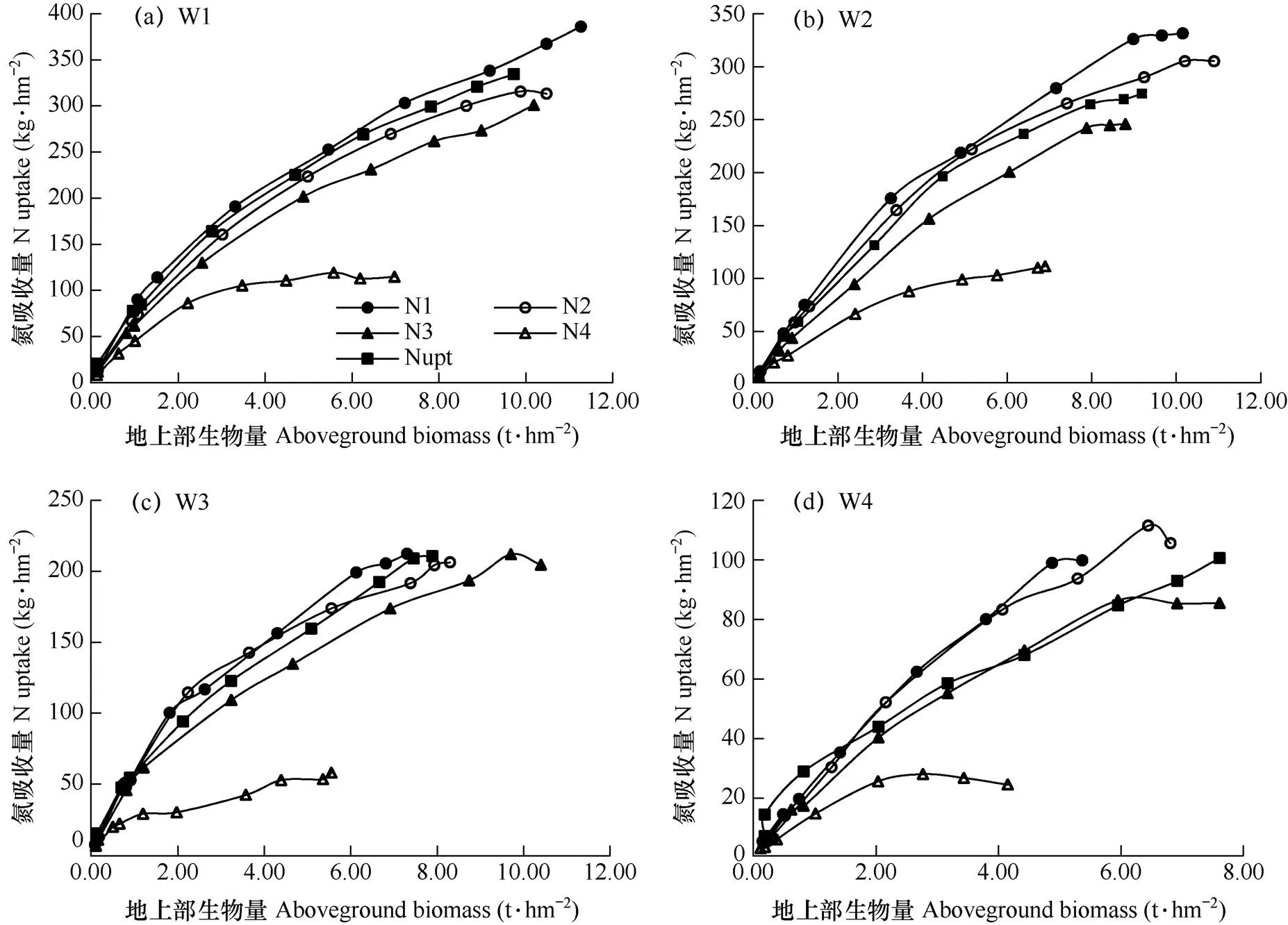
图5 不同水氮条件下葡萄地上部生物量与氮吸收量的关系
3 结论与讨论
3.1 讨论
为避免实际生产中过度施氮的现象,明确设施葡萄植株在不同生长时期所需临界氮浓度,以合理指导施氮量,本研究构建了葡萄植株在不同灌溉条件下的临界、最高和最低氮浓度稀释曲线模型,并对不同水氮条件下葡萄植株的氮营养状况进行了诊断,发现施氮量对该模型基本形式无显著影响,但对其统计学参数值影响较大。所构建的模型参数不同于前人所建立的作物临界氮浓度稀释曲线模型[5],主要原因[4,20]一是前人构建的模型是基于无氮素限制条件下得到的;二是由于作物品种、类型及内在生理生态机制的不同;三是不同的栽培方式也会使参数产生差异;四是由于作物生长的气候条件不同。任一模型应用于特定作物时,模型参数都需重新设定。本研究表明,参数a随土壤水分含量增加而增加,说明在适当的水分条件下葡萄植株对氮营养的吸收能力增强,有利于干物质的积累。与杨慧等[20−21]构建的番茄植株临界氮浓度模型的结论一致。本研究中参数a值在正常水分条件(W1)下较大,葡萄植株地上部干物质累积量较高;该值在重度水分胁迫(W4)下较小,是因为水分过度亏缺限制了葡萄植株对氮肥的吸收利用,从而抑制了葡萄植株的生长。本研究所构建的在不同水氮条件下的临界氮浓度稀释曲线模型相比于仅由氮素单因素所构建的模型更具普适性,但此模型仅在同一地点,由同一品种的试验条件下构建,因此还待进一步完善。
NNI可实时诊断葡萄植株的氮肥营养状况,量化植株受氮肥制约的程度[27],是进行合理施氮的重要依据。前人研究表明,NNI能较好地反映油菜、玉米、高粱、番茄、包心菜、马铃薯、向日葵、甜椒等植株的氮营养状况,基于NNI来诊断植株生长进程中的氮素营养盈亏,从而及时采取措施,调整水肥管理方法,提高作物地上部干物质的累积速率,为精确施氮提供理论依据与指导。本研究对各水氮条件下葡萄植株不同时期NNI和葡萄植株地上部氮吸收进行分析,发现葡萄植株NNI随土壤水分的提高而降低,随施氮量增加而上升,随生长时间延长而减小的趋势,葡萄植株氮素吸收量随着施氮量和地上部干物质量的增加呈增加的变化趋势,本研究分析初步认为,葡萄的较适施氮量介于17~25.5g×plant−1,作物干物质量的有效积累需要吸收适宜的氮肥,则该施氮量有助于作物对氮营养的利用。同时,葡萄植株的地上部生物量和氮素吸收量随着土壤水分的增加而增加,其中W1(70%~80%)适宜施氮量为N1(25.5g×plant−1)、W2(60%~70%)适宜施氮量为N2(17g×plant−1),两者均可促进设施葡萄植株对氮素营养的吸收利用,使地上部生物量增加最终分别达11.29t·hm−2和10.92t·hm−2。基于成本考虑,在W2的灌水条件下施用N2更适合应用于实践。本研究还认为在一定土壤水分条件下,高氮和低氮均会使葡萄植株的生物量减少,赵薇等[28]以番茄为试验对象也得出了一致结论。葡萄植株地上部生物量随施氮量增加呈先增后降的变化趋势,说明葡萄植株对氮的容纳有一定限度,高于临界氮吸收量后增施氮肥不仅不能同时提高作物干物质量,还会抑制植株对氮的吸收利用。
3.2 结论
(1)以1a生葡萄品种“红提”为供试材料,设置4个灌溉水平:W1(70%~80%)、W2(60%~70%)、W3(50%~60%)、W4(30%~40%),4个氮素水平(25.5、17、8.5和0g×plant−1),构建了不同灌溉条件下设施葡萄植株的临界、最大和最小氮浓度稀释曲线模型,结果表明,不同时期的植株最大生物量与氮浓度之间存在幂函数关系,由模型参数得,植株的氮素吸收量和地上部生物量随灌溉水平提高而增加。
(2)氮营养指数模型与氮素吸收模型诊断各水分条件下设施葡萄植株氮营养结果一致:W1、W2及W3灌溉水平下,每株葡萄植株较适施氮量在17~25.5g,W4条件下在8.5~17g。
(3)分析氮素营养对植株生物量的影响效应认为,水分条件为W1和W2时较利于葡萄对氮营养元素的吸收利用,地上部生物量较高。在适宜施氮量情况下,灌溉水平为W2时可获得仅低于W1灌溉水平下约3.3%的生物量,大大减少了水和肥料的成本。考虑到温室无降水的供应,灌水量W2(60%~70%)施氮量为17g×plant−1左右为较适水氮配比。
[1] 穆维松,高阳,王秀娟,等.我国设施葡萄生产的成本收益比较研究[J].中外葡萄与葡萄酒,2014,(3):20-24.
Mu W S,Gao Y,Wang X J,et al.Comparative cost-benefit analysis on grape protected cultivation[J].Sino-Overseas Grapevine & Wine,2014,(3):20-24.(in Chinese)
[2] 吉沐祥,李国平,芮东明,等.江苏省鲜食葡萄病虫害绿色防控技术规程[J].江苏农业科学,2015,43(7):107-109.
Ji M X,Li G P,Rui D M,et al.Technical specification for green control of diseases and insect pests of fresh grapevine in Jiangsu province[J].Jiangsu Agricultural Sciences,2015,43(7):107-109.(in Chinese)
[3] Greenwood D J,Gastal F,Lemaire G,et al.Growth rate and %N of field grown crops: theory and experiments[J].Annals of Botany,1991,67(2):181-190.
[4] 王新,马富裕,刁明,等.滴灌番茄临界氮浓度、氮素吸收和氮营养指数模拟[J].农业工程学报,2013,29(18):107-116.
Wang X,Ma F Y,Diao M,et al.Simulation of critical nitrogen concentration,nitrogen uptake and nitrogen nutrition index of processing tomato with drip irrigation[J].Transactions of the CSAE,2013,29(18):107-116.(in Chinese)
[5] Lemaire G,Gastal F.N uptake and distribution in plant canopies[M].Diagnosis of the Nitrogen Status in Crops, 1997,53(370):3-43.
[6] Justes E,Mary B,Meynard J M,et al.Determination of a critical nitrogen dilution curve for winter wheat crops[J]. Annals of Botany,1994,74(4):397-407.
[7] Sheehy J E,Dionora M J A,Mitchell P L,et al.Critical nitrogen concentrations: implications for high-yielding rice(L.) cultivars in the tropics[J].Field Crops Research, 1998,59(1):31-41.
[8] Colnenne C,Meynard J M,Reau R,et al.Determination of a critical nitrogen dilution curve for winter oilseed rape[J]. Annals of Botany,1998,81(2):311-317.
[9] Daniel P,Gilles L.Relationships between dynamics of nitrogen uptake and dry matter accumulation in maize crops: determination of critical N concentration[J].Plant and Soil, 1999,216(1-2):65-82.
[10] Debaeke P,Oosterom E J V,Justes E,et al.A species-specific critical nitrogen dilution curve for sunflower(L.)[J].Field Crops Research, 2012, 136: 76-84.
[11] Tei F,Benincasa P,Guiducci M.Critical nitrogen concentration in processing tomato[J].European Journal of Agronomy,2002, 18(1):45-55.
[12] Ekbladh G,Witter E.Determination of the critical nitrogen concentration of white cabbage[J].European Journal of Agronomy,2010,33(4):276-284.
[13] Giletto C M,Echeverría H E.Critical nitrogen dilution curve for processing potato in Argentinean humid pampas[J]. American Journal of Potato Research,2012,89(2):102-110.
[14] Oosterom E J V,Carberry P S,Muchow R C.Critical and minimum N contents for development and growth of grain sorghum[J].Field Crops Research,2001,70(1):55-73.
[15] Yasuor H,Ben-Gal A,Yermiyahu U,et al.Nitrogen management of greenhouse pepper production:agronomic nutritional, and environmental implications[J].Hort Science,2013,48(10): 1241-1249.
[16] 薛晓萍,沙奕卓,郭文琦,等.棉花蕾花铃生物量、氮累积特征及临界氮浓度稀释模型[J].生态学报,2008,28(12): 6204-6211.
Xue X P,Sha Y Z,Guo W Q,et al.Accumulation characteristics of biomass and nitrogen and critical nitrogen concentration dilution model of cotton reproductive organ[J].Acta Ecologica Sinica,2008,28 (12):6204-6211.(in Chinese)
[17]梁效贵,张经廷,周丽丽,等.华北地区夏玉米临界氮稀释曲线和氮营养指数研究[J].作物学报,2013,39(2):292-299.
Liang X G,Zhang J T,Zhou L L,et al.Critical nitrogen dilution curve and nitrogen nutrition index for summer maize in North China Plain[J].Acta Agronomica Sinica, 2013,39(2):292-299.(in Chinese)
[18] 强生才,张富仓,向友珍,等.关中平原不同降雨年型夏玉米临界氮稀释曲线模拟及验证[J].农业工程学报,2015,31 (17):168-175.
Qiang S C,Zhang F C,Xiang Y Z,et al.Simulation and verification of critical nitrogen dilution curve for summer maize in Guanzhong Plain during different rainfall years[J].Transactions of the CSAE,2015,31(17): 168-175.(in Chinese)
[19]向友珍,张富仓,范军亮,等.基于临界氮浓度模型的日光温室甜椒氮营养诊断[J].农业工程学报,2016,32(17):89-97.
Xiang Y Z,Zhang F C,Fan J L,et al.Nutrition diagnosis for N in bell pepper based on critical nitrogen model in solar greenhouse[J].Transactions of the CSAE,2016,32(17):89-97. (in Chinese )
[20]杨慧,曹红霞,柳美玉,等.水氮耦合条件下番茄临界氮浓度模型的建立及氮素营养诊断[J]. 植物营养与肥料学报,2015,21(5):1234-1242.
Yang H,Cao H X,Liu M Y,et al.Simulation of critical nitrogen concentration and nitrogen nutrition index of tomato under different water and nitrogen conditions[J]. Journal of Plant Nutrition and Fertilizer,2015,21(5):1234- 1242. (in Chinese )
[21] 刘明,吕爱锋,武建军,等.干旱对农业生态系统影响研究进展[J].中国农学通报,2014,30(32):165-171.
Liu M,Lv A F,Wu J J,et al.A review of impacts of drought on agro-ecosystem[J].Chinese Agricultural Science Bulletin, 2014,30(32):165-171.(in Chinese)
[22] 王奎稳.设施葡萄秋季施肥技术[J].落叶果树,2016,48(3): 30.
Wang K W.Autumn fertilization techniques for protected grapes[J].Deciduous Fruits,2016,48(3):30.(in Chinese)
[23]倪荣梅.不同水肥管理对设施葡萄产量和品质的影响研究[J].新疆农垦科技,2016,39(4):62-64.
Ni R M.Effects of different water and fertilizer management on yield and quality of protected grape[J].Xinjiang Farm Research of Science and Technology,2016,39(4):62-64.(in Chinese)
[24]Bao S D.Soil and agricultural chemistry analysis[M].Beijing:China Agriculture Press,1999.
[25]Gastal F,Lemaire G.N uptake and distribution in crops: an agronomical and ecophysiological perspective[J].Journal of Experimental Botany,2002,53(370):789-799.
[26]岳松华,刘春雨,黄玉芳,等.豫中地区冬小麦临界氮稀释曲线与氮营养指数模型的建立[J].作物学报,2016,42(6):909-916.
Yue S H,Liu C Y,Huang Y F,et al.Simulating critical nitrogen dilution curve and modeling nitrogen index in winter wheat in central Henan area[J].Acta Agronomica Sinica,2016,42(6):909-916.(in Chinese)
[27]Meynard J M,David G.Diagnostic de lelaboration du rendement des cultures[J].Cahiers Agriculture,1992,1(1):9-19.
[28]赵薇,张治平,缪旻珉.番茄临界氮浓度模型的建立及氮素营养诊断[J].中国农学通报,2018,34(22): 37-44.
Zhao W,Zhang Z P,Miao M M.Establishment of tomato critical nitrogen concentration model and diagnosis of nitrogen nutrition[J].Chinese Agricultural Science Bulletin,2018,34(22):37-44.(in Chinese)
Establishment of a Critical Nitrogen Dilution Model for Grapes and Nitrogen Nutrition Diagnosis under Different Water Conditions
LI Jia-shuai1, YANG Zai-qiang1,2, LI Yong-xiu1,2, JIANG Meng-yuan1, ZHAO He-li1, WEI Ting-ting1, ZHANG Xu-ran1
(1.Collaborative Innovation Center on Forecast and Evaluation of Meteorological Disasters, Nanjing University of Information Science & Technology, Nanjing 210044, China; 2.Jiangsu Provincial Key Laboratory of Agrometeorology, Nanjing 210044)
In this paper, a two-factor pot experiment was carried out in the Venlo-type greenhouse, using the annual grape of "Hongti" variety as experimental material. There were four irrigation levels and four nitrogen application levels in the two-factor pot experiment. Four irrigation levels were normal irrigation (W1, 70%−80% of the maximum water holding capacity in the field), slight drought stress (W2, 60%−70%), moderate drought stress (W3, 50%−60%) and extra severe drought tress (W4, 30%−40%). And four nitrogen application levels were 1.5 times normal recommended nitrogen application rate(N1, 25.5g×plant−1), normal recommended nitrogen application rate(N2, 17g×plant−1), 0.5 times normal recommended nitrogen application rate(N3, 8.5g×plant−1) and no nitrogen application(N4, 0g×plant−1). The nitrogen concentration in the plant and the aboveground biomass of the plant were observed every 10 days. The minimum nitrogen concentration corresponding to the maximum biomass obtained by grape plants under different water conditions in a certain period is called Nitrogen critical concentration (Nc), it can be used to construct the model of nitrogen critical concentration dilution curve of grape, which can further establish Nitrogen uptake model (Nupt) and Nitrogen Nutrition Index model (NNI) for quantitative diagnosis of nitrogen nutrition status of grapes under different water conditions.The results showed: there was a power function relationship between the nitrogen critical concentration and aboveground biomass of grape plants, which embodied as the nitrogen critical concentration, nitrogen uptake and aboveground biomass of grape plants all increased as the irrigation amount increasing. As nitrogen application increased, the biomass of grape plants under treatments of W1 and W2 increased, while that under W3 and W4, increased first and then decreased. Under the same water condition, the nitrogen concentration increased with the increase of nitrogen application and decreased with the progress of grapes growth. The established Nuptand NNI models can be used to effectively diagnose the deficiency of nitrogen nutrients in plants.
Grape; Nitrogen critical concentration; Nitrogen nutrition index; Nitrogen uptake; Dry matter accumulation
10.3969/j.issn.1000-6362.2019.08.005
李佳帅,杨再强,李永秀.不同水分条件下葡萄临界氮稀释曲线模型的建立及氮素营养诊断[J].中国农业气象,2019,40(8):523-533
2019−02−26
。E-mail:yzq@nuist.edu.cn
江苏省科技支撑项目(BE2015693)
李佳帅(1993−),女,研究方向为设施农业气象。E-mail:596993884@qq.com

