不同种属来源活化体系中CYP2A6 酶活及其对烟碱代谢的动力学
王蕙婷,李 翔,华辰凤,许良涛,赵 阁,尚平平,乔梁峻,赵俊伟,刘惠民,彭桂新,谢复炜*
1. 中国烟草总公司郑州烟草研究院,郑州高新技术产业开发区枫杨街2 号 450001
2. 河南中烟工业有限责任公司技术中心,郑州市经济技术开发区第三大街8 号 450000
CYP2A6 作为细胞色素P450 酶家族中的一员,主要表达于肝脏,约占细胞色素P450 的5%,主要参与烟碱及临床上常用的药物如甲硝唑、替加氟等的代谢[1-2],也在烟草特有亚硝胺NNK 和NNN 的代谢活化中起至关重要的作用[3]。烟碱是卷烟烟气中的重要活性成分,燃吸烟草时释放出的烟碱可使吸烟者的植物神经和中枢神经系统受到刺激,吸烟者通过摄入烟碱来维持血、脑中的烟碱水平,形成吸烟依赖行为[4-6],因此,烟碱是烟草依赖形成和维持的主要驱动力。研究表明,人体内约70%~80%的烟碱通过CYP2A6 催化的反应被代谢成可替宁[7](图1)。首先,CYP2A6 介导烟碱C-氧化为烟碱△1′(5′)-亚铵离子,再经细胞质醛氧化酶氧化成可替宁,可替宁再由CYP2A6 进一步催化形成反式-3′-羟基可替宁、5′-羟基可替宁和去甲可替宁。上述代谢途径表明,CYP2A6 是烟碱的主要代谢酶。研究发现,CYP2A6 活性在不同个体之间存在较大差异[8],且与正常吸烟者相比,CYP2A6 活性较低的吸烟者每天消费卷烟数量更少,体内较高的CYP2A6 酶活会使吸烟者消费卷烟量变大,暴露于更高浓度的致癌物中,从而导致肺癌风险增高[9-10]。因此该酶活性水平直接影响体内烟碱代谢速率及个体吸烟行为,从而导致暴露风险变化[11-12]。
不同种属间的药物代谢差异一直是药物研发的重点。有研究报道,不同种属对香豆素的代谢能力不同,表明CYP2A6 在种属间的表达存在显著差异[13-14],且CYP2A6 酶的基因是高度多态性的,迄今为止已经发现了40 多种变异,不同基因型的CYP2A6 酶活存在着明显差异[15-17],这些差异均可导致研究结果不同。目前国内外关于CYP2A6 酶活的报道主要集中于不同人群的CYP2A6 遗传表型及其与吸烟行为、相关癌症发病率的相关性研究[18-20],关于该酶在体外药物代谢模型应用方面的研究较少。有研究人员使用不同动物的肝微粒体或同源重组人工酶进行体外药物代谢研究[21-22],但不同种属间CYP2A6 酶蛋白表达水平及酶活性差异尚不明确。所以,在体外条件下探究不同来源活化体系中的CYP2A6 酶活对卷烟烟气的体外毒理学研究具有重要意义。因此,本研究中选取CYP2A6 重组酶、不同来源的人肝微粒体及药代动力学实验中常用的动物肝微粒体等进行CYP2A6 酶体外活性研究,以期为烟碱的体外毒理学评价提供数据支撑。

图1 烟碱主要代谢通路:由CYP2A6 及醛氧化酶依次催化成可替宁Fig.1 Metabolic pathway for nicotine catalyzed by CYP2A6 and aldehyde oxidase successively to cotinine
1 材料与方法
1.1 材料、试剂和仪器
支气管上皮细胞BEAS-2B 细胞、巨噬细胞、HepG2 细胞(中国科学院上海生命科学研究院细胞资源中心);CYP2A6 重组酶(EZ011)(0.5 mL,10 mg/mL)、无表达对照蛋白(EZ003)(0.5 mL,10 mg/mL)(英国Cypex 公司);25 供体混合性别人肝微粒体(X008064)(0.5 mL,20 mg/mL)、雄性SD大鼠(混合)肝微粒体(0.5 mL,20 mg/mL)、雄性恒河猴(混合)肝微粒体(0.5 mL,20 mg/mL)、雄性比格犬(混合)肝微粒体(0.5 mL,20 mg/mL)、雄性SD 大鼠(混合)肝S9(0.5 mL,20 mg/mL)(美国BioIVT 公司);男性混合人肝微粒体(0.5 mL,20 mg/mL)、NADPH 发生系统(汇智泰康生物技术有限公司)。
支气管上皮细胞基础培养基(Bronchial epithelial cell basal medium,BEBM)、SingleQuots 细胞因子(CC-3171,Clonetics)(美国Lonza 公司);改良Eagle 培养基(Dulbecco's modified of eagle's medium,DMEM)、胎牛血清、青链霉素混合液(生化级,美国Gibco 公司);胰酶(500 U/mg,美国Amresco 公司);甲酸铵(色谱纯,上海安谱实验技术股份有限公司);烟碱、烟碱-d3(NIC-d3)(色谱纯,加拿大TRC 试剂公司);氯化钾、磷酸二氢钾、氯化钠、七水合磷酸氢二钠(AR,天津凯通化学试剂有限公司);二甲基亚砜(DMSO,生化级,美国Amresco 公司);乙腈(色谱纯,美国J&T Baker 公司);蛋白分子量标准品(26617,美国Thermo Scientific 公司);兔抗一抗β-actin(ab8227)、兔抗一抗 GADPH(ab181602)、兔 抗 一 抗 CYP2A6(ab3570)(英国Abcam 公司);辣根过氧化物酶(Horseradish peroxidase,HRP)标记山羊抗兔二抗、增强化学发光法(Enhanced chemiluminescence,ECL)检测试剂盒(上海碧云天生物技术有限公司);哺乳动物蛋白提取试剂(Mammalian protein extraction reagent,78501,美国Thermo 公司)。
HERA Cell 240 细胞培养箱(美国Thermo 公司);SW-CJ-2FD 超净工作台(江苏省苏州安泰空气技术有限公司);细胞培养皿(430166,美国Corning 公司);TH4-200 显微镜(日本Olympus 公司);Nanodrop 2000 超微量紫外分光光度计(美国Thermo Fisher Scientific 公司);聚偏二氟乙烯(Polyvinylidene fluoride,PVDF)膜(美 国Merck Millipore 公司);AL204-IC 电子天平(感量0.000 1 g,瑞 士Mettler Toledo 公 司);Mini Trans-Blot Electrophoreti 蛋白免疫印迹小型Trans-Blot 转印槽(美国Bio-Rad 公司);Fluor Chem E 超灵敏全自动成像分析系统(美国Protein Simple 公司);3-18K高速冷冻离心机(德国Sigma公司);13 mm×0.22 μm有机相针式滤膜(上海安谱科学仪器有限公司);Milli-Q 超纯水纯化系统(美国Millipore 公司);1200 高效液相色谱仪(美国Agilent 公司);API 4000 液相色谱/质谱(HPLC/MS)联用仪(美国AB SCIEX 公司)。
1.2 方法
1.2.1 细胞培养
1.2.1.1 贴壁生长细胞培养
将BEAS-2B 细胞接种于含有BEBM 细胞培养基(加SingleQuots 细胞因子)的10 cm 培养皿中,置于37 ℃、5% CO2的培养箱内培养。观察细胞生长状况,在细胞生长汇合度达到80%后,用0.05%(体积百分比)胰酶消化,离心,弃去上清液;加入新鲜培养基,制成细胞悬液,并进行细胞培养。
HepG2 细胞所用培养基为含有10%(体积百分比)胎牛血清、100 U/mL 的青霉素和链霉素的DMEM 培养基,0.25%(体积百分比)胰酶消化,培养方法同上。
1.2.1.2 悬浮生长细胞培养
将巨噬细胞接种于含有10%(体积百分比)胎牛血清、100 U/mL 的青霉素和链霉素的DMEM 培养基的培养瓶中,置于37 ℃、5% CO2的培养箱内培养。观察细胞生长状况,在细胞生长至对数生长期时,离心,弃上清液,加入新鲜的培养基制成细胞悬液,传代并进行细胞培养。
1.2.2 免疫印迹法测定各体系中CYP2A6 蛋白表达水平
采用1.2.1 节所述方法对细胞进行培养,收获细胞于冰上裂解得到细胞全蛋白,肝微粒体及重组酶可解冻后直接进行实验。使用紫外分光光度计测量全蛋白浓度,调整电泳上样量均为20 μg 蛋白。制备5%(质量分数)的浓缩胶和8%~15%(质量分数)的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分离胶并对蛋白样品进行分离。使用转膜装置将蛋白质转印至PVDF 膜上(转膜电压100 V,转膜时间1 h)。将PVDF 膜于5%的脱脂奶粉溶液中室温封闭1 h,使用含Tween 20(0.05%)的三羟甲基氨基甲烷缓冲盐溶液(Tris-buffered saline and Tween 20,TBST)洗膜3 次,每次5 min,后与相对应的兔抗一抗于4 ℃下孵育过夜。次日使用TBST 洗膜3 次,每次5 min,后与HRP 标记的山羊抗兔二抗于室温中孵育1 h。使用TBST 洗膜3 次,每次5 min。然后使用ECL 进行显影,使用显影仪拍照。
1.2.3 烟碱代谢孵育方法
用KH2PO4缓冲液(0.1 mol/L,pH 7.4)将各体系蛋白液稀释至一定浓度,各反应体系为0.2 mL。根据实验设定精密量取烟碱标准品溶液加入反应体系中,37 ℃预孵育5 min 后,立即加入NADPH 发生系统启动反应。反应一定时间后,加入等体积含内标的乙腈终止反应,然后将孵育液涡旋3 min,4 ℃、13 000 r/min 离心20 min,取上清液过滤,进行HPLC-MS/MS 分析。以无表达对照蛋白组的孵育体系为阴性对照。进行3 次重复实验。
1.2.3.1 烟碱在各体系中的稳定代谢
孵育体系为0.2 mL,包含KH2PO4缓冲液、各活化体系(蛋白浓度0.5 g/L)、烟碱(200 ng/mL),37 ℃水浴中预孵育5 min 后,加入同法预孵的NADPH 溶液启动反应,继续于37 ℃水浴中孵育,并分别于0、5、10、15、30、45、60 min 取出,立即加入等体积含内标的乙腈溶液终止反应。将孵育液涡旋3 min,13 000 r/min 离心20 min,取上清液过滤,进样检测剩余烟碱的浓度。
1.2.3.2 目标代谢体系对烟碱的代谢动力学参数分析
A. 不同蛋白浓度下烟碱的代谢-时间曲线
根据稳定性代谢实验结果确定目标体系,将CYP2A6 重组酶代谢活化体系的蛋白终浓度调节为系列浓度(0.10、0.25、0.50、1.00 mg/mL),将雄性恒河猴(混合)肝微粒体及25 供体混合性别人肝微粒体代谢活化体系的蛋白终浓度均调节为系列浓度(0.10、0.25、0.50、1.00、1.50 mg/mL)。孵育体系中烟碱初始浓度为8 μg/mL。在37 ℃预孵育5 min 后,立即加入NADPH 溶液启动反应,每个浓度样品分别在孵育0、5、10、20、30、60、120 min 后用等体积含内标的乙腈终止反应,每个蛋白浓度及时间点平行操作3 管。对样品处理后进行HPLC-MS/MS 分析。以孵育后的底物浓度对孵育时间作图。
B. 酶动力学参数的测定
根据1.2.3.2 节A 项下方法所得结果,确定线性范围内的孵育时间点和蛋白浓度点,在此条件下测定酶动力学参数。在最佳蛋白浓度下的各体系中,分别加入不同浓度的烟碱,使其在孵育体系中的初始浓度分别为1、2、4、8、16、32、64 μg/mL,37 ℃预孵育5 min,加入NADPH 启动反应,37 ℃孵育至最佳孵育时间后,加入等体积含内标的乙腈终止反应,13 000 r/min 离心20 min,取上清液过滤后进行HPLC-MS/MS 分析,测定剩余烟碱的浓度,每个底物浓度平行操作3 管,按照Lineweaver Burk法计算米氏常数(Km)和最大反应速率(Vmax)[23]。
1.2.4 HPLC-MS/MS 检测方法
将得到的样品用滤膜过滤处理后进行HPLC-MS/MS 分析,分析条件:
色谱柱:Waters×Bridge C18柱(2.1 mm×150 mm,5.0 µm);柱温:25 ℃;进样量:10 µL;流速:0.30 mL/min;流动相:A 水(10 mmol/L 甲酸铵,用甲酸调节pH=3.0),B 乙腈,梯度洗脱(0~11 min,5%~70% A;11~13 min,70%~5% A;13~16 min,5% A);进样前,色谱柱平衡16 min。离子源:电喷雾电离(ESI);扫描模式:正离子扫描;碰撞气(CAD,N2):41.37 kPa(6 psi);雾化气(GS1,N2):344.75 kPa(50 psi);辅助加热气(GS2,N2):344.75 kPa(50 psi);气 帘 气(CUR,N2):68.95 kPa(10 psi);电喷雾电压:5 000 V;干燥温度:500 ℃;扫描时间:40 ms;检测模式:多反应监测(MRM)模式。
1.2.5 数据统计分析
实验结果重复3 次,数据以平均值±标准偏差表 征。 采 用Graphpad Prism 5.0 软 件(美 国GraphPad 软件有限公司)进行酶动力学参数分析。使用SPSS 13.0 软件(美国SPSS 公司)对数据组间差异进行统计分析,使用单因素方差分析法(One-way analysis of variance,ANOVA)对数据进行最小显著差异(Least significant difference,LSD)检验。P<0.05 时差异具有统计学意义。
2 结果与讨论
2.1 各体系中CYP2A6 蛋白表达水平
采用免疫印迹法检测相同蛋白上样量(20 μg)中各活化体系中CYP2A6 蛋白表达水平,结果如图2 所示,由HepG2 细胞、BEAS-2B 细胞和巨噬细胞(1、2 和3)中内参蛋白β-actin 与GADPH 的表达水平基本一致可判断免疫印迹实验中每组样品蛋白上样量一致。β-Actin 及GAPDH 广泛表达于细胞浆中[24-25],而重组酶在大肠杆菌中表达提取,故4 号体系中无内参蛋白表达。肝S9 由肝组织匀浆取上清液后制得,主要成分为微粒体和胞质组分,肝微粒体只含有内质网亚细胞组分[26],二者的制备过程均发生内参蛋白量的改变。所以内参蛋白β-actin 与GADPH 的表达水平在各体系中存在差异。因此,本研究中采用分光光度计调整各体系蛋白上样量均为20 μg,进行3 次独立实验。由图2 可知,与阴性对照组相比,CYP2A6 重组酶(以下简称重组酶)中CYP2A6 蛋白表达水平较高,25供体混合性别人肝微粒体(以下简称25 供体人肝微粒体)及男性混合人肝微粒中均有少量表达。由于该酶主要在肝脏表达,在呼吸系统及免疫系统表达较少且存在较大的个体差异性[27-31],故在BEAS-2B 细胞和巨噬细胞中均未检测到CYP2A6蛋白。而HepG2 细胞属于肝肿瘤细胞,其药物代谢酶活性远远低于正常肝细胞[32],因而在HepG2细胞中也未检测到CYP2A6 蛋白。由于种属差异,CYP2A6 酶在猴肝部的表达水平较高,而在犬肝部几乎不表达[33],故本实验中雄性恒河猴(混合)肝微粒体(以下简称猴肝微粒体)中CYP2A6蛋白表达水平明显高于雄性比格犬(混合)肝微粒体(以下简称犬肝微粒体)。关于CYP2A6 酶在大鼠体内的表达,有报道证明大鼠肝微粒体内含有CYP2A6 酶[34],也有研究认为CYP2A6 酶于大鼠肝微粒体几乎不表达[33],故于雄性SD 大鼠(混合)肝微粒体(以下简称大鼠肝微粒体)检测到少量的CYP2A6 蛋白,而不同来源的雄性SD 大鼠(混合)肝S9(以下简称大鼠肝S9)中则未检测到该蛋白。免疫印迹法测得的结果反映了各体系中CYP2A6 蛋白表达水平的高低,而各体系中CYP2A6 实际酶活性高低还需后续的代谢动力学实验进行测定。

图2 免疫印迹法测定各体系中的CYP2A6 蛋白表达水平Fig.2 Determination of CYP2A6 protein expression levels by immunoblotting
2.2 烟碱在各体系中的代谢稳定性
为了比较各活化体系对烟碱代谢能力的差异,分别在各体系中进行低浓度烟碱稳定代谢实验。结果表明不同体系对烟碱的代谢能力不同。从烟碱的稳定代谢曲线(图3a)可知,在各体系(蛋白浓度均为0.5 mg/mL)中,烟碱在30 min 内代谢较快,30~60 min 内剩余底物的浓度变化较小,趋于稳定。通过各体系在孵育2 h 后的烟碱代谢率(图3b),可更为直观地比较各体系对烟碱代谢能力的差异,且结合2.1 节结果发现,各体系烟碱代谢率与其CYP2A6 蛋白表达水平基本一致,其中,HepG2、BEAS-2B 及巨噬细胞中CYP2A6 蛋白表达水平及烟碱代谢能力最低,重组酶及猴肝微粒体中的CYP2A6 蛋白表达水平最高,对烟碱代谢能力最强。在CYP2A6 蛋白表达水平均较低的情况下,25 供体人肝微粒体的烟碱代谢能力明显高于男性混合肝微粒体及其他CYP2A6 蛋白表达水平相近的体系;免疫印迹结果表明,大鼠肝S9 中CYP2A6 表达水平明显低于大鼠肝微粒体及犬肝微粒体,但三者CYP2A6 酶中烟碱代谢率均约为10%。这些差异表明,除酶蛋白表达水平外,种属、性别及基因型的不同对代谢能力也存在显著影响[14,16,35]。通过比较CYP2A6 蛋白表达水平及其对烟碱代谢率发现,各体系中CYP2A6 酶活存在显著差异。CYP2A6 酶活高低对于卷烟烟气的其他成分的代谢活化过程是否有影响还需要进一步讨论。

图3 不同体系对烟碱代谢能力的比较Fig.3 Metabolic activity of nicotine in different systems
2.3 目标代谢体系对烟碱的代谢-时间曲线
按照1.2.3.2 节A 项下的方法测得数据,为进一步探究各体系实际酶活性,将烟碱代谢率最高的3 个体系(CYP2A6 重组酶、猴肝微粒体及25 供体人肝微粒体)作为目标体系进行代谢动力学参数的测定。以不同孵育时间对目标体系中剩余烟碱浓度绘制不同蛋白浓度下的孵育时间曲线(图4)。由不同蛋白浓度下重组酶代谢-时间曲线(图4a)可知,当重组酶蛋白浓度为0.5 mg/mL 时,孵育10 min 内有良好线性。表明在测定CYP2A6 重组酶的代谢动力学参数时,应使用0.5 mg/mL 的蛋白浓度,与烟碱共孵育10 min。由25 供体人肝微粒体的代谢-时间曲线(图4b)分析可知,在孵育时间10 min 内,1.0 mg/mL 及1.5 mg/mL 蛋白浓度下的孵育时间曲线较为接近,且均具有良好的线性,在满足代谢现象明显且尽量降低体系蛋白浓度的原则下,25 供体人肝微粒体的最佳孵育条件为蛋白浓度1.0 mg/mL,孵育10 min。基于此原则分析猴肝微粒体(图4c)的代谢-时间曲线,可得其孵育条件应设置为蛋白浓度1.0 mg/mL、孵育10 min。

图4 不同蛋白浓度下各目标体系的烟碱代谢-时间曲线Fig.4 Metabolic-time curves of nicotine in target systems at different protein concentrations
2.4 目标代谢体系对烟碱代谢的动力学参数
因动力学参数的测定需要确定该体系对底物的最佳孵育时间及酶浓度,即其代谢-时间曲线在线性范围内的孵育时间及蛋白浓度,从而在此条件下进行酶动力学参数的测定。故由2.3 节的代谢-时间曲线可得,重组酶、25 供体人肝微粒体及猴肝微粒体的最佳线性孵育蛋白浓度分别为0.5、1.0、1.0 mg/mL,最佳线性孵育时间均为10 min。在此条件下测定系列烟碱浓度下的烟碱代谢速度,并以烟碱代谢速度与其初浓度做浓度孵育曲线(图5)。计算的3 个体系的Km值和Vmax值结果如表1 所示。
代谢动力学参数表明,重组酶及猴肝微粒体中CYP2A6 酶的Km及Vmax值较为接近,25 供体人肝微粒体中CYP2A6 酶Km及Vmax值较低。较低的Km值表明该CYP2A6 酶对烟碱代谢亲和力强。结合免疫印迹实验结果分析,重组酶及猴肝微粒体中CYP2A6 酶Vmax值基本与其酶蛋白表达水平正相关。而在25 供体人肝微粒体中,CYP2A6 蛋白表达水平较低,但Vmax值与CYP2A6 重组酶及猴肝微粒体较为接近,该结果表明25 供体人肝微粒体中CYP2A6 的酶活显著高于CYP2A6 重组酶及猴肝微粒体。这种酶活性的差异与其种属有关[14]。综合比较各目标体系,25 供体人肝微粒体及猴肝微粒体不仅对烟碱代谢活性较高,且均富含大量的P450 酶及其他代谢酶[36-39],在体外药物代谢研究领域中应用范围较广。而同源重组CYP2A6 酶的活性最高,在烟碱的体外代谢研究及烟气的体外毒性评价中具有较强的适用性。但与肝微粒体体系相比,酶种类单一,且代谢机制仍需进一步探索研究。
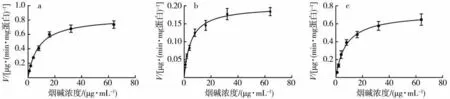
图5 线性条件下各目标体系的烟碱浓度-孵育曲线Fig.5 Incubation curves of nicotine in target systems under optimum linear conditions

表1 各体系代谢动力学参数Tab.1 Metabolic kinetic parameters of target systems
3 结论
①10 种活化体系中CYP2A6 酶活具有明显差异,烟碱在与25 供体混合性别人肝微粒体、同源重组CYP2A6 酶及雄性恒河猴肝微粒体共孵育时其浓度明显降低,而另外7 种则无CYP2A6 活性或活性较低。 ②CYP2A6 的蛋白表达水平与CYP2A6 酶活具有一定的相关性,对目标活化体系进行CYP2A6 蛋白相对定量及代谢动力学研究可为烟气体外毒理学评价中代谢活化体系的筛选提供依据。

