5-羟色胺2A受体基因多态性与肺癌患者疼痛发生及阿片类药物需求量的相关性研究Δ
刘贝,华敏,刘尧,孙媛媛,申文#(.徐州医科大学附属医院疼痛科,江苏徐州22004;2.徐州医科大学江苏省麻醉与疼痛应用技术重点实验室,江苏徐州 22002)
全球每年癌症新发患者众多,据世界卫生组织(WHO)统计数据显示,预计到2020年,癌症新发病例将超过1 500万人[1]。疼痛是癌症患者常见的临床症状,晚期癌症患者的疼痛发生率可高达70%~90%[2]。尽管临床针对癌痛的治疗方法很多,但大部分患者难以获得满意的镇痛效果。有研究指出,不同个体的疼痛敏感性和药物镇痛效果有所差异,而上述差异可能与环境因素及患者的遗传特征有关[3]。5-羟色胺(5-HT)是一种重要的神经递质,当其被相应受体介导后,便可参与痛觉等生理活动的调节[4]。5-羟色胺2A受体(5-HT2AR)编码基因(5-HT2AR)定位于人染色体13q14~21,包括3个外显子和2个内含子,长约 20 kb[5]。其中,rs6313(102C/T)位于第1外显子,该位点突变虽不引起编码氨基酸的改变,但可能与患者疼痛个体差异和阿片类药物需求量有关[6-7]。Polesskaya OO等[8]研究发现,正常人颞叶皮质5-HT2AR基因rs6313位点C等位基因mRNA及编码蛋白的表达量均低于T等位基因,这可能是导致患者个体疼痛敏感性及阿片类药物需求量差异的主要原因。为此,本研究拟分析5-HT2AR基因rs6313位点多态性与肺癌患者疼痛发生的相关性,并进一步探讨其对患者阿片类药物需求量的影响,以期为实现肺癌患者个体化基因靶向镇痛治疗提供参考。
1 资料与方法
1.1 纳入与排除患者
1.1.1 肺癌患者 纳入标准:(1)经病理学和/或细胞学诊断为肺恶性肿瘤(不限定肿瘤分期及分型);(2)年龄为18~80岁,性别不限;(3)神志清楚,不存在交流障碍;(4)汉族(不限定区域)。排除标准:(1)曾患有或现患有严重精神疾病或神志不清者;(2)患有严重心、脑血管等中枢系统疾病者;(3)伴有中、重度肝肾功能损伤者;(4)不能进行自我评估者;(5)合并其他慢性疼痛者;(6)研究过程中自行退出和病情突然恶化者。
1.1.2 健康者 纳入标准:(1)在徐州医科大学附属医院体检中心进行体检的健康者;(2)签署知情同意书;(3)年龄为18~80岁,性别不限;(4)汉族(不限定区域)。排除研究过程中自行退出或拒绝配合者。
1.2 研究对象
本研究方案经医院医学伦理委员会审核批准(伦理批件号:XYFY2015-KL002-01),所有受试者或其家属均已知情并签署了知情同意书。选取2017年12月-2018年6月在徐州医科大学附属医院就诊的经病理学和/或细胞学诊断为肺恶性肿瘤的患者,作为肺癌组(332例,非连续入组);据其是否伴有疼痛分为疼痛组(177例,男性120例、女性57例)和无痛组(155例,男性102例、女性53例)。另选取同一时期于该院进行体检的健康者,作为对照组(116例,男性72例、女性44例)。各组受试者均无血缘关系。
1.3 样本采集与疼痛评估
于入院当日记录所有受试者的一般资料,包括性别、年龄、身高、体质量、病理类型、TNM分期等。采用视觉模拟评分法(VAS)评估肺癌疼痛组患者的疼痛程度,首次评分记为其用药前VAS评分。VAS评分标准:0分为无痛,1~3分为轻度疼痛,4~6分为中度疼痛,7~10分为重度疼痛[9]。
1.4 疼痛治疗
肺癌疼痛组患者的药物治疗及方案调整均严格遵循《欧洲癌痛阿片类药物镇痛指南》[10],并以治疗后VAS评分≤3分为“镇痛效果满意”[11]。记录患者镇痛效果满意时的阿片类药物日均需求量,按“曲马多(口服制剂)200 mg/d=羟考酮(口服制剂)30 mg/d=芬太尼(透皮贴剂)25 μg/d=吗啡(静脉注射/皮下注射制剂)20mg/d=吗啡(口服制剂)60 mg/d”的标准[10]换算为每日等效吗啡口服剂量(MEDD)。
1.5 基因型检测
采用聚合酶链反应-限制性片段长度多态性方法(PCR-RFLP)对所有受试者的基因型进行检测。
1.5.1 DNA提取 抽取所有受试者外周静脉血2 mL,于-80℃冰箱保存,备用。取上述血样500 μL,采用树脂型TM基因组DNA提取试剂盒(上海赛百盛基因技术有限公司)提取患者DNA,使用NanoDrop 2000型紫外分光光度计[赛默飞世尔科技(中国)有限公司]检测其DNA浓度和纯度。
1.5.2 引物设计与合成 PCR引物的设计与合成由生工生物工程(上海)股份有限公司完成。上游引物:5′-TCTGCTACAAGTTCTGGCTT-3′,下 游 引 物 :5′-CTGCAGCTTTTTCTCTAGGG-3′。
1.5.3 PCR扩增 采用TProfessional Standard型高性能梯度PCR仪(德国Whatman Biometra公司)进行扩增。PCR反应体系(共25 μL):DNA模板2 μL,上、下游引物各1 μL,2×Taq Master Mix 12.5 μL,无核酶水8.5 μL。PCR反应条件:94℃预变性5 min,94℃变性30 s,62℃退火30 s,72℃延伸30 s,共35个循环;72℃再延伸10 min。
1.5.4 酶切 将PCR扩增产物采用限制性核酸内切酶MspⅠ[12]进行酶切,酶切反应体系(共31 μL):PCR产物10 μL、10×Buffer Tango 2 μL、MspⅠ酶1 μL、焦碳酸二乙酯(DEPC)水18 μL,于37 ℃的SHP-080型高阶恒温箱[赛默飞世尔科技(中国)有限公司]中酶切3~6 h。其中,T等位基因不能被限制性核酸内切酶切断,片段大小为342 bp;C等位基因可被限制性核酸内切酶切断,片段大小为126、216 bp;各基因型酶切产物片段大小——野生型纯合子(CC):126、216 bp,突变型杂合子(CT):126、216、342 bp,突变型纯合子(TT):342 bp[13]。酶切完成后,将各酶切产物置于2%琼脂糖凝胶中进行电泳(电压:120 V,时间:45 min),使用ChemiDoc XRS+型凝胶成像分析系统(美国Bio-Rad公司)拍照。
1.5.5 验证 随机抽取不同基因型的PCR产物采用Sanger测序法进行验证,由生工生物工程(上海)股份有限公司完成。
1.6 统计学方法
采用SPSS 23.0和Graphpad Prism 5.0软件对数据进行统计分析。采用Kolmogorov-Smirnov法进行正态性检验,符合正态分布的计量资料以±s表示,组间比较采用单因素方差分析;不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用Kruskal-Wallis检验;计数资料以例数及率表示,组间比较采用χ2检验。采用χ2检验分析受试者基因型频率是否符合Hardy-Weinberg平衡;采用Hosmer-Lemeshaw检验评价模型拟合度,采用二元Logistic回归分析对肺癌疼痛发生的影响因素进行评价。检验水准α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
3组受试者的性别、年龄、身高、体质量等一般资料比较,差异均无统计学意义(P>0.05),具有可比性,详见表1。

表1 3组受试者一般资料比较Tab 1 Comparison of general data of subjects among 3 groups
2.2 基因型与等位基因频率分布
本研究共检出5-HT2AR基因rs6313位点CC、CT、TT等3种基因型,各基因型酶切产物片段大小分别为126、216 bp(CC型),126、216、342 bp(CT型),342 bp(TT型),详见图1。经验证,Sanger测序结果与PCR-RFLP方法基因型鉴定结果一致,详见图2。

图1 rs6313位点酶切产物凝胶电泳图Fig 1 Gel electrophoresis of rs6313 locus enzyme products
各组受试者5-HT2AR基因rs6313位点CC、CT、TT型和T、C等位基因频率分布均符合Hardy-Weinberg平衡(P>0.05),表明本研究纳入的对象可代表整个群体的分布情况。同时,肺癌组患者5-HT2AR基因rs6313位点CC、CT、TT型和T、C等位基因频率与对照组比较,差异均无统计学意义(P>0.05),详见表2。
2.3 肺癌患者疼痛发生相关因素分析
以肺癌患者是否疼痛为应变量,患者性别、年龄、身高、体质量、病理类型、TNM分期、rs6313基因型等因素为自变量进行二元Logistic回归分析,各自变量赋值——性别:男=0,女=1;TNM分期:Ⅰ~Ⅱ=0,Ⅲ~Ⅳ=1;基因型:CC=1,CT=2,TT=3;病理类型:鳞癌=1,腺癌=2,小细胞癌=3,其他=4。分析结果显示,模型拟合度良好(Hosmer-Lemeshaw 检验:χ2=13.811,P=0.087>0.05)。其中,TNM分期(Ⅲ~Ⅳ期)对肺癌患者疼痛发生有影响[比值比(OR)=3.661,95%置信区间(CI)(1.972,6.797),P<0.001],是肺癌疼痛发生的危险因素,而rs6313位点基因型及性别、年龄等其他因素与肺癌患者疼痛的发生无关(P>0.05),详见表3[表中,(1)、(2)、(3)等表示哑变量,哑变量个数=自变量水平数减1]。
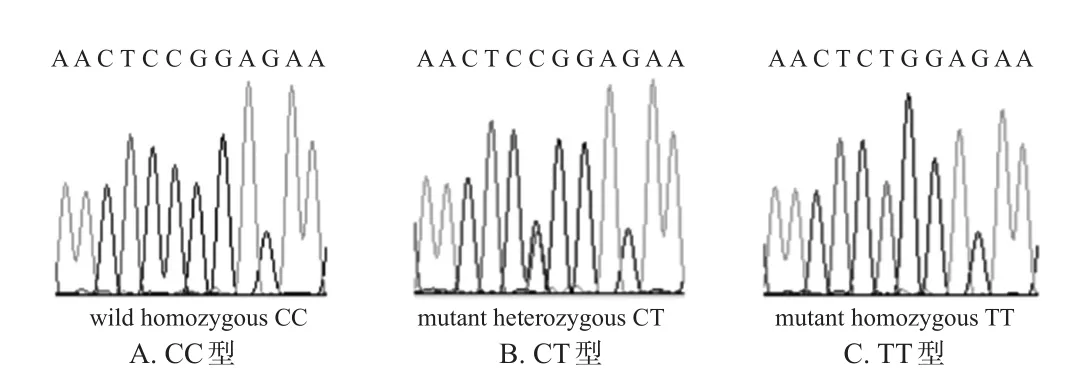
图2 rs6313位点基因型测序图(Sanger测序法)Fig 2 Genotype sequencing diagram of rs6313 locus(Sanger sequencing)
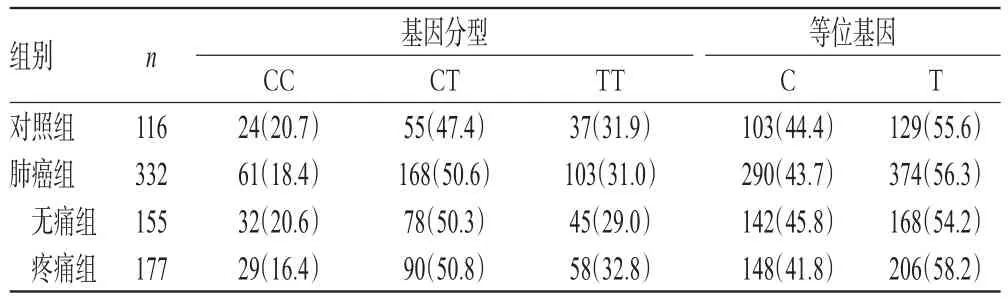
表2 各组受试者rs6313位点基因型及等位基因分布[例(%%)]Tab 2 Distributions of genotype and allele of rs6313locus in subjects of each group[cases(%%)]

表3 肺癌患者疼痛发生相关因素的二元Logistic回归分析Tab 3 Binary Logistic regression analysis of pain-related factors in patients with lung cancer
2.4 基因型与肺癌疼痛组患者疼痛程度的相关性
根据用药前VAS评分将肺癌疼痛组患者分为轻度疼痛、中度疼痛和重度疼痛组等3个亚组,对其临床特征和基因型与疼痛程度的相关性进行分析。结果,3个亚组患者的性别、年龄、身高、体质量、病理类型、TNM分期等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。3个亚组患者各基因型频率比较,差异均无统计学意义(P>0.05),详见表4。
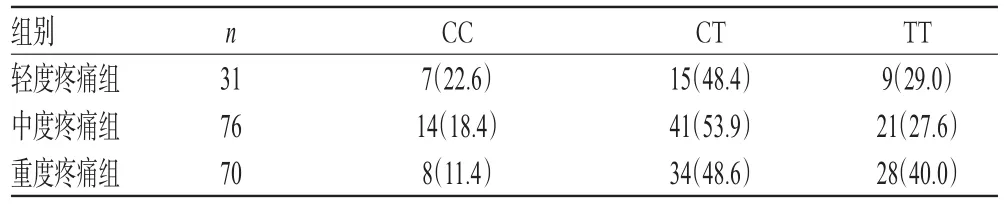
表4 不同疼痛程度患者rs6313位点基因型分布比较[例(%%)]Tab 4 Comparison of rs6313 locus genotype in patients with different pain levels[cases(%%)]
2.5 基因型与肺癌疼痛组患者阿片类药物需求量的相关性
Kruskal-Wallis检验结果显示,3个亚组不同基因型患者MEDD比较,差异均无统计学意义(P>0.05),详见表5。
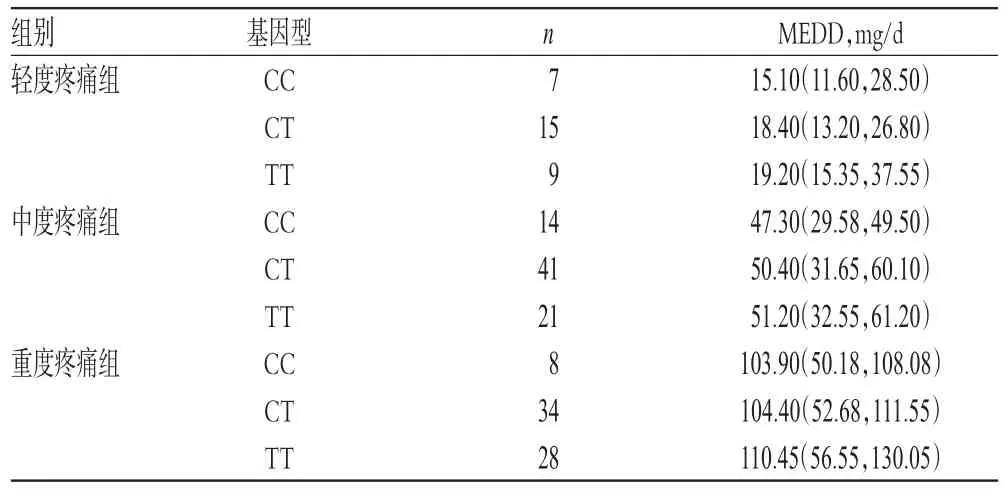
表5 不同基因型肺癌疼痛患者MEDD比较[M(P25,P75)]Tab 5 Comparison of MEDD among lung cancer pain patients with different genotypes[M(P25,P75)]
3 讨论
疼痛严重影响恶性肿瘤患者的生存质量[14]。基因组学的相关研究发现,基因的遗传学变异可以有助于预测和指导癌症患者的疼痛反应及个体化镇痛治疗[15]。随着对疼痛遗传学研究的不断深入,学者发现与疼痛有关的多态性位点主要是通过造成神经系统电活动异常、神经肽及神经递质释放的改变以及药物代谢酶与药物转运体功能异常等途径来参与疼痛调节[16]。研究表明,基因编码区多态性虽不导致氨基酸的改变,但仍可通过改变mRNA的稳定性、剪接或定位来影响基因的整体功能[17]。因此,如何解释这些静息型多态性对个体疼痛差异的影响也是未来疼痛遗传学研究关注的热点之一。
5-HT2AR是与磷脂酶相关的G蛋白偶联受体,是由1 413个核苷酸开放阅读框架编码的471个氨基酸组成,其本质是糖蛋白。目前发现的5-HT2AR基因有6种多态性,其中rs6313为静息型,突变率为60%,是该基因多态性位点中突变率最高的一种[18]。有研究发现,与其他基因型患者比较,TT型患者对疼痛的敏感性更高;其机制可能是TT型可表达更高水平的mRNA及编码蛋白,可激活更多的5-HT2AR,而活化后的5-HT2AR可进一步激活磷脂酶C,并将其降解为三磷酸肌醇(IP3)和二酰基甘油(DAG),以促进更多的钙离子(Ca2+)流入细胞内,提高细胞的兴奋性,加快疼痛信号的传递[6,19]。此外Ozdemir E等[20]研究发现,5-HT2AR拮抗剂可抑制吗啡耐受现象的发生,并可提高吗啡等阿片类药物的镇痛效果,但这种作用的确切生理机制尚未完全阐明。为此,本研究初步探讨5-HT2AR基因rs6313位点多态性与疼痛发生及阿片类药物需求量的相关性。
本研究选取了发病率和病死率均较高的肺癌,以减少肿瘤类型对个体疼痛差异的影响;以MEDD作为考察指标,以保证使用不同镇痛方案患者间的可比性[21];同时,本研究采用经典的PCR-RFLP技术,并借助Sanger测序法予以验证,以确保分型检测结果更为可靠。本研究结果显示,各组受试者5-HT2AR基因rs6313位点CC、CT、TT型频率分别为20.7%、47.4%、31.9%(对照组),20.6%、50.3%、29.0%(无痛组),16.4%、50.8%、32.8%(疼痛组),C、T等位基因频率分别为44.4%、55.6%(对照组),45.8%、54.2%(无痛组),41.8%、58.2%(疼痛组),与Aoki J等[6]的研究结果基本一致。肺癌组与对照组受试者基因型频率和等位基因频率比较,差异均无统计学意义。这提示该基因位点多态性在肺癌患者及健康人群中的分布并无明显差异。
一项多中心观察性研究发现,患者肺癌疼痛的发生可能与其疾病发展程度等临床特征相关[22],故本研究对与之可能相关的因素(如性别、年龄、病理类型、TNM分期及基因型等)进行了二元Logistic回归分析。结果显示,患者的性别、年龄、身高、体质量、病理类型、rs6313位点基因型等因素均与肺癌患者疼痛的发生无关;而TNM分期是肺癌患者疼痛发生的独立危险因素,与上述研究[22]结果基本一致。本研究并未发现5-HT2AR基因rs6313位点多态性与肺癌患者疼痛发生的相关性,笔者认为这可能与该位点多态性增加了外周5-HT2AR的含量、降低了中枢5-HT2AR的含量以及下调受体敏感性有关,但其分子机制仍有待进一步确证。此外,本研究考察了患者基因型与其疼痛程度的相关性,结果并未发现5-HT2AR基因rs6313位点多态性与患者癌痛程度相关。Aoki J等[6]发现,5-HT2AR基因rs6313位点多态性与个体疼痛差异显著相关;Pata C等[23]比较不同rs6313基因型肠易激综合征(IBS)患者的临床资料发现,TT型患者疼痛阈值较其他基因型患者更低;Gürsoy S等[7]比较发现,TT型纤维肌痛患者的VAS评分较其他基因型患者更高,TT型患者的个体疼痛阈值低于CT和CC基因型;然而,Tander B等[24]发现,5-HT2AR基因rs6313位点多态性与纤维肌痛无关,并不会影响患者疼痛感知。由此可见,该位点多态性与疼痛程度的相关性研究结论尚不一致,这可能与受试人群种族及疾病类型差异有关。Aoki J等[6]指出,与5-HT2AR基因rs6313位点CT、CC型携带者比较,TT型携带者对芬太尼、吗啡等阿片类药物的需求量更大。但本研究并未发现该多态性与肺癌疼痛患者阿片类药物MEDD的相关性,这可能与本研究纳入的样本量有限有关;此外,由于疼痛基因遗传学作用机制复杂,不排除多种因素(如不同地域、基因相互作用等)的共同作用[25],故本研究结果尚有待进一步确证。
综上所述,5-HT2AR基因rs6313位点多态性与肺癌患者疼痛的发生及阿片类药物的需求量无关,其多态性可能不是导致肺癌患者疼痛个体差异的主要原因。但本研究为单中心研究,仅初步探讨了对5-HT2AR功能有影响的单个基因多态性,且样本量不大,同时并未考虑该基因的其他位点或其他疼痛相关基因遗传变异的影响,故本课题组下一步将研究基因之间的交互作用,联合多个基因进行筛选,并结合疾病状态从相关基因mRNA及蛋白质表达水平进一步深入探讨。

