斑翅果蝇气味结合蛋白OBP56h与小分子化合物的结合特征
李都,牛长缨,李峰奇,罗晨
斑翅果蝇气味结合蛋白OBP56h与小分子化合物的结合特征
李都1,2,牛长缨1,李峰奇2,罗晨2
(1华中农业大学植物科学技术学院,武汉 430070;2北京市农林科学院植物保护环境保护研究所北方果树病虫害绿色防控北京市重点实验室,北京 100097)
【】克隆斑翅果蝇()气味结合蛋白56h(odorant binding protein 56h,OBP56h)基因,诱导表达斑翅果蝇OBP56h重组蛋白(DsuzOBP56h),研究其与小分子化合物的结合特性。【】通过RT-PCR并设计特异性引物克隆斑翅果蝇ORF全长,从NCBI数据库中下载相似度高的昆虫气味结合蛋白序列,进行序列比对和分析。以Ⅰ和Ⅰ为酶切位点,将OBP56h连入pET-30a(+)原核表达载体,将重组质粒转入BL21(DE3)大肠杆菌感受态细胞。扩大培养阳性菌株,并用IPTG诱导表达DsuzOBP56h重组蛋白。收集菌液,通过超声波破碎细胞得到蛋白,利用Ni-NTA柱纯化蛋白,进行Tris-HCl透析,用BCA法测定蛋白浓度。蛋白用50 mmol·L-1Tris-HCl(pH 7.4)稀释至终浓度2 μmol·L-1,配基用色谱级甲醇稀释至终浓度1 mmol·L-1,以4,4′-二苯胺基-1,1′-联萘-5,5′-二磺酸二钾盐(4,4′-dianilino-1,1′-binaphthyl-5,5′-disulfonic acid dipotassium salt,bis-ANS)荧光探针为报告子,利用荧光竞争结合试验检测DsuzOBP56h蛋白与18种候选小分子化合物配基的结合特性。【】克隆获得了斑翅果蝇的ORF全长,共405 bp,N-端含有19个氨基酸组成的信号肽,具有6个保守半胱氨酸位点,符合OBP的典型特征,与其同属的黑腹果蝇OBP56h进化关系最近。成功连入pET-30a(+)表达载体,在1 mmol·L-1IPTG、28℃条件下诱导DsuzOBP56h蛋白表达,并过柱纯化得到目的蛋白。荧光光谱试验显示,荧光探针bis-ANS与DsuzOBP56h的解离常数为0.9568 μmol·L-1,适合作为本试验中竞争性荧光结合试验的报告子;进一步的荧光竞争结合试验表明,在18种候选配基中,苦味物质盐酸小蘖碱和香豆素与DsuzOBP56h的结合亲和性较强,解离常数分别为12.16和17.93μmol·L-1,柚皮素与DsuzOBP56h的解离常数为25.32 μmol·L-1,草莓叶片产生的一种对斑翅果蝇具有吸引作用的挥发性气味物质-环柠檬醛也能与DsuzOBP56h结合,其解离常数为31.37 μmol·L-1。【】斑翅果蝇气味结合蛋白OBP56h能与测试的多种植物苦味物质和挥发性气味物质结合,表明DsuzOBP56h很有可能参与斑翅果蝇对食物味觉和嗅觉的识别行为,研究结果可为理解斑翅果蝇的取食行为提供理论依据,并为开展斑翅果蝇的生态防控提供新思路。
斑翅果蝇;气味结合蛋白;原核表达;竞争结合
0 引言
【研究意义】斑翅果蝇()是双翅目(Diptera)果蝇科(Drosophilidae)果蝇属()昆虫,雌虫特化有锯齿状产卵器,可将卵直接产于成熟或即将成熟的草莓、蓝莓、树莓、樱桃、葡萄、桃等果皮较软的果实内,幼虫在果实内取食,给水果产业造成严重损失[1-2]。研究斑翅果蝇嗅觉相关蛋白与取食果品相关小分子化合物的识别结合机理,对深入认识该虫的取食选择和产卵定位以及进一步建立斑翅果蝇的生态防控技术具有重要理论意义。【前人研究进展】昆虫气味结合蛋白(odorant binding protein,OBP)分布于感器淋巴液,气味分子经OBP识别后运输至感觉神经元膜上刺激气味受体,引发动作电位,进而影响昆虫相关行为反应[3],因此OBP是嗅觉系统中识别化学物质的第一步,对昆虫接收外界化学信息至关重要[4-6]。双翅目昆虫中对OBP蛋白的功能研究多为其与不同化合物的结合特性[7-8]。果蝇属昆虫大多数种类以腐烂水果为寄主,在上面取食和产卵,因而对水果产业危害不大,而斑翅果蝇不同,虽然也喜食腐烂水果,但在产卵时更喜欢以即将成熟的水果为寄主[9],对水果品质和产量危害巨大。斑翅果蝇1916年最先报道于日本,后陆续被多国报道,自2008年在欧美地区暴发以来,对软皮水果产业造成了严重威胁。在我国山东、湖北、河南、广西、云南等22个省(自治区)均有发现,其发生危害呈加重和蔓延趋势,国内关于斑翅果蝇的研究十分滞后,亟需加强[10-11]。目前,斑翅果蝇的防治方法主要以化学防治为主,但由于该虫卵和幼虫在果实内,化学防治有很大局限,且不利于环境保护和食品安全。基于昆虫行为学习性的生态调控是控制害虫种群的有效措施。基于果蝇对腐烂水果的趋性,以发酵产物如苹果醋、酒、酵母等为诱饵对斑翅果蝇进行防控具有很好的效果[12-13],但也会诱到其他种类的果蝇和寄生性天敌[14]。Feng等[15]根据新鲜和发酵苹果汁的气味发现,乙偶姻、辛酸乙酯、乙酸、乙酸乙酯和苯乙醇5种化合物组成的混合液对斑翅果蝇的引诱更有效,更有针对性。此外,利用驱避剂防止害虫危害,也是一种有效措施;Wallingford等[16]研究发现,二甲萘烷醇和1-辛烯-3-醇对斑翅果蝇具有趋避作用。昆虫对物质的正反趋向行为都与其寄主选择有关,明确斑翅果蝇的寄主选择机制,将有利于开发更加有效、更有针对性的引诱剂或驱避剂,对于斑翅果蝇的防治至关重要。【本研究切入点】黑腹果蝇()中气味结合蛋白的研究较为深入,其中在嗅觉和味觉感受器均有表达[17],且在味觉中具有重要作用[18],而斑翅果蝇的相关研究尚未见报道,推测斑翅果蝇OBP56h在其取食行为中具有重要作用。本研究通过克隆斑翅果蝇,采用原核表达和荧光竞争结合试验,研究其与18种小分子化合物的结合特性。【拟解决的关键问题】研究斑翅果蝇OBP56h与相关化合物的结合特性,解析其在斑翅果蝇定位和取食行为中的作用,为斑翅果蝇的生态调控技术提供新的思路和理论依据。
1 材料与方法
试验于2018年6—12月分别在华中农业大学和北京市农林科学院进行。
1.1 供试昆虫
斑翅果蝇采自湖北省十堰市,在华中农业大学植物科学技术学院建立室内种群,用香蕉和人工饲料饲养于人工气候箱[19],温度为(25±1)℃,相对湿度为(70±5)%,光周期L﹕D=16 h﹕8 h。
1.2 主要试剂
总RNA提取RNAiso Plus、反转录试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser、pMD18-T载体、限制性核酸内切酶、T4 DNA连接酶购自TaKaRa公司。Trans 5、BL21 (DE3)感受态细胞、IPTG、卡那霉素、胶回收试剂盒EasyPure Quick Gel Extraction Kit、质粒提取试剂盒EasyPure Plasmid MiniPrep Kit等购自北京全式金公司。bis-ANS及配体小分子化合物购自Sigma-Aldrich公司和欣博盛公司。
1.3 总RNA提取及cDNA第一链的合成
取羽化5—7 d的斑翅果蝇雌雄成虫各10头,于液氮中速冻,参照RNAiso Plus说明书进行总RNA的提取。cDNA的合成采用PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒,取2 μL gDNA Eraser Buffer、1 μL gDNA Eraser、1 μg RNA,加RNase Free dH2O至10 μL,42℃ 2 min后放冰上,加PrimeScript RT Enzyme Mix 1 μL、RT Primer Mix 1 μL、PrimerScript Buffer 4 μL、RNase Free dH2O 4 μL。反应条件:37℃ 15 min,85℃ 5 s。合成的cDNA保存于-20℃备用。
1.4 斑翅果蝇OBP56h克隆及序列分析
从斑翅果蝇基因组数据库(http://spottedwingflybase. org/)分析序列(数据库基因 ID:DS1000009134,GenBank登录号:XM_017086371.1),用在线网站(http://www.cbs.dtu.dk/services/SignalP/)进行信号肽预测。根据该序列用Primer Premier 5设计去信号肽序列引物并加上Ⅰ和Ⅰ酶切位点(下划线表示)。上下游引物分别为:5′-GGAATTCG ATTCGGACTTCCGGCAG-3′;5′-CCGGTG ATGTCCTGGCATGGC-3′。
用高保真酶进行PCR扩增:5×PrimeSTAR Buffer10 μL、dNTP Mixture 4 μL、上下游引物各1 μL、cDNA 0.5 μL、PrimeSTAR HS DNA Polymerase 0.5 μL、ddH2O 33 μL。PCR程序为94℃ 3 min,94℃ 15 s、60℃ 5 s、72℃ 1 min共30个循环,72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测,回收目的片段,连入pMD18-T克隆载体,经菌液PCR鉴定后进行测序验证。
从NCBI数据库下载相似度较高的昆虫气味结合蛋白的序列,包括黑腹果蝇OBP56h(ABW78078.1)、橘小实蝇()OBP56h(AKI29012.1)、铜绿蝇()OBP56h(KNC21653.1)、葱蝇()OBP4(BAI82444.1)、灰地种蝇()OBP4(BAS69444.1)、柑橘大实蝇()OBP56g(AYN70642.1)、柑橘大实蝇OBP56h1(AYN70643.1)、枣实蝇()OBP1(AMY98992.1)、华北大黑鳃金龟()OBP10(AZK90214.1)和南亚实蝇()OBP56h(ALS40429.1),利用软件MEGA 5中的ClustalW和Maximum Likelihood方法分别进行序列比对和系统发育树构建。
1.5 斑翅果蝇OBP56h重组蛋白的原核表达和蛋白纯化
将的阳性克隆质粒与pET-30a (+)表达载体同时用Ⅰ和Ⅰ进行双酶切,用T4 DNA连接酶进行连接,并转化至5感受态细胞中,经菌液PCR与质粒双酶切验证后,将阳性质粒转入大肠杆菌BL21 (DE3)感受态细胞中。挑选阳性菌培养至OD600为0.4—0.6,加入终浓度为1 mmol·L-1的IPTG,28℃,180 r/min诱导蛋白表达10 h。 离心收集菌体,加入细菌裂解液,进行超声波破碎(工作30 min,其中破碎3 s,停5 s)。破碎后离心收集上清和沉淀,经SDS-PAGE电泳检测蛋白表达情况。
将蛋白上清加入HisTrap亲和层析柱,用梯度咪唑缓冲液(0、20、50、100、250、500 mmol·L-1)洗脱,将目的蛋白洗脱液于50 mmol·L-1Tris-HCl(pH 7.4)进行透析24 h,用SDS-PAGE进行蛋白检测,用BCA法测定蛋白浓度。
1.6 斑翅果蝇OBP56h蛋白的配基结合试验
以bis-ANS作为OBP56h荧光竞争结合试验探针,并将所选用的配基,用色谱级甲醇稀释至终浓度1 mmol·L-1,蛋白用50 mmol·L-1Tris-HCl(pH 7.4)稀释至终浓度2 μmol·L-1。荧光分光光度计激发波长设为295 nm,扫描范围300—550 nm,向装有蛋白的石英皿中逐渐加入bis-ANS使其趋近饱和,根据Scatchard[20]方程,测定OBP56h和荧光探针bis-ANS的结合解离常数Kbis-ANS。在石英皿中加入OBP56h和bis-ANS(终浓度均为2 μmol·L-1),逐渐加入配基,测定OBP56h和配基的结合能力,计算解离常数Ki,公式为Ki=[IC50]/(1+[bis-ANS]/Kbis-ANS),其中[IC50]为荧光强度降低一半时的配基浓度,[bis-ANS]为游离的bis-ANS浓度。
2 结果
2.1 斑翅果蝇OBP56h克隆及序列分析
经总RNA提取、cDNA合成、PCR扩增及测序后,得到斑翅果蝇序列,与斑翅果蝇数据库中序列一致。开放阅读框(ORF)全长405 bp,经信号肽预测显示,含有从N-端开始的19个氨基酸组成的信号肽。斑翅果蝇OBP56h具有6个保守半胱氨酸位点(图1),符合OBP的典型特征。
将斑翅果蝇OBP56h与其他昆虫的OBP氨基酸序列进行序列比对与系统发育树构建,结果显示斑翅果蝇OBP56h与其同属的黑腹果蝇OBP56h进化关系最近(图2),序列一致度高达82.84%,Score为242,E-value为e-80。

6个保守半胱氨酸用黑色标出
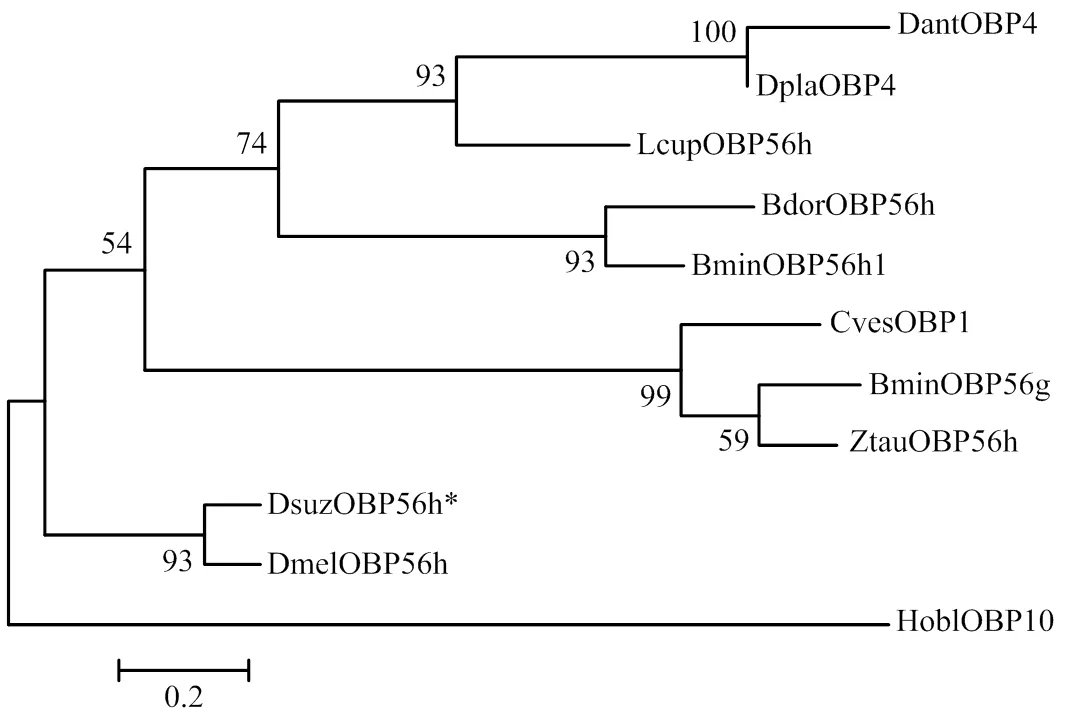
图2 斑翅果蝇OBP56h与其他昆虫OBP的系统发育树
2.2 斑翅果蝇OBP56h蛋白表达与纯化
构建pET30a-OBP56h重组质粒并转入BL21 (DE3)感受态细胞,在1 mmol·L-1IPTG、28℃、180 r/min条件下诱导蛋白表达。用SDS-PAGE电泳检测蛋白的表达,经Ni-NTA过柱后能得到单一目的蛋白条带(图3),透析24 h后用BCA法检测蛋白浓度。
2.3 斑翅果蝇OBP56h蛋白结合特性分析
用分子荧光光谱仪检测OBP56h与荧光探针bis-ANS的结合特性(图4),结合曲线经Scatchard方程线性化后为=-2.102+4.277(2=0.9601),拟合效果较好,解离常数为0.9568 μmol·L-1,表明bis-ANS探针可用于后续荧光竞争结合试验研究。
将所选配基依次加入浓度均为2 μmol·L-1的OBP56h和bis-ANS混合液中,进行荧光竞争结合试验,记录荧光强度随配基浓度的改变并计算IC50,根据公式计算出解离常数Ki。在所选的18种候选配基中,盐酸小蘖碱、香豆素、柚皮素、-环柠檬醛能将荧光强度竞争至初始值的50%以下(图5),其中盐酸小蘖碱和香豆素与OBP56h的结合亲和性较强,解离常数Ki分别为12.16和17.93 μmol·L-1;柚皮素和-环柠檬醛与OBP56h的结合亲和性相对较弱,解离常数Ki分别为25.32和31.37 μmol·L-1(表1)。
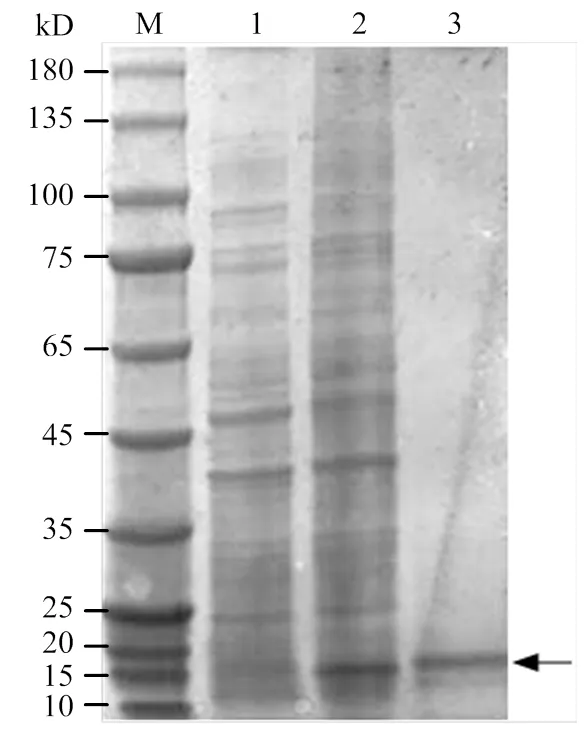
M:蛋白Marker Protein molecular weight;1:未诱导的pET30a-OBP56h的BL21菌体Bacterial products containing pET30a-OBP56h without induction;2:BL21菌体中DsuzOBP56h蛋白诱导表达Expression products after induction;3:纯化后的OBP56h蛋白Purified recombinant protein OBP56h
3 讨论
斑翅果蝇与黑腹果蝇一样趋向于在腐烂水果上取食,但在产卵时却趋向于即将成熟的软皮水果[9]。昆虫需要找到适合的寄主才能完成正常的生活史,繁衍种群,其寄主选择和定位过程需依靠嗅觉和味觉等[21]。气味结合蛋白在果蝇的寄主选择中具有重要作用,例如果蝇的OBP57d和OBP57e会影响其对寄主诺丽果()产生的植物源毒物己酸和辛酸的识别,进而影响寄主选择行为[22]。本研究克隆出斑翅果蝇并进行序列分析,原核表达蛋白,分析其与味觉物质和气味化合物的结合特性,为防治斑翅果蝇寻找新靶标提供理论依据。
荧光结合试验中常以1-NPN(-Phenyl-1- naphthylamine)、1-AMA(1-aminoanthracene)、ANS(8-Anilino-1-naphthalenesulfonic acid)和bis-ANS为荧光配基[23],本研究曾尝试以1-NPN为荧光报告子,但与斑翅果蝇OBP56h蛋白结合较差,后以bis-ANS探针作为荧光报告子[24],与OBP56h蛋白结合能力较强,后续相关研究可以此参考。
对昆虫气味结合蛋白的研究多为嗅觉方面,包括与寄主挥发物或性信息素的作用等[25-27]。在本研究中,斑翅果蝇OBP56h能与-环柠檬醛结合。-环柠檬醛是草莓叶片产生的一种挥发性气味物质,对斑翅果蝇具有吸引作用[28]。测试了同样对斑翅果蝇有吸引作用的挥发性气味物质乙偶姻和乙酸乙酯[29],但不能与OBP56h结合。斑翅果蝇嗅觉系统灵敏,可能还有其他嗅觉相关蛋白参与对偏嗜寄主挥发物的识别。同时,还测试了果蝇中主要的性信息素cVA、7-T、9-T、棕榈酸甲酯、月桂酸甲酯和肉豆蔻酸甲酯[30],均不能与OBP56h蛋白结合,但不能就此否认其在斑翅果蝇识别性信息素中的作用,因为果蝇性信息素存在多元情况,在黑腹果蝇中,OBP56h的抑制会影响其他嗅觉基因的表达,减少果蝇表皮性信息素抑制剂5-tricosene的含量,减少交配潜伏期[31]。未测试的果蝇性信息素组分能否与斑翅果蝇OBP56h蛋白结合还有待进一步研究。
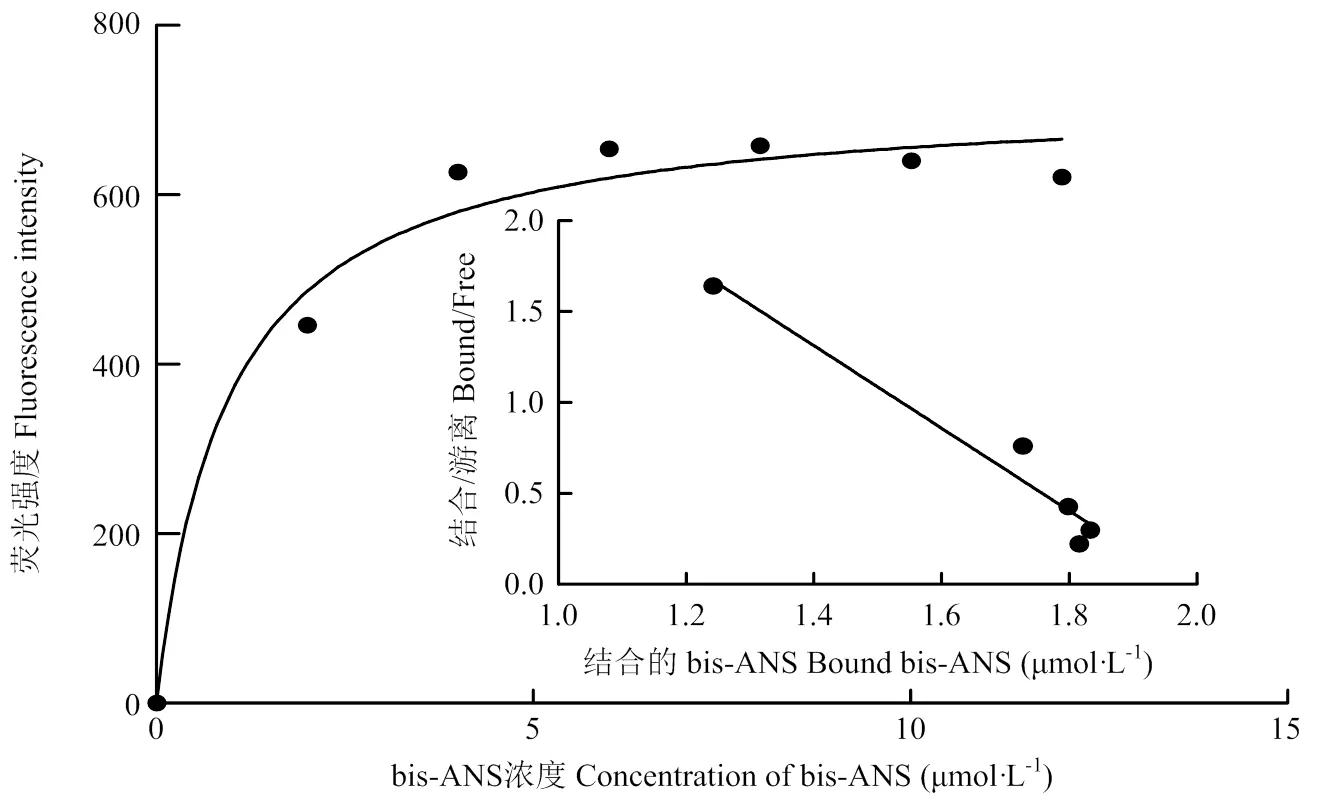
图4 斑翅果蝇OBP56h蛋白与bis-ANS的结合
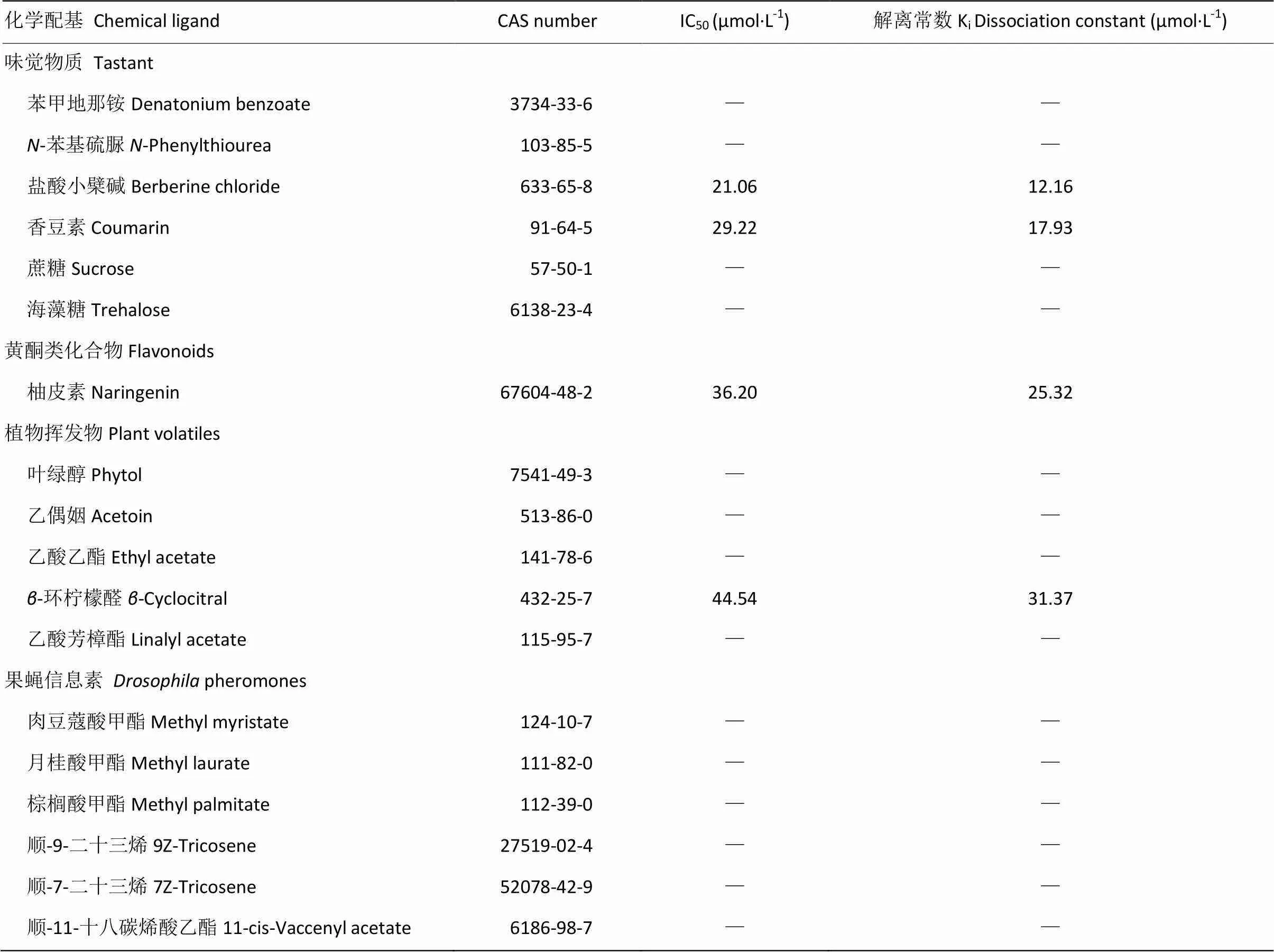
表1 候选配基与斑翅果蝇OBP56h蛋白的结合特性

图5 候选配基与bis-ANS竞争结合斑翅果蝇OBP56h蛋白
有研究认为气味结合蛋白在味觉、湿度感觉等非嗅觉方面具有重要作用[32-33]。昆虫气味结合蛋白会促进气味的运输,而苦味物质与气味物质相似,多为小分子疏水性化合物。Swarup等对黑腹果蝇中的研究发现,抑制OBP56h的表达会减少果蝇对盐酸小蘖碱、香豆素、苯甲地那铵、-苯基硫脲等苦味化合物的取食行为[18]。在本研究中也有类似发现,斑翅果蝇OBP56h蛋白与苦味化合物盐酸小蘖碱及香豆素的结合亲和性较强,但不能与苯甲地那铵、-苯基硫脲结合。斑翅果蝇OBP56h与黑腹果蝇OBP56h氨基酸序列一致度高,理论上为直系同源基因,具有类似功能,其差异行为可能与蛋白结构有关,值得进一步研究。许多苦味物质是有毒的,对昆虫来说,识别这类物质至关重要,这将影响其对取食寄主及产卵的选择。OBP56h可能作为苦味物质的转运载体在斑翅果蝇的味觉系统中起作用,影响其寄主选择行为。此外,斑翅果蝇OBP56h还能与柚皮素结合。柚皮素是柚子和番茄中的主要生物类黄酮,在草莓中也存在[34],会影响黑腹果蝇的取食、寿命等[35],对斑翅果蝇的影响尚不清楚。
昆虫气味结合蛋白的作用与其表达部位有关,气味结合蛋白表达范围广泛,除了主要的嗅觉感受器触角,在头、胸、腹、足、翅均有表达[36-37],在嗅觉与非嗅觉感受器均有表达[36]。黑腹果蝇OBP56h在幼虫及成虫的嗅觉和味觉感受器均有表达[17],而斑翅果蝇OBP56h是否存在同样的表达部位有待于进一步研究。
4 结论
斑翅果蝇气味结合蛋白OBP56h能与测试的多种植物苦味物质和挥发性气味物质结合,表明OBP56h很有可能参与斑翅果蝇对食物味觉和嗅觉的识别,研究结果可为理解斑翅果蝇的取食行为提供理论依据,并为斑翅果蝇的生态防控提供新思路。
[1] Mitsui H, Takahashi K H, Kimura M T. Spatial distributions and clutch sizes ofspecies ovipositing on cherry fruits of different stages., 2006, 48(3): 233-237.
[2] Rota-Stabelli O, Blaxter M, Anfora G.., 2013, 23(1): R8-R9.
[3] Leal W S. Odorant reception in insects: Roles of receptors, binding proteins, and degrading enzymes., 2013, 58: 373-391.
[4] Swarup S, Williams T I, Anholt R R. Functional dissection of odorant binding protein genes in., 2011, 10(6): 648-657.
[5] Wang P, Lyman R F, Mackay T F, Anholt R R. Natural variation in odorant recognition among odorant-binding proteins in., 2010, 184(3): 759-767.
[6] Große-Wilde E, Svatoš A, Krieger J. A pheromone-binding protein mediates the bombykol-induced activation of a pheromone receptor., 2006, 31(6): 547-555.
[7] 陈玲, 李红亮, 周宇翔, 赵磊, 张林雅, 倪翠侠, 商晗武. 桔小实蝇气味结合蛋白BdorOBP2的cDNA克隆、组织表达及配基结合特性. 昆虫学报, 2013, 56(6): 612-621.
Chen L, Li H L, Zhou Y X, Zhao L, Zhang L Y, Ni C X, Shang H W. cDNA cloning, tissue expression and ligand binding characteristics of odorant-binding protein 2 from the oriental fruit fly,(Diptera: Tephritidae)., 2013, 56(6): 612-621. (in Chinese)
[8] 陈东凯, 张林雅, 邢振龙, 雷仲仁. 美洲斑潜蝇气味结合蛋白OBP13的鉴定与功能. 中国农业科学, 2018, 51(5): 893-904.
Chen D K, Zhang L Y, Xing Z L, Lei Z R. Identification and function of the OBP13 protein from the leafminer ()., 2018, 51(5): 893-904. (in Chinese)
[9] Karageorgi M, BrÄcker L B, Lebreton S, Minervino C, Cavey M, Siju K P, GRUNWALD Kadow I C, Gompel N, Prud’homme B. Evolution of multiple sensory systems drives novel egg-laying behavior in the fruit pest., 2017, 27(6): 847-853.
[10] 任路明, 秦胜楠, 丁心婷, 万方浩, 褚栋. 水果害虫铃木氏果蝇的入侵及其防控研究进展. 生物安全学报, 2014, 23(3): 142-150.
Ren L M, Qin S N, Ding X T, Wan F H, Chu D. Research on the invasion and control of a fruit insect pest,(Matsumura)., 2014, 23(3): 142-150. (in Chinese)
[11] 张开春, 闫国华, 郭晓军, 王晶, 张晓明, 周宇. 斑翅果蝇 () 研究现状. 果树学报, 2014, 31(4): 717-721.
Zhang K C, Yan G H, Guo X J, Wang J, Zhang X M, Zhou Y. Research review on spotted wing drosophila ()., 2014,31(4): 717-721. (in Chinese)
[12] Hamby K A, Becher P G. Current knowledge of interactions betweenand microbes, and their potential utility for pest management., 2016, 89(3): 621-630.
[13] Lee J C, Burrack H J, Barrantes L D, Beers E H, Dreves A J, Hamby K A, Haviland D R, Isaacs R, Richardson T A, Shearer P W, Stanley C A, WALSH D B, Walton V M, Zalom F G, BRUCK D J. Evaluation of monitoring traps for(Diptera: Drosophilidae) in North America., 2012, 105(4): 1350-1357.
[14] Wang X G, Stewart T J, Biondi A, Chavez B A, Ingels C, Caprile J, Grant J A, Walton V M , Daane K M. Population dynamics and ecology ofin central California., 2016, 89(3): 701-712.
[15] Feng Y, Bruton R, Park A, Zhang A. Identification of attractive blend for spotted wing drosophila,, from apple juice., 2018, 91(4): 1251-1267.
[16] Wallingford A K, Hesler S P, Cha D H, Loeb G M. Behavioral response of spotted-wing drosophila,Matsumura, to aversive odors and a potential oviposition deterrent in the field., 2016, 72(4): 701-706.
[17] Galindo K, Smith D P. A large family of divergentodorant-binding proteins expressed in gustatory and olfactory sensilla., 2001, 159(3): 1059-1072.
[18] Swarup S, Morozova T V, Sridhar S, Nokes M, Anholt R R. Modulation of feeding behavior by odorant-binding proteins in., 2014, 39(2): 125-132.
[19] Dalton D T, Walton V M, Shearer P W, Walsh D B, Caprile J, Isaacs R. Laboratory survival ofunder simulated winter conditions of the Pacific Northwest and seasonal field trapping in five primary regions of small and stone fruit production in the United States., 2011, 67(11): 1368-1374.
[20] Congdon R W, Muth G W, Splittgerber A G. The binding interaction of Coomassie blue with proteins., 1993, 213(2): 407-413.
[21] Knolhoff L M, Heckel D G. Behavioral assays for studies of host plant choice and adaptation in herbivorous insects., 2014, 59: 263-278.
[22] Matsuo T, Sugaya S, Yasukawa J, Aigaki T, Fuyama Y. Odorant-binding proteins OBP57d and OBP57e affect taste perception and host-plant preference in., 2007, 5(5): e118.
[23] 张帅, 张永军, 苏宏华, 高希武, 郭予元. 中红侧沟茧蜂化学感受蛋白MmedCSP1的结合特征. 昆虫学报, 2009, 52(8): 838-844.
Zhang S, Zhang Y J, Su H H, Gao X W, Guo Y Y. Binding characterization of chemosensory protein MmedCSP1 in(Hymenoptera: Braconidae)., 2009, 52(8): 838-844. (in Chinese)
[24] Löbel D, Strotmann J, Jacob M, Breer H. Identification of a third rat odorant-binding protein (OBP3)., 2001, 26(6): 673-680.
[25] Xu P, Atkinson R, Jones D N, Smith D P.OBP LUSH is required for activity of pheromone-sensitive neurons., 2005, 45(2): 193-200.
[26] Laughlin J D, Ha T S, Jones D N, Smith D P. Activation of pheromone-sensitive neurons is mediated by conformational activation of pheromone-binding protein., 2008, 133(7): 1255-1265.
[27] Zwiebel L J, Takken W. Olfactory regulation of mosquito-host interactions., 2004, 34(7): 645-652.
[28] Keesey I W, Knaden M, Hansson B S. Olfactory specialization insupports an ecological shift in host preference from rotten to fresh fruit., 2015, 41(2): 121-128.
[29] Cha D H, Adams T, Rogg H, Landolt P J. Identification and field evaluation of fermentation volatiles from wine and vinegar that mediate attraction of spotted wing drosophila,., 2012, 38(11): 1419-1431.
[30] Dweck H K, Ebrahim S A, Thoma M, Mohamed A A, Keesey I W, Trona F, Lavista-Llanos S, Svatoš A, Sachse S, Knaden M, Hansson B S. Pheromones mediating copulation and attraction in., 2015, 112(21): E2829-E2835.
[31] Shorter J R, Dembeck L M, Everett L J, Morozova T V, Arya G H, Turlapati L, St ARMOUR G E, Schal C, Mackay T F C, Anholt R R H.modulates mating behavior in., 2016, 6(10): 3335-3342.
[32] Jeong Y T, Shim J, Oh S R, Yoon H I, Kim C H, Moon S J, Montell C. An odorant-binding protein required for suppression of sweet taste by bitter chemicals., 2013, 79(4): 725-737.
[33] Sun J S, Larter N K, Chahda J S, Rioux D, Gumaste A, Carlson J R. Humidity response depends on the small soluble protein Obp59a in., 2018, 7: e39249.
[34] Herrera M C, De Castro M D L. Ultrasound-assisted extraction for the analysis of phenolic compounds in strawberries., 2004, 379(7/8): 1106-1112.
[35] Chattopadhyay D, Sen S, Chatterjee R, Roy D, James J, Thirumurugan K. Context- and dose-dependent modulatory effects of naringenin on survival and development of., 2016, 17(2): 383-393.
[36] Gu S H, Wu K M, Guo Y Y, Pickett J A, Field L M, Zhou J J, Zhang Y J. Identification of genes expressed in the sex pheromone gland of the black cutwormwith putative roles in sex pheromone biosynthesis and transport., 2013, 14: 636.
[37] Song Y Q, Sun H Z, Du J. Identification and tissue distribution of chemosensory protein and odorant binding protein genes inDistant (Hemiptera: Lygaeidae)., 2018, 8: 7803.
(责任编辑 岳梅)
Binding Characterization of Odorant Binding Protein OBP56h inwith Small Molecular Compounds
LI Du1,2, NIU ChangYing1, LI FengQi2, LUO Chen2
(1College of Plant Science & Technology, Huazhong Agricultural University, Wuhan 430070;2Beijing Key Laboratory of Environment Friendly Management on Fruit Diseases and Pests in North China, Institute of Plant and Environment Protection, Beijing Academy of Agriculture and Forestry Sciences, Beijing 100097)
【】Theobjective of this study is to clone the odorant binding protein 56h (OBP56h) gene from, get the recombinant DsuzOBP56h protein, and characterize the binding profiles of DsuzOBP56h with some small molecular compounds.【】By means of specific primer, reverse transcription PCR (RT-PCR) was used to clone the full-length ORF of. The sequences of insect OBPs with high similarity were downloaded from NCBI database for sequence alignment and analysis. UsingⅠandⅠas restriction sites, OBP56h was ligated into pET-30a (+) prokaryotic expression vector, and transformed intoBL21 (DE3). IPTG was applied to induce the expression of recombinant DsuzOBP56h protein. The bacterial solution was collected and the protein was obtained through breaking cells by ultrasound, and then the protein was purified by the method of Ni-NTA resin. The purified protein was dialyzed by Tris-HCl and the concentration was determined by the method of BCA. The protein was diluted with 50 mmol·L-1Tris-HCl (pH 7.4) to a final concentration of 2 μmol·L-1, and the ligand was diluted with chromatography-grade methanol to a final concentration of 1 mmol·L-1. The binding characterization of DsuzOBP56h with 18 small molecular compounds was investigated using bis-ANS as fluorescence probe. 【】The full-length ORFofinwas amplified, which is 405 bp in total, including 19 amino acids of signal peptide in the N-terminal. It has 6 conserved cysteine sites, which is consistent with the typical characteristics of OBPs, and has the closest evolutionary relationship withOBP56h. OBP56h was successfully inserted into pET-30a (+) and expressed at 1 mmol·L-1IPTG and 28℃, then purified by the method of Ni-NTA resin. In the competitive fluorescence assay, the dissociation constant Kbis-ANSwas 0.9568 μmol·L-1, indicating that bis-ANS is suitable to be a reporter of competitive fluorescence binding assay. Among 18 ligands, the binding affinity of bitter tastants berberine chloride and coumarin with DsuzOBP56h was strong, and the dissociation constant is 12.16 and 17.93 μmol·L-1, respectively. The dissociation constant of naringenin with DsuzOBP56h is 25.32 μmol·L-1. A volatile odorant-cyclocitral, which is attractive toproduced by strawberry leaves, can also bind to DsuzOBP56h, with the dissociation constant of 31.37 μmol·L-1.【】The OBP56h incan bind with a variety of bitter tastants and volatile odors from plants, indicating that OBP56h may be involved in the gustatory and olfactory recognition of food in. The results can provide a theoretical basis for understanding the feeding behavior of, and provide a new idea for the ecological prevention and control of.
; odorant-binding protein; prokaryotic expression; competitive binding
2019-04-02;
2019-04-29
国家重点研发计划(2017YFD0200900)、国家自然科学基金(31661143045)、国家公益性行业(农业)科研专项(201503137)
李都,E-mail:lidu94@163.com。
牛长缨,E-mail:niuchangying88@163.com。通信作者李峰奇,E-mail:pandit@163.com

