撕裂蜡孔菌对黄瓜蔓枯病的防治作用及促生增产效果
白如霞,曾汇文,范倩,殷洁,隋宗明,袁玲
撕裂蜡孔菌对黄瓜蔓枯病的防治作用及促生增产效果
白如霞,曾汇文,范倩,殷洁,隋宗明,袁玲
(西南大学资源环境学院,重庆 400716)
【】明确撕裂蜡孔菌()对黄瓜的防病、促生作用,为农药、肥料减施增效提供依据。【】以自主分离的撕裂蜡孔菌HG2011新菌株为供试菌,采用Bonnet液体培养基制备撕裂蜡孔菌发酵液(fermentationbroth,CLB),另利用蛭石、玉米粉和谷壳等制备撕裂蜡孔菌固体菌剂(solid agent,CLA),通过拮抗、对峙培养、盆栽试验和田间试验,研究撕裂蜡孔菌对甜瓜球腔菌()引起的黄瓜蔓枯病的防治作用,以及对黄瓜生长发育、养分吸收、土壤酶活性、黄瓜产量和果实品质的影响。【】在拮抗试验中,培养第6天50% CLB对甜瓜球腔菌的抑制率为32.39%,与甲基托布津(thiophanate methyl,TM)作用相当。在对峙培养试验中,甜瓜球腔菌生长受到撕裂蜡孔菌抑制,撕裂蜡孔菌则继续生长至完全覆盖甜瓜球腔菌,使之变形、萎缩和消失。在盆栽试验中,喷病菌孢子液(pathogen inoculation,PI)处理的发病率为36.67%,病情指数为38.40。与PI相比,CLB可显著降低蔓枯病的发病率和病情指数,其相对防治效果为79.69%,同样与甲基托布津(75.57%)相当。与常规施化肥(CF)相比,施用CLB可促进黄瓜植株生长,提高生物量、根系活力和叶绿素含量,分别提高了5.87%—21.45%、36.50%—38.83%和10.54%—19.80%;黄瓜植株养分吸收量分别增加45.24%—69.05%(氮)、20.51%—43.59%(磷)和19.88%—38.51%(钾);土壤脲酶、酸性磷酸酶、过氧化氢酶、纤维素酶、脱氢酶和蛋白酶活性增强,增加幅度分别为8.73%—35.84%、7.55%—10.74%、25.32%—26.49%、186.21%—279.23%、47.99%—76.51%和49.00%—100.00%,施用高量(150 ml)CLB处理的效果优于低量(75 ml)CLB处理的效果。在田间试验中,与常规施肥相比,常规施肥与固体菌剂配施(CF+CLA10)与减肥处理与固体菌剂配施(75% CF+CLA10)均显著提高了黄瓜单株结果数、产量和游离氨基酸含量,增幅分别为13.61%、13.87%、71.54%(CF+CLA10)和11.51%、11.71%、54.37%(75% CF+CLA10),此外,75% CF+CLA10处理显著降低了硝酸盐含量,降幅为14.93%。【】撕裂蜡孔菌HG2011可抑制甜瓜球腔菌生长。喷施CLB能防治黄瓜蔓枯病,降低发病率和病情指数,提高防治效果;盆栽施加CLB可提高土壤酶活性,促进黄瓜幼苗吸收养分,使黄瓜健康生长。田间施用CLA可增加黄瓜产量,提高黄瓜果实游离氨基酸含量,降低硝酸盐含量,改善品质,益于实现减肥增效。撕裂蜡孔菌HG2011能分解木质素和纤维素,在作物秸秆中生长迅速,利用该生物菌剂制作堆肥可兼具防病、促生效果。
撕裂蜡孔菌;甜瓜球腔菌;黄瓜;蔓枯病;防治作用;促生
0 引言
【研究意义】黄瓜蔓枯病(gummy stem blight)又称黑腐病,是一种由子囊菌亚门(Ascomycotina)甜瓜球腔菌()引起的土传病害[1],为瓜类多发性真菌病害。在美国北卡罗来纳州,蔓枯病对黄瓜的危害仅次于根结线虫;在欧洲各国,蔓枯病是危害温室黄瓜的严重病害之一[2];我国浙江、上海、甘肃等地瓜类产区均存在蔓枯病[3]。黄瓜蔓枯病可发生于各个生育时期,侵染根、茎、叶等多个部位,造成减产[4]。施用化学农药是防治作物病害最快捷、最有效的手段之一,但长期施用存在环境和食品安全风险,并使病原菌产生抗药性。此外,黄瓜需肥较多,大量施肥造成一系列生产和环境问题,如肥料浪费、利用率降低、环境污染、水体富营养化等。我国黄瓜的种植面积近133.3万公顷,产量高达6 041万吨[5],研发高效、安全、对环境友好的生防和促生菌剂对化学农药及化肥减施具有重要意义。【前人研究进展】生防菌源于自然,与环境的相容性好,筛选高效、广谱、对人畜低毒或无毒的生防菌一直是植物保护领域重要的研究内容。目前发现的生防菌包括细菌、真菌和放线菌3大类。其中,以生防真菌研究较多,包含木霉(spp.)、粘帚霉(spp.)、拟青霉()等,其中哈茨木霉()和寡雄腐霉()已广泛应用于实际生产[6-7];生防细菌以植物根际促生菌(plant growth promoting rhizobacteria,PGPR)为代表,荧光假单胞菌()、洋葱假单胞菌()、恶臭假单胞菌()已用于马铃薯、胡萝卜和小麦,兼具防病和促生作用[8-11];我国还利用放线菌生产出井冈霉素(jinggangmycin)、农抗120(agricultural antibiotic 120)、多抗霉素(polyxins)、武夷菌素(wuyiencin)、中生菌素(zhongshengmycin)、宁南霉素(ningnanmycin)等,并已规模化应用[12]。撕裂蜡孔菌()是木生真菌中的多孔菌类,属多源类群,部分种类起源于平革菌科(Phanerochaetaceae)[13],部分起源于皱孔菌科(Meruliaceae)[14],目前已发现49种蜡孔菌,我国报道了20余种[15-16],其中部分菌株能分泌多酚、黄酮、多糖、-淀粉酶抑制剂、葡萄糖苷酶抑制剂和免疫调节剂,有些还能吸附结晶紫,分泌木质素酶、纤维素酶、蛋白酶和磷酸酶等,被广泛用于医学、生物制浆造纸、废水处理和生物能源等[17-19]。【本研究切入点】撕裂蜡孔菌可分泌铁载体、-1,3-葡聚糖酶、几丁质酶、磷酸酶、小分子抑菌物质、生长素(IAA)和多种有机酸等,可能具有抗病、促生、溶磷、解钾等功能[20-21],是一种潜在的生防和促生菌。目前,国内外关于撕裂蜡孔菌的研究主要集中于医疗、环保和生物能源等,在植物抗病促生方面的报道甚少。【拟解决的关键问题】采用课题组自主分离获得的撕裂蜡孔菌菌株HG2011,制备发酵液和固体菌剂,研究对黄瓜蔓枯病的防治作用及促生效应,为黄瓜减肥、减药提供技术支撑。
1 材料与方法
1.1 材料
供试黄瓜:津优1号(天津科润黄瓜研究所),购于重庆市三千种业。
供试化学农药:甲基托布津(thiophanate methyl,TM)(日本曹达株式会社),购于重庆农资农药公司,按照使用说明稀释800倍备用。
供试病原菌:甜瓜球腔菌由西南大学植物保护学院提供,用PDA固体培养基28℃培养7—10 d,用于拮抗试验;另用无菌水洗涤孢子,配制成1×104cfu/mL孢子悬浮液,用于植株抗病试验。
Bonnet液体培养基:0.6 g KH2PO4、0.7 g KNO3、0.25 g MgSO4·7H2O、0.125 g K2HPO4·3H2O、0.3 gCa(NO3)2、1 g天冬酰胺、10 g葡萄糖、1.5 mg MnSO4·H2O、4 mg ZnSO4·7H2O、0.1 mg Na2MoO4·2H2O、1 mg H3BO3、1 mg泛酸钙、8 mg FeNa-EDTA、1 mg吡哆醇、1 mg烟酸、20mg CuSO4·5H2O、10mg CoCl2·6H2O、20mg KI,水1 L,pH调至6.0。
撕裂蜡孔菌发酵液(fermentation broth,CLB):配制Bonnet液体培养基,加入发酵罐(BLB10-50SJ-UIP,上海百仑生物科技公司)中,灭菌后接入HG2011菌株;温度:(27±1)℃;搅拌速率:150 r/min;通气量:0.1 vvm;发酵时间:120 h,制备出CLB。
撕裂蜡孔菌固体菌剂(solid agent,CLA):取谷壳、玉米粉、蛭石和水,按15﹕3﹕15﹕70(质量比)混匀,装入32 cm×32 cm×45 cm栽培袋,透气膜封口,高温灭菌(121℃,1 h),冷却后每袋注入100 mL CLB,28℃暗培养21 d,制备出CLA[22]。
1.2 试验方法
1.2.1 撕裂蜡孔菌发酵上清液平板拮抗培养 4 000 r/min离心CLB 15 min,0.22 mm滤膜真空抽滤去菌丝和孢子,制成撕裂蜡孔菌发酵上清液。配制PDA固体培养基,灭菌,在凝固前加入CLB,配制成浓度为0、25%和50%的含药平板(由CK、25% CLB、50% CLB表示)。加入甲基托布津的操作同上,配制出稀释800倍的带药平板(TM)。然后用6 mm打孔器取甜瓜球腔菌菌落边缘的菌块,接种于培养皿PDA固体培养基中央,25℃暗培养,重复6次,第3天和第6天拍照记录,用十字交叉法测量菌落直径并计算抑制率:抑制率(%)=100×(对照菌落直径-处理菌落直径)/(对照菌落直径-6)。
1.2.2 撕裂蜡孔菌活菌对峙培养 配制PDA固体培养基,灭菌、倒板、冷却,(A)用直径为6 mm的打孔器取甜瓜球腔菌和撕裂蜡孔菌HG2011菌块,分别接种于培养基两侧,25℃黑暗下对峙培养15 d,观察并拍照;(B)用直径为6 mm的打孔器取甜瓜球腔菌菌块,接种于培养基中央,25℃黑暗下培养,第6天用直径为6 mm的打孔器取4块撕裂蜡孔菌HG2011菌块接在甜瓜球腔菌周围,继续培养,观察并拍照;挑取撕裂蜡孔菌和甜瓜球腔菌的菌丝,光学显微镜下观察菌丝形态变化。
1.2.3 CLB对黄瓜蔓枯病的防治效果 于2017年6—8月在重庆市北碚区西南大学资源环境学院温室大棚(E 106°25′,N 29°29′)进行盆栽试验,供试土壤为紫色土,风干,磨细过2 mm筛,甲醛熏蒸后备用。土壤基本理化性质:中壤,pH 6.5,有机质22.32 g·kg-1,全氮0.84 g·kg-1,全磷0.65 g·kg-1,全钾18.04 g·kg-1,碱解氮62.81 mg·kg-1,有效磷12.20 mg·kg-1,有效钾76.76 mg·kg-1。每盆装土1 kg,每盆施入2 g 15-15-15复合肥,混匀,每盆种1株健康、均匀一致的9日龄黄瓜幼苗,成活后设置4种处理:(1)对照(CK):正常黄瓜苗上喷无菌水;(2)喷病菌孢子液(PI):用1×104cfu/mL黄瓜蔓枯病菌孢子悬液喷湿幼苗;(3)化学农药+病菌(TM+PI):先用甲基托布津800倍稀释液喷湿幼苗,24 h后再喷蔓枯病病菌;(4)CLB+病菌(CLB+PI):先用CLB喷湿幼苗,24 h后再喷病菌。每个处理30盆,重复3次,共360盆,常规管理,观察,当PI的发病率超过30%时停止试验,调查植株发病率、病情指数和防治效果,同时测定最大展开叶片的相对电导率和丙二醛含量。
以叶片受害程度计算病情指数和防治效果[23]。病害程度分为5个等级,0级:无病症;1级:叶片受侵染面积<10%;2级:叶片受侵染面积在10%—25%;3级:叶片受侵染面积在25%—50%;4级:叶片受侵染面积在50%—75%;5级:叶片受侵染面积>75%。病情指数=100×∑[(各级发病数×该级代表数)/(调查总数×5)];防治效果(%)=100×(对照病情指数-处理病情指数)/对照病情指数。
1.2.4 CLB对黄瓜生长的影响 于2017年5—7月在重庆市北碚区西南大学资源环境学院温室大棚进行盆栽试验,供试土壤与土壤基本理化性质同1.2.3。每盆装土3 kg。设置4种处理:(1)对照(CK):不施肥+150 mL Bonnet培养液;(2)常规施化肥+Bonnet培养液(CF):每盆拌入5 g 15-15-15复合肥,浇灌150 mL Bonnet培养液;(3)常规施化肥+75 ml发酵液(CF+CLB75):在常规施化肥的基础上,浇灌75 mL CLB;(4)常规施化肥+150 ml发酵液(CF+CLB150):在常规施化肥的基础上,浇灌150 mL CLB。每盆种植1株黄瓜幼苗,各处理6盆,随机排列。Bonnet培养液或CLB均于移栽后0、5、10、15和20 d浇灌5次,常规管理。移栽后第40天收获植株,测定藤蔓长度、生物量和根系活力,并采摘第一片完全展开的真叶测定叶绿素含量[24];植株样品经105℃杀青后(80±2)℃烘干,常规分析氮、磷、钾含量[25]。用抖根法收集根际土壤,自然风干,用硝基水杨酸比色法、福林酚比色法、高锰酸钾滴定法、TTC分光光度法、苯酚钠-次氯酸钠比色法和磷酸苯二钠比色法分别测定纤维素酶、蛋白酶、过氧化氢酶、脱氢酶、脲酶和酸性磷酸酶活性[26]。
1.2.5 CLA对黄瓜生长的影响 于2018年4—7月在重庆市北碚区歇马柑橘研究所(E106°18′,N29°43′)完成。供试土壤为紫色土,中壤,pH 7.3,有机质19.88 g·kg-1,全氮0.98 g·kg-1,全磷0.92 g·kg-1,全钾19.97 g·kg-1,碱解氮60.60 mg·kg-1,有效磷29.12 mg·kg-1,有效钾53.49 mg·kg-1。年均气温18.6℃,年降雨量 1 173.6 mm。有机肥为商品鸡粪有机肥(鲜基),有机质含量30.01%,氮含量1.38%,磷含量1.15%,钾含量1.37%。设置4种处理:(1)对照(CK):不施肥,基施10 g/株高压蒸汽灭菌的CLA;(2)常规施肥(CF):每667 m2分别施用有机肥、尿素、过磷酸钙和硫酸钾380.43、26.63、3.13和26.5 kg(以N计,30%来自有机肥,70%来自化肥),其中有机肥、磷肥全部做基肥,并基施10 g/株高压蒸汽灭菌的CLA,氮钾化肥10%做基肥,剩余的90%均分为3份,分别于初花期、坐果期和第一批结果采收后兑水追施;(3)常规施肥+每株基施10 g CLA(CF+CLA10):常规施肥并基施10 g/株CLA;(4)75%的常规施肥+每株基施10 g CLA(75%CF+ CLA10):基肥、追肥均比常规施肥减少25%并基施10 g/株CLA。种植密度3 500株/667 m2,随机区组排列,重复3次,常规管理。分批采收黄瓜果实,累计结果数和产量。取盛果期果实10个,分别用蒽酮比色法、考马斯亮蓝G250法、茚三酮比色法、2,6–二氯酚靛酚滴定法和紫外分光光度法测定可溶性糖、可溶性蛋白、游离氨基酸、维生素C和硝酸盐含量[24]。
1.3 数据处理
用Excel 2016、SPSS 18.0和Origin 2017进行基本计算、统计分析与作图,用Duncan法进行多重比较,显著水平设置为<0.05。
2 结果
2.1 撕裂蜡孔菌发酵上清液和活菌对甜瓜球腔菌的拮抗作用
撕裂蜡孔菌发酵上清液(CLB)显著抑制甜瓜球腔菌的菌丝生长,培养第6天时,TM、25% CLB和50% CLB的抑制率分别为34.16%、25.93%和32.39%。其中,TM和50% CLB的抑菌率无显著差异,抑菌效果相似(图1)。
在对峙培养试验(A)中,撕裂蜡孔菌HG2011的生长速率大于甜瓜球腔菌,二者菌落均为乳白色。接种后第6天,二者的菌丝发生接触,甜瓜球腔菌生长受到抑制,撕裂蜡孔菌则继续生长至完全覆盖甜瓜球腔菌,最终使之萎缩和消失(图2-A);在对峙培养试验(B)中,甜瓜球腔菌培养过程中菌丝逐渐由乳白色转为青灰色。接种撕裂蜡孔菌后,乳白色菌落逐渐覆盖甜瓜球腔菌,最终取代甜瓜球腔菌成为优势菌(图2-B)。正常的甜瓜球腔菌菌丝有隔膜,表面光滑。当撕裂蜡孔菌HG2011对甜瓜球腔菌产生对峙作用后,甜瓜球腔菌菌丝则发生断裂、萎缩和消融(图3)。

CK:对照control;TM:甲基托布津thiophanate methyl;25% CLB:25% of CLB;50% CLB:50% of CLB
2.2 撕裂蜡孔菌发酵液(CLB)对黄瓜蔓枯病的防治效果及相关生理指标的影响

A:左侧为撕裂蜡孔菌菌株HG2011,右侧为甜瓜球腔菌 The left is C. lacerata strain HG2011 and the right is M. melonis;B:中间为甜瓜球腔菌,四周菌株为撕裂蜡孔菌HG2011 The middle is M. melonis and the around strain is C. lacerata HG2011

a:撕裂蜡孔菌菌株HG2011的正常菌丝 Normal hyphaeof C. lacerata strain HG2011 (400×);b:甜瓜球腔菌的正常菌丝 Normal hyphaeof M. melonis (400×);C:撕裂蜡孔菌对其产生对峙作用后的甜瓜球腔菌异常菌丝 Abnormal M. melonis hyphae after C. lacerate confront culture (400×)
由表1可见,接种甜瓜球腔菌(PI)使瓜苗发生蔓枯病。与PI相比,TM(甲基托布津)处理的病情指数和发病率分别降低29.02和26.67%,CLB处理的病情指数和发病率分别降低30.60和26.67%,TM和CLB的防治效果无显著差异(75.57%和79.69%)。黄瓜叶片丙二醛含量PI>TM+PI>CLB+PI>CK,相对电导率PI>TM+PI>CLB+PI>CK。
2.3 撕裂蜡孔菌发酵液(CLB)对黄瓜生长、相关生理指标和养分吸收的影响
2.3.1 植株生长、叶绿素含量和根系活力 与常规施化肥(CF)相比,施用CLB使黄瓜生物量、根系活力和叶绿素含量分别提高5.87%—21.45%、36.50%—38.83%和10.54%—19.80%(在CF+CLB75处理中,生物量和叶绿素含量的增幅未达显著水平),施用高量菌剂优于低量菌剂(图4)。
2.3.2 植株养分吸收 由表2可知,与常规施化肥(CF)相比,施用CLB显著提高黄瓜植株氮、磷、钾的含量和吸收量,其增幅依次为28.77%—32.88%、8.15%—12.59%、6.82%—12.57%(含量);45.24%—69.05%、20.51%—43.59%和19.88%—38.51%(吸收量),其中,除氮含量外,CLB150的作用显著高于CLB75,分别增加了4.11%(磷含量)、5.38%(钾含量)、16.39%(氮吸收量)、19.15%(磷吸收量)和15.54%(钾吸收量)。

表1 CLB对黄瓜蔓枯病的防治效果及相关生理指标的影响
同列数据后不同小写字母表示差异显著(<0.05)。下同
In the each column, data followed by different lowercases indicate significant difference (<0.05). The same as below

图4 不同处理下黄瓜生物量、藤蔓长度、根系活力及叶绿素含量
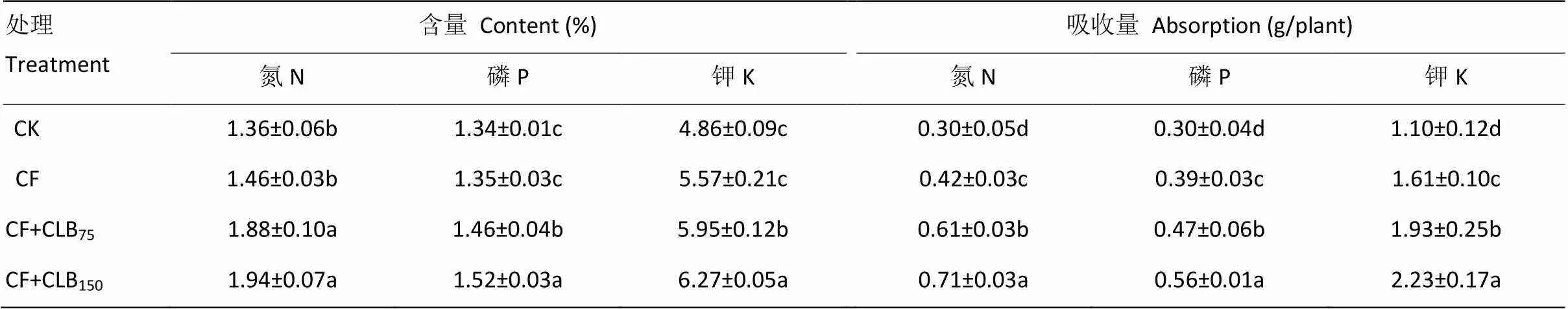
表2 不同处理下黄瓜植株养分含量与吸收量
2.4 撕裂蜡孔菌发酵液(CLB)对土壤酶活性的影响
与常规施化肥(CF)相比,施用CLB提高土壤脲酶、酸性磷酸酶、过氧化氢酶、纤维素酶、脱氢酶和蛋白酶活性(部分低量菌剂处理的增幅未达显著水平),其增幅依次为8.73%—35.84%、7.55%—10.74%、25.32%—26.49%、186.21%—279.23%、47.99%—76.51%和49.00%—100.00%(图5)。
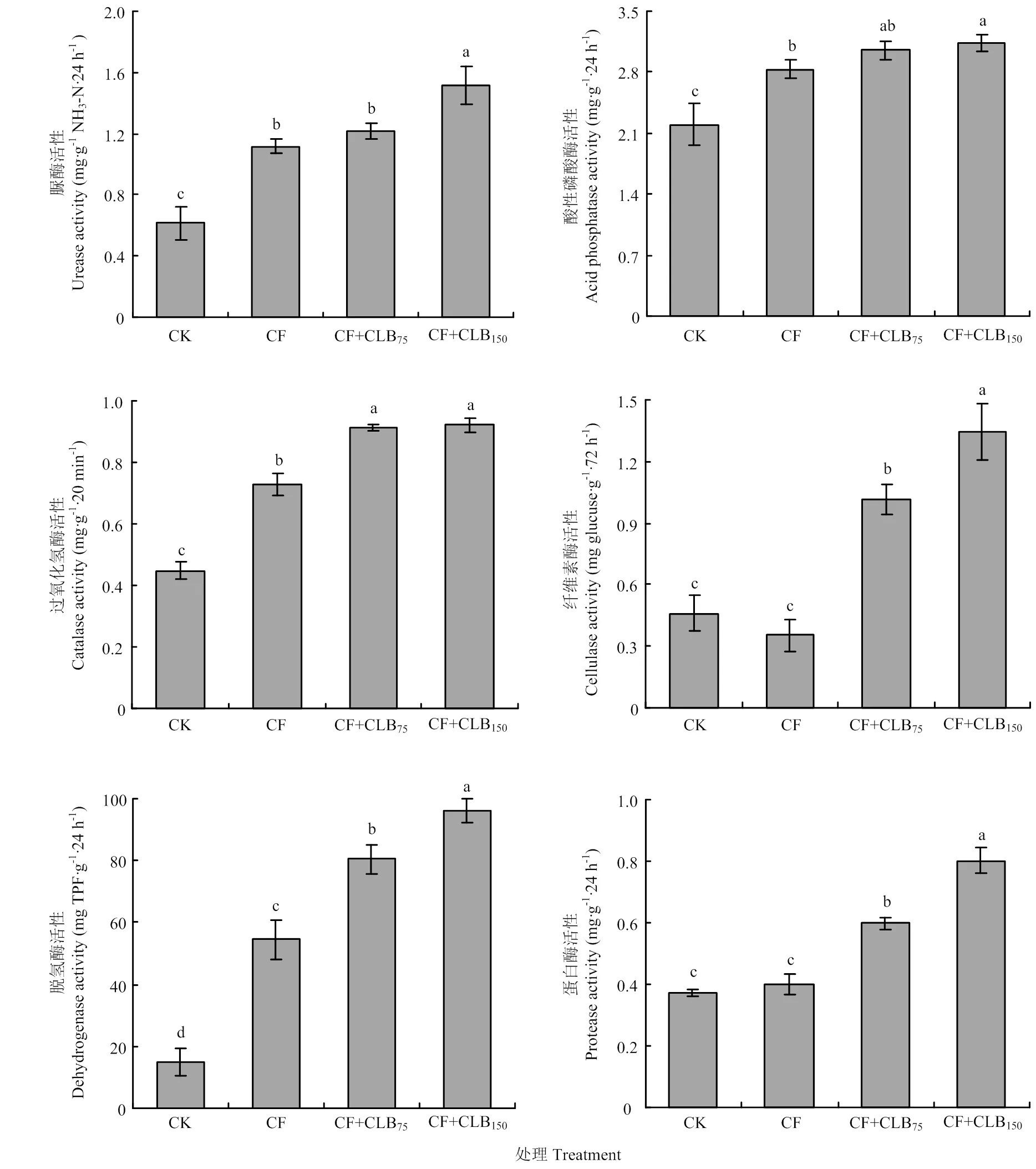
图5 不同处理的土壤酶活性
2.5 撕裂蜡孔菌固体菌剂(CLA)对黄瓜产量和品质的影响
由表3可知,与常规施肥(CF)相比,施用CLA显著提高黄瓜植株的单株结果数、产量和游离氨基酸含量,其增幅依次为11.51%—13.61%、11.71%—13.87%、54.37%—71.54%,减肥并施 加CLA处理(75% CF+CLA10)的硝酸盐含量显著低于常规施肥(CF),降幅为14.93%。此外,CF+ CLA10与75% CF+CLA10的产量及品质指标无显著差异。

表3 CLA 对黄瓜产量及品质的影响
3 讨论
在农业生产中,农药在防治病虫害中发挥着极其重要的作用。据预测,2019年全球消费的农药将达320万吨[27]。农药在保障农业丰产的同时,也带来了一系列环境与食品安全问题。既要控制病虫害,又不污染环境并保障食品安全,寻找高效安全的生物农药是较为理想的方法之一[28-30]。拮抗试验表明,撕裂蜡孔菌发酵液(CLB)能有效抑制甜瓜球腔菌的生长,其原因可能是CLB含有几丁质酶、纤维素酶、-1,3-葡聚糖酶及蛋白酶等多种胞外酶和小分子抗菌物质[20]。其中,几丁质酶具有广谱性抑菌作用,可抑制病原真菌的孢子萌发和菌丝生长[31];纤维素酶可穿透病原真菌的细胞壁,对重寄生作用产生重要影响[32];-1,3-葡聚糖酶是一种抗真菌蛋白,对真菌细胞壁的水解有催化作用,从而破坏病原菌细胞壁的完整性[33];蛋白酶可参与降解病原菌的细胞膜和细胞壁,释放蛋白质为重寄生菌提供营养[34]。甲基托布津(TM)是防治黄瓜蔓枯病的常规农药[35]。本试验接种甜瓜球腔菌后,黄瓜蔓枯病发病率达36.67%,TM的防治效果达到75.57%,CLB的防治效果为79.69%,二者的病情指数、发病率及防治效果均无显著差异,说明施用TM和CLB均能有效降低黄瓜蔓枯病的发生,且CLB的防治效果与常规防治药剂TM相当。电导率和丙二醛是衡量细胞受损伤的重要指标,接种甜瓜球腔菌后,黄瓜叶片相对电导率和丙二醛含量明显增加,使用TM和CLB均能显著降低相对电导率和丙二醛含量,其中以CLB+PI处理的叶片丙二醛含量最低,叶片相对电导率最小,说明CLB能保护黄瓜叶片细胞膜、减少受损伤程度[36]。
磷肥施入土壤之后,与钙、镁、铁、铝等离子结合,形成难溶性磷酸盐,作物利用率很低,我国磷肥利用率一般不超过30%。为满足作物磷素营养需要,必须大量施肥,因此,在一些菜园地和集约化农田里,磷素过量累积,导致污染环境非常严重[37]。利用有益微生物活化土壤难溶性磷是提高磷肥利用率,减少肥料用量的重要途径之一。研究发现,有些土壤微生物具有溶解土壤难溶性磷,提高磷肥利用率,促进作物生长的特性[38]。本试验采用的撕裂蜡孔菌菌株HG2011能分泌草酸、乙酸、柠檬酸、苹果酸等[21],这些有机酸可分解土壤中的矿物成分,释放有效态磷钾,促进植物对养分的吸收利用[39-41]。该菌株还能分泌IAA和铁载体,促进植物生长发育[42-43]。因此,在盆栽试验中,施用CLB后,黄瓜植株氮、磷、钾吸收量增加,生物量提高,类似CLB对烟草和茄子的促生效应[21-22]。同时,施用CLB增加了叶绿素含量和根系活力,光合作用中,叶绿素参与光能吸收及光合产物的形成,直接关系到植物生长[44-45],根系活力可反映根系的代谢状况,较强的根系活力有益于养分、水分的吸收[46]。在常规施肥的基础上施用CLA后,黄瓜果实产量比常规施肥增加,增产13.87%,而当肥料减施25%后,施用CLA同样增加了黄瓜产量,增产11.71%。其原因是采收果实体积大小(果重)均一的条件下,菌剂可活化养分,提高肥料利用率,增加黄瓜的结果数。施加CLA的减肥处理(75% CF+CLA10),黄瓜果实游离氨基酸显著增加,全氮、维生素C和可溶性蛋白不减少,并且硝酸盐含量显著降低,说明该菌剂能改善果实品质,减少肥料投入量,增加黄瓜产量。改善果实品质不仅提高黄瓜商品率,增加菜农收入,更有益于降低食品安全风险。
土壤微生物是土壤酶的重要来源,与常规施肥相比,施用CLB提高了黄瓜根际土壤中脲酶、酸性磷酸酶、过氧化氢酶、纤维素酶、脱氢酶和蛋白酶6种酶的活性。据此推测撕裂蜡孔菌在根际土壤中的定殖和繁殖可能是土壤酶活性增强的原因之一。土壤酶参与并促进土壤物质能量循环等生物化学过程[47-48],其酶活性在一定程度上能够反映土壤肥力水平[49-50]。其中,土壤脱氢酶在催化有机物质脱氢过程中起重要作用,其活性可作为微生物氧化还原系统的指标;纤维素酶参与土壤中碳水化合物的水解,在土壤碳素循环过程中发挥重要作用;过氧化氢酶能在过氧化氢的水解过程中起重要作用,可作为土壤的生化活性指标;脲酶参与催化尿素的水解,可用来表示土壤的氮素状况;酸性磷酸酶催化有机磷化合物矿化,其活性高低直接影响土壤有机磷的分解转化;蛋白酶参与土壤中含氮有机物的转化,在土壤氮素循环过程中起重要作用。因此,施用撕裂蜡孔菌菌剂可增强土壤酶活性,有益于土壤养分循环,改善土壤养分供应,促进黄瓜健康生长,并有利于其抗病增产。
4 结论
撕裂蜡孔菌菌株HG2011可有效防治黄瓜蔓枯病,促进黄瓜吸收养分,益于黄瓜健康生长,增加产量,提高品质。利用撕裂蜡孔菌HG2011可以作物秸秆为基质迅速生长的特性,腐熟秸秆制作堆肥,并在多种作物上持续研究,有望获得兼具防病与促生作用的新型生物菌剂。
[1] ST AMAND P C, WEHNER T C. Generation means analysis of leaf and stem resistance to gummy stem blight in cucumber., 2001, 126(1): 95-99.
[2] WEHNER T C, ST AMAND P C. Field tests for cucumber resistance to gummy stem blight in North Carolina., 1993, 28(4): 327-329.
[3] 李英. 瓜类蔓枯病菌的生物学特性和黄瓜抗病资源的筛选[D]. 南京: 南京农业大学, 2007.
LI Y. Study on biology characteristics ofand screening of resistance germplasm of cucumber[D]. Nanjing: Nanjing Agricultural University, 2007. (in Chinese)
[4] 孙元超. 怎样防治黄瓜蔓枯病. 现代农村科技, 2010(17): 24-25.
SUN Y C. How to control gummy stem blight in cucumber., 2010(17): 24-25. (in Chinese)
[5] 吴建寨, 韩书庆. 黄瓜2016年市场分析及2017年市场预测. http://jiuban.moa.gov.cn/zwllm/jcyj/201701/t20170122_5461548.htm.
WU J Z, HAN S Q. Market analysis of cucumber in 2016 and market forecast in 2017. http://jiuban.moa.gov.cn/zwllm/jcyj/201701/ t20170122_5461548.htm. (in Chinese)
[6] SHARMA V, SALWAN R, SHARMA P N, KANWAR S S. Elucidation of biocontrol mechanisms ofagainst different plant fungal pathogens: universal yet host specific response., 2017, 95: 72-79.
[7] 殷洁, 袁玲. 寡雄腐霉菌剂对辣椒疫病的防治及促生效应. 园艺学报, 2017, 44(12): 2327-2337.
YIN J, YUAN L.disease control and growth promotion of pepper by., 2017, 44(12): 2327-2337. (in Chinese)
[8] GHOLAMI A, SHAHSAVANI S, NEZARAT S. The effect of plant growth promoting(PGPR) on germination, seedling growth and yield of maize., 2009, 49(1): 19-24.
[9] ARSENEAULT T, GOYER C, FILION M.LBUM223 increases potato yield and reduces common scab symptoms in the field., 2015, 105(10): 1311-1317.
[10] 彭于发. 荧光假单胞菌Tn5诱变防病增产研究初报. 中国农业科学, 1990, 23(1): 88-89.
PENG Y F. Effects ofmutated by Tn5 on disease suppression and crop yield increase., 1990, 23(1): 88-89. (in Chinese)
[11] SOWMYA D S, RAO M S, KUMAR R M, GAVASKAR J, PRITI K. Bio-management ofandin carrot (L.) usingand., 2012, 40: 189-194.
[12] 段佳丽, 薛泉宏, 舒志明, 王东胜, 何斐. 放线菌Act12与腐植酸钾配施对丹参生长及其根域微生态的影响. 生态学报, 2015, 35(6): 1807-1819.
DUAN J L, XUE Q H, SHU Z M, WANG D S, HE F. Effects of combined application of actinomycetes Act12 bio-control agents and potassium humate on growth and microbial flora in rooting zone ofBge., 2015, 35(6): 1807-1819. (in Chinese)
[13] JANG Y, CHOI H E, LIM Y W, LEE J S, KIM J J. The first report of(Phanerochaetaceae, Basidiomycota) in Korea., 2012, 119(1): 397-403.
[14] YUAN H S. A new species of(Basidiomycota, Meruliaceae) from tropical China., 2011, 117(1): 255-260.
[15] 贾碧丝. 中国蜡孔菌属分类与系统发育研究[D]. 北京: 北京林业大学, 2012.
JIA B S. Taxonomy and phylogeny ofin China[D]. Beijing: Beijing Forestry University, 2012. (in Chinese)
[16] Jia B S, Zhou L W, Cui B K, Rivoire B, Dai Y C. Taxonomy and phylogeny of(Polyporales, Basidiomycota) with an emphasis of Chinese collections., 2014, 13(1): 81-93.
[17] Shin E J, Kim J E, Kim J H, Park Y M, Yoon S K, Jang B C, Lee S P, Kim B C. Hypoglycemic effects of submerged culture ofmycelium., 2015, 22(1): 145-153.
[18] 王娜, 于圣, 褚衍亮, 徐翔宇, 林陈强. 撕裂蜡孔菌在开放体系中对甲基橙染料的静态脱色研究. 菌物学报, 2015, 34(6): 1196-1204.
WANG N, YU S, CHU Y L, XU X Y, LIN C Q. Decolorization of methyl orange dye byunder statically air-opened condition., 2015, 34(6): 1196-1204. (in Chinese)
[19] WANG N, CHU Y L, WU F, ZHAO Z L, XU X Y. Decolorization and degradation of Congo red by a newly isolated white rot fungus,, from decayed mulberry branches., 2017, 117: 236-244.
[20] 黄建国, 殷洁, 袁玲. 一株撕裂蜡孔菌及其防治作物真菌病害的应用: CN 107201317 A[P]. (2017-09-26) [2018-12-25].
HUANG J G, YIN J, YUAN L. Disease control by application of a strain of: CN 107201317 A[P]. (2017-09-26) [2018-12-25]. (in Chinese)
[21] 袁玲, 殷洁, 黄建国. 一株撕裂蜡孔菌的促生作用及应用: CN 107164245 A[P]. (2017-09-15) [2018-12-25].
YUAN L, YIN J, HUANG J G. Growth promotion by application of a strain of: CN 107164245 A[P]. (2017-09-15) [2018-12-25]. (in Chinese)
[22] 殷洁, 范倩, 黄建国. 撕裂蜡孔菌的新功能——防治茄子绵疫病及促生效应. 中国农业科学, 2018, 51(12): 2300-2310.
YIN J, FAN Q, HUANG J G. New functions ofin phytophthora blight control and growth promotion of eggplants., 2018, 51(12): 2300-2310. (in Chinese)
[23] DIK A J, KONING G, KÖHL J. Evaluation of microbial antagonists for biological control ofstem infection in cucumber and tomato., 1999, 105(2): 115-122.
[24] 何金环, 连艳鲜. 生物化学实验技术. 2版. 北京: 中国轻工业出版社, 2014: 156-158.
HE J H, LIAN Y X... Beijing: China Light Industry press, 2014: 156-158. (in Chinese)
[25] 杨剑虹, 王成林, 代亨林. 土壤农化分析与环境监测. 北京: 中国大地出版社, 2008: 282-287.
YANG J H, WANG C L, DAI H L.. Beijing: China Earth Press, 2008: 282-287. (in Chinese)
[26] 关松荫. 土壤酶及其研究法. 北京: 农业出版社, 1986: 274-339.
Guan S Y.. Beijing: Agriculture Press, 1986: 274-339. (in Chinese)
[27] AGROPAGES. Global pesticide market - by regions and vendors - market size, demand forecasts, industry trends and updates, supplier market shares 2014-2020. http://report.agropages.com/ReportDetail- 1830.htm.
[28] 贾振华, 李静, 贾中雄. 化学农药在我国农作物生产中的应用与分析//陈万全. 病虫害绿色防控与农产品质量安全——中国植物保护学会2015年学术年会论文集.北京: 中国农业科学技术出版社, 2015: 319-322.
JIA Z H, LI J, JIA Z X. Application and analysis of chemical pesticides in crop production in China//Chen W Q.——. Beijing: China Agricultural Science and Technology Press, 2015: 319-322. (in Chinese)
[29] 雷仲仁. 病虫害生物防治是实现蔬菜安全生产的主要途径. 中国农业科学, 2016, 49(15): 2932-2934.
LEI Z R. Biological control of diseases and insect pests is valid method to ensure vegetable safe producing., 2016, 49(15): 2932-2934. (in Chinese)
[30] O’BRIEN P A. Biological control of plant diseases., 2017, 46: 293-304.
[31] BROGLIE K, CHET I, HOLLIDAY M, CRESSMAN R, BIDDLE P, KNOWLTON S, MAUVAIS C J, BROGLIE R. Transgenic plants with enhanced resistance to the fungal pathogen., 1991, 254(5035): 1194-1197.
[32] PICARD K, TIRILLY Y, BENHAMOU N. Cytological effects of cellulases in the parasitism ofby., 2000, 66(10): 4305-4314.
[33] MAUCH F, MAUCH-MANI B, BOLLER T. Antifungal hydrolases in pea tissue: Ⅱ. Inhibition of fungal growth by combinations of chitinase and-1,3-glucanase., 1988, 88(3): 936-942.
[34] GEREMIA R A, GOLDMAN G H, JACOBS D, ARDRTES W, VILA S B, VAN MONTAGU M, HERRERA-ESTRELLA A. Molecular characterization of the proteinase-encoding gene,, related to mycoparasitism by., 1993, 8(3): 603-613.
[35] 管炜, 李淑菊, 王惠哲, 杨瑞环. 几种杀菌剂对黄瓜蔓枯病菌的室内毒力测定. 天津农业科学, 2010, 16(3): 82-83.
GUAN W, LI S J, WANG H Z, YANG R H. Toxicity of some fungicides to, 2010, 16(3): 82-83. (in Chinese)
[36] 宋锐, 林丽果, 王康英, 宋浩然, 蒋勇斌, 刘慧霞. 不同盐生境下硅对高羊茅生物量及生理生化特征的影响. 草业学报, 2016, 25(8): 91-97.
SONG R, LIN L G, WANG K Y, SONG H R, JIANG Y B, LIU H X. Effects of silicon supply on the biomass and physiochemical features of tall fescue seedlings under different salinization conditions., 2016, 25(8): 91-97. (in Chinese)
[37] 李书田, 金继运. 中国不同区域农田养分输入、输出与平衡. 中国农业科学, 2011, 44(20): 4207-4229.
LI S T, JIN J Y. Characteristics of nutrient input/output and nutrient balance in different regions of China., 2011, 44(20): 4207-4229. (in Chinese)
[38] 王克安. 设施蔬菜高效施肥与土壤无害化处理. 北京: 金盾出版社, 2015.
WANG K A.. Beijing: Jindun Publishing House, 2015. (in Chinese)
[39] JOHNSON S E, LOEPPERT R H. Role of organic acids in phosphate mobilization from iron oxide., 2006, 70(1): 222-234.
[40] 刘丽, 梁成华, 王琦, 杜立宇, 吴玉梅, 韩巍. 低分子量有机酸对土壤磷活化影响的研究. 植物营养与肥料学报, 2009, 15(3): 593-600.
LIU L, LIANG C H, WANG Q, DU L Y, WU Y M, HAN W. Effects of low-molecular-weight organic acids on soil phosphorus release., 2009, 15(3): 593-600. (in Chinese)
[41] 王东升, 王君. 低分子量有机酸作用下土壤矿物钾释放机制. 辽宁工程技术大学学报(自然科学版), 2009, 28(suppl. 2): 259-261.
WANG D S, WANG J. Mechanism of soil mineral potassium release extracted by low-molecular-weigh organic acids., 2009, 28(suppl. 2): 259-261. (in Chinese)
[42] 杨扬, 高克祥, 吴岩, 刘晓光. 吲哚乙酸跨界信号调节植物与细菌互作. 生物技术通报, 2016, 32(8): 14-21.
YANG Y, GAO K X, WU Y, LIU X G. Indole-3-acetic acid-mediated cross-kingdom signalling involved in plant-bacteria interactions., 2016, 32(8): 14-21. (in Chinese)
[43] KLOEPPER J W, LEONG J, TEINTZE M, SCHROTH M N. Enhanced plant growth by siderophores produced by plant growth-promoting rhizobacteria., 1980, 286(2): 885-886.
[44] 徐凯, 郭延平, 张上隆. 不同光质对草莓叶片光合作用和叶绿素荧光的影响. 中国农业科学, 2005, 38(2): 369-375.
XU K, GUO Y P, ZHANG S L. Effect of light quality on photosynthesis and chlorophyll fluorescence in strawberry leaves., 2005, 38(2): 369-375. (in Chinese)
[45] 孙洪助. 红蓝光比例对绿叶蔬菜生理特性及品质的影响[D]. 南京: 南京农业大学, 2014.
SUN H Z. Effects of proportions of red and blue light on physiological characteristics and quality in leafy greens[D]. Nanjing: Nanjing Agricultural University, 2014. (in Chinese)
[46] 王素平, 郭世荣, 李璟, 胡晓辉, 焦彦生. 盐胁迫对黄瓜幼苗根系生长和水分利用的影响. 应用生态学报, 2006, 17(10): 1883-1888.
WANG S P, GUO S R, LI J, HU X H, JIAO Y S. Effects of salt stress on the root growth and leaf water use efficiency of cucumber seedlings., 2006, 17(10): 1883-1888. (in Chinese)
[47] 张丽娟, 曲继松, 朱倩楠, 吴涛. 不同剂量外源纤维素酶对设施土壤生物活性与番茄生长的影响. 植物营养与肥料学报, 2017, 23(4): 1089-1094.
ZHANG L J, QU J S, ZHU Q N, WU T. Effects of exogenous cellulase with different dosages on the biological activity and tomato growth in greenhouse soil., 2017, 23(4): 1089-1094. (in Chinese)
[48] 杨丽娟, 须晖, 邱忠祥, 刘永青. 菜田土壤酶活性与黄瓜产量的关系. 植物营养与肥料学报, 2000, 6(1): 113-116.
YANG L J, XU H, QIU Z X, LIU Y Q. Relationship between activities of enzyme and cucumber yield in vegetable soil., 2000, 6(1): 113-116. (in Chinese)
[49] DE LA PAZ JIMENEZ M, DE LA HORRA A, PMZZO L, PALMA R M. Soil quality: a new index based on microbiological and biochemical parameters., 2002, 35: 302-306.
[50] 申卫收, 林先贵, 张华勇, 尹睿, 段增强, 施卫明. 不同施肥处理下蔬菜塑料大棚土壤微生物活性及功能多样性. 生态学报, 2008, 28(6): 2682-2689.
SHEN W S, LIN X G, ZHANG H Y, YIN R, DUAN Z Q, SHI W M. Microbial activity and functional diversity in soils used for the commercial production of cucumbers and tomatoes in polytunnel greenhouse, under different fertilization., 2008, 28(6): 2682-2689. (in Chinese)
Effects ofon gummy stem blight control,growth Promotion and Yield Increase of cucumbers
BAI RuXia, ZENG HuiWen, FAN Qian, YIN Jie, SUI ZongMing, YUAN Ling
(College of Resources and Environment, Southwest University, Chongqing 400716)
【】The objective of this study is to clarify the effects ofon plant disease control and growth promotion, and to provide a basis forreducing the application of chemical pesticides and fertilizers.【】A new self-isolated(fungal strain HG2011) was grown in Bonnet liquid medium and mixture made of vermiculite, maize powder, and rice husk, respectively, to produce culture broth (CLB) and solid inoculant (CLA). CLB and CLA were prepared and conduced to evaluate the effect ofon the antagonistic activity against, control of gummy stem blight, vegetative growth of cucumber seedlings, yield of cucumbers, soil enzyme activity, and quality of cucumbers with the method of antagonistic assay, confront culture, greenhouse pot experiments, and field experiments, respectively.【】In the antagonistic assay, the inhibition rate of 50% CLB againstwas 32.39% in agar medium at the 6th day, which was similar to that of thiophanate methyl (TM). In the confront culture assay,HG2011 inhibited the growth of, this antagonistic fungus could covercolonies and make the hyphae deformed, shrunken and disappeared. In greenhouse pot experiments, the incidence of pathogen inoculation (PI) treatment was 36.67% and the disease index was 38.40. Compared with PI, CLB could significantly reduce the incidence and disease index of gummy stem blight, and the relative control efficacy was 79.69%, which was also similar to that of TM (75.57%). Compared with single conventional fertilization (CF), the application of CLB could promote the seedling growth, increase the biomass, root activity and chlorophyll content in leaves by 5.87%-21.45%, 36.50%-38.83% and 10.54%-19.80%, respectively. The nutrient uptake by cucumber seedlings increased by 45.24%-69.05% (nitrogen), 20.51%-43.59% (phosphorus), and 19.88%-38.51% (potassium), respectively. The activities of urease, acid phosphatase, catalase, cellulase, dehydrogenase, and protease increased by 8.73%-35.84%, 7.55%-10.74%, 25.32%-26.49%, 186.21%-279.23%, 47.99%-76.51% and 49.00%-100.00%. The effect of high dose (150 mL) CLB treatment was better than that of low dose (75 mL) CLB treatment. In field experiments, application of CLA on the basis of CF (CF+CLA10) increased fruit quantity of plant by 13.61%, yield by 13.87%, and free amino acids content by 71.54%. Application of CLA on the basis of reducing 25% CF (75% CF+CLA10) increased fruit quantity of plant by 11.51%, yield by 11.71%, and free amino acids content by 54.37%. In addition, compared with CF, 75% CF+CLA10significantly decreased nitrate content by 14.93%. 【】HG2011 strain can inhibit hyphal growth of. Spraying CLB can control gummy stem blight, reduce the incidence and disease index, and improve the control efficacy. Pot application of CLB can increase the activity of soil enzyme, promote the absorption of nutrients by cucumber seedlings, and make the healthy growth of cucumber. Field application of CLA can increase the yield of cucumber and the content of free amino acids in fruits, reduce the content of nitrate content and improve the quality, which is beneficial to reduce application and increase efficiency of chemical fertilizer.HG2011 strain can decompose lignin and cellulose, and grow rapidly in crop straw. Composting with this biological agent can both prevent disease and promote growth.
;; cucumber; gummy stem blight; control efficacy; growth promotion
2018-12-25;
2019-02-23
国家重点基础研究发展计划(“973”计划)(2013CB127405)、重庆市社会事业与民生保障科技创新专项(cstc2017shms-xdny80084)、重庆市科委社会民生类重点研发项目(cstc2018jscx-mszdX0011)
白如霞,E-mail:18306038510@163.com。
袁玲,E-mail:lingyuanh@aliyun.com
(责任编辑 岳梅)

