血液标志物在局部晚期鼻咽癌中的预测价值
孙健达,熊 俊,张汉雄,陈意标
广东省梅州市人民医院放疗科,广东 梅州514031
鼻咽癌是一种独特的头颈部恶性肿瘤,发病具有明显的地域性,在中国及东南亚地区高发,而其中又以中国的华南地区为甚。鼻咽癌是一种放射敏感及化疗相对敏感的肿瘤,早期鼻咽癌的治疗以根治性放疗为主,局部晚期鼻咽癌以放化疗综合治疗为主。以解剖结构为基础的TNM分期系统是目前治疗决策及判断预后的依据,但同一分期的患者接受相同的治疗后往往会出现不同的预后,这就说明TNM分期系统仍然存在一定的缺陷。近年来随着研究的不断深入,血液生物标志物在肿瘤的预后判断上取得显著的进展。研究表明血小板计数、血小板与淋巴细胞比值(platelet to lymphocyte ratio,PLR)及EB病毒(Epstein-Barr virus,EBⅤ)DNA等标志物与鼻咽癌的预后显著相关[1-3],且与TNM分期结合后可改善原有分期对预后的预测价值[4-5]。目前尼妥珠单抗被推荐用于Ⅲ~Ⅳ期鼻咽癌患者的放疗过程中,但是究竟哪一部分患者能够从治疗中获益仍然没有定论。本研究通过对接受尼妥珠单抗治疗的局部晚期鼻咽癌患者治疗前血小板计数、淋巴细胞计数、PLR及EBⅤ DNA拷贝数的检测,探讨其与分期之间的相关性,以及在近期疗效的预测作用,以期指导对尼妥珠单抗治疗的优势人群的筛选。
1 资料和方法
1.1 一般资料
选择2015年5月—2018年10月梅州市人民医院放疗科收治的初治并经病理学确诊、无远处转移的局部晚期鼻咽癌患者共83例。纳入标准:① Ⅲ~Ⅳa期(中国2008分期);② 年龄为18~70岁;③ 初次治疗;④ 无放化疗禁忌证;⑤ 治疗前有完整的血液学检查结果;⑥ 无感染性疾病或血液系统疾病。所有患者的病理学分型均为未分化型非角化性癌,而且均接受尼妥珠单抗联合放化疗综合治疗。其中男性57例,女性26例;中位年龄46岁(范围24~69岁);T1-2期27例,T3-4期56例;N0-1期20例,N2-3期63例;Ⅲ期41例,Ⅳa期42例。治疗前对患者病情的评估包括症状和体征、电子鼻咽镜检查、胸部及上腹部电子计算机断层(computed tomography,CT)增强扫描、鼻咽部及颈部磁共振成像(magnetic resonance imaging,MRI)增强扫描、发射型计算机断层扫描(emission computed tomography,ECT)骨显像,部分患者行全身正电子发射计算机断层显像(positron emission tomography/computed tomography,PET/CT)检查。
1.2 血常规检测方法
所有患者治疗前采取清晨空腹外周血2 mL,采用SYSMEX XE-2100全自动血细胞分析仪对全血标本进行检测,全程按照操作说明进行。记录血小板计数及淋巴细胞计数。PLR定义为血小板计数绝对值除以淋巴细胞计数绝对值。根据血小板计数及淋巴细胞计数将患者分为两组,A组为血小板计数及淋巴细胞计数均在正常范围,B组为血小板计数或淋巴细胞计数任一升高。
1.3 EBV DNA拷贝数检测方法
所有患者治疗前采取清晨空腹静脉血2 mL,之后向试管内注入含乙二胺四乙酸二钠(EDTA2Na)或枸橼酸钠试管立即轻轻颠倒试管混合5~10次,使抗凝剂与静脉血充分混匀,密闭送检。取全血1 mL至干燥玻璃试管,加入0.9%NaCl溶液1 mL轻摇混匀;取干燥玻璃试管加入500 µL淋巴细胞分离液,将稀释好的全血用移液器缓慢加入加有淋巴细胞分离液的试管中。2 000 r/min离心20 min,吸取白细胞层(从上往下的第二层),加入1.5 mL离心管,12 000 r/min离心5 min。离心后去上清液,沉淀中加入50 µL DNA提取液充分混匀,100 ℃恒温温育10 min。12 000 r/min离心5 min,备用。按比例(EBⅤPCR反应液40 µL/人份+Tap酶3 µL/人份)取相应量的PCR反应液及Tap酶,充分混匀后按43 µL管分装至0.2 mL离心管中,备用。向准备好试剂的0.2 mL离心管分别加入处理后的样品(标本、阴性质控品、临界或强阳性质控品)上清液2 µL或阳性定量参考品2 µL,8 000 r/min离心数秒。EBⅤ试剂购自达安基因股份有限公司。在Roche LightCycler 480扩增仪上进行PCR 扩增,93 ℃预变性2 min,93 ℃变性5 s,57 ℃延伸45 s,共进行40个循环扩增,37 ℃ 1 s,反应结束后再通过软件读取数值。本院EBⅤ DNA拷贝数检测的参考范围是0~1 000 U/mL,因此EBⅤ DNA升高定义为拷贝数大于1 000 U/mL。
1.4 治疗方法
56例患者接受调强适形放疗,27例患者接受容积旋转调强放疗。鼻咽部照射剂量70~74 Gy/33次。有4例患者在放疗结束时鼻咽病灶残留明显,其中1例予以三维适形局部推量6 Gy/3次 ,另外3例予以后装放疗(2例放疗剂量为10 Gy,1例放疗剂量为12 Gy);有1例患者在放疗过程中因机器故障而中断放疗的时间较长,因此在放疗结束后按原计划加放疗1次。颈部转移淋巴结照射剂量为66~74 Gy/33次,高危区PTⅤ1照射剂量为60~66 Gy/33次,低危区PTⅤ2照射剂量为50~54 Gy/28次。所有患者接受1~3个周期以铂类药物为基础的联合方案新辅助化疗,以及1~3个周期铂类药物单药同期化疗。部分T4、N3或具有其他高危因素的患者放疗结束后接受辅助化疗,共20例,其中18例接受1~3个周期以铂类药物为基础的联合方案化疗,另外2例患者因为体质较弱而接受卡培他滨或替吉奥口服化疗。放疗过程中予以尼妥珠单抗治疗,每次200 mg,每周1次。12例患者完成6次尼妥珠单抗治疗,71例患者完成7次尼妥珠单抗治疗。
1.5 疗效评价
放疗结束复查电子鼻咽镜、鼻咽+颈部MRI增强扫描、胸部X线/CT、上腹部彩超/CT,以评价疗效。近期疗效评价采用实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)1.1版[6]。其中,完全缓解(complete response,CR)为所有靶病灶消失,所有病变淋巴结的短径均小于10 mm;部分缓解(partial response,PR)为靶病灶直径之和比基线水平减少至少30%;疾病进展(progressive disease,PD)为靶病灶直径之和相对增加至少20%(直径之和的绝对值增加至少5 mm),或出现新的病灶;疾病稳定(stable disease,SD)为靶病灶直径之和减少的程度没有达到PR,增加的程度也没有达到PD。
1.6 统计学处理
2 结 果
2.1 治疗前血液标志物与肿瘤分期的关系
83例患者中血小板计数为255.47±71.69(×109/L),PLR为150.82±68.65。EBⅤ DNA拷贝数≤1 000 U/mL的患者28例,EBⅤ DNA拷贝数>1 000 U/mL的患者55例。所有淋巴细胞计数升高的患者,血小板计数均在正常范围,共5例;所有血小板计数升高的患者,淋巴细胞计数均在正常范围,共8例;血小板计数及淋巴细胞计数均在正常范围内的患者共70例。治疗前血小板计数、PLR、EBⅤ DNA水平、联合血小板计数和淋巴细胞计数均未显示出与肿瘤的T分期、N分期及临床分期之间存在明显的相关性(表1~3)。
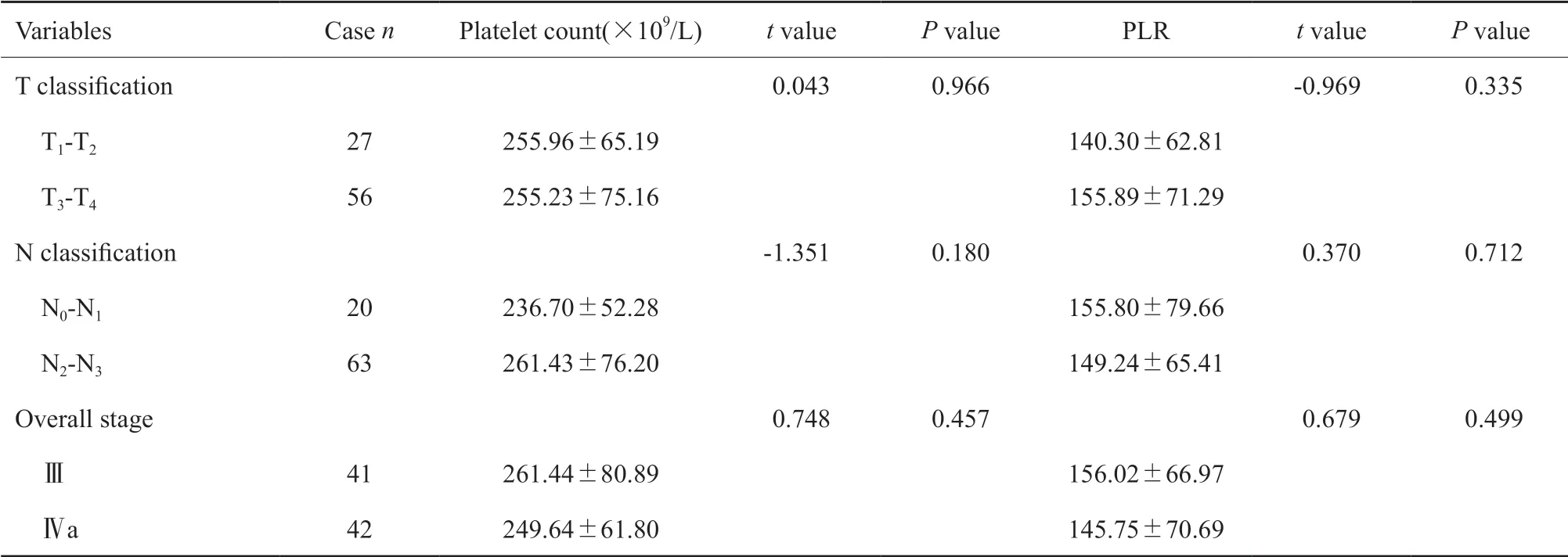
表 1 83例鼻咽癌患者治疗前血小板计数及PLR值与肿瘤分期的关系Tab. 1 The association of pretreatment platelet count and PLR with tumor staging in 83 NPC patients
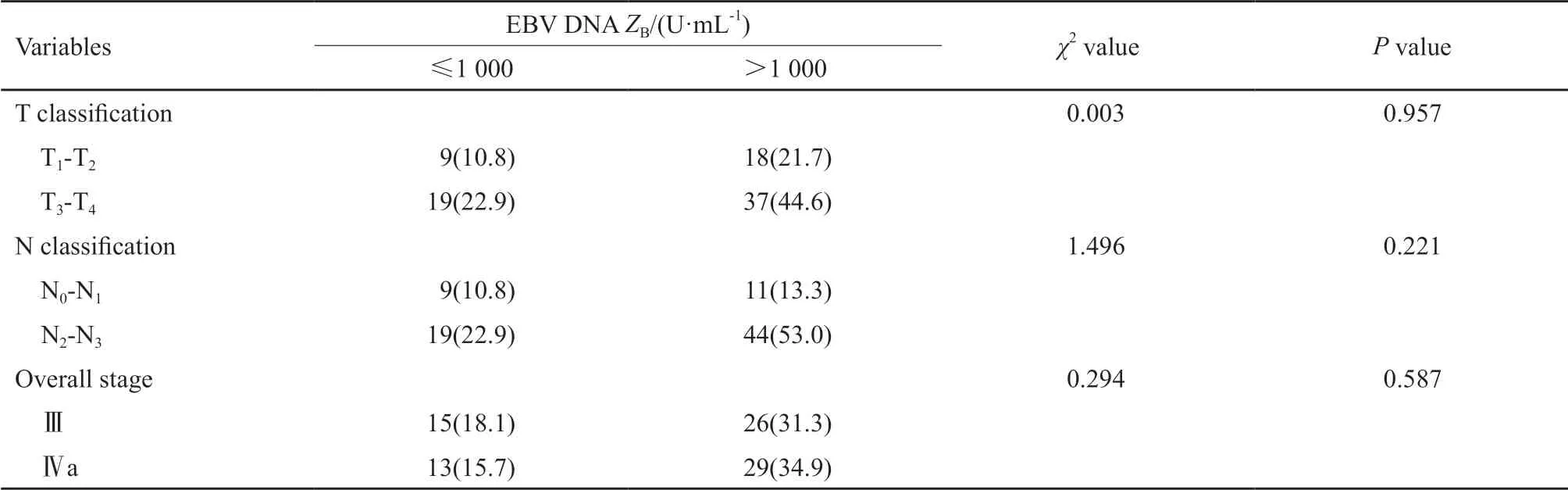
表 2 83例鼻咽癌患者治疗前EBV DNA水平与肿瘤分期的关系Tab. 2 The relationship between pretreatment EBV DNA levels and tumor staging in 83 NPC patients[n (%)]
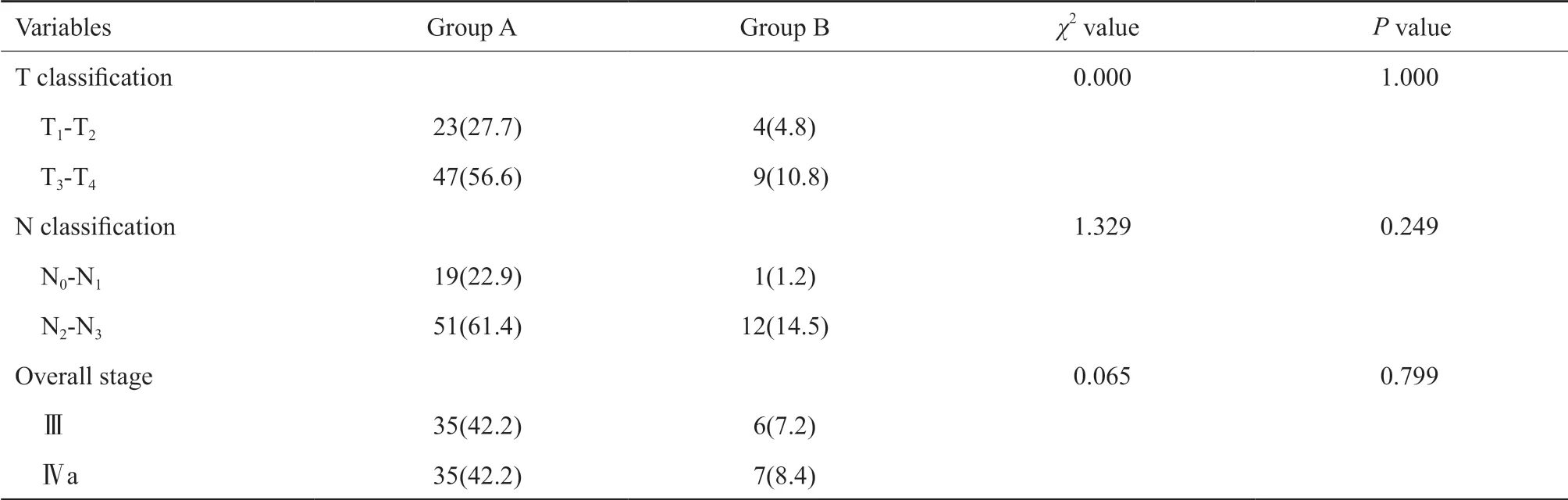
表 3 83例鼻咽癌患者治疗前联合血小板计数和淋巴细胞计数与肿瘤分期的关系Tab. 3 The association of pretreatment combination of platelet count and lymphocyte count with tumor staging in 83 NPC patients[n (%)]
2.2 治疗前血液标志物与近期疗效的关系
放疗结束时,鼻咽病灶CR为58例,PR为23例,SD为2例;颈部淋巴结CR为64例,PR为16例。由于放疗后鼻咽病灶SD只有2例,因此在探讨治疗前血液标志物与鼻咽病灶近期疗效的关系时将这2例患者纳入PR组中一并进行统计。治疗后鼻咽病灶达到完全缓解的患者的血小板计数平均值低于未达到完全缓解的,差异接近有统计学意义(P=0.068)。治疗前联合血小板计数和淋巴细胞计数与治疗后颈部淋巴结的缓解程度显著相关,A组患者的颈部淋巴结完全缓解率高于B组(分别为85.1%和53.8%),差异有统计学意义。治疗前PLR及血浆EBⅤ DNA水平与治疗后肿瘤的缓解程度无显著相关性(表4~6)。
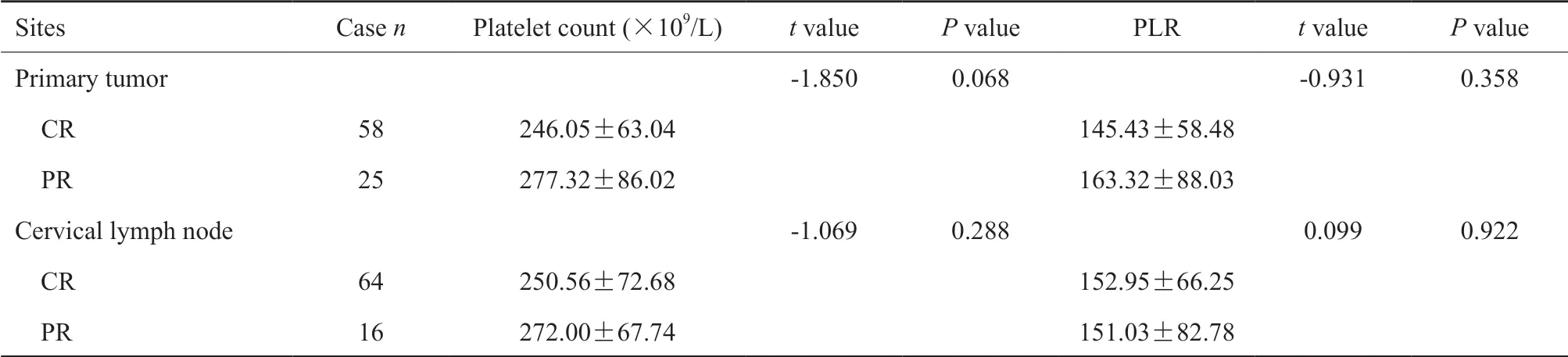
表 4 治疗前血小板计数及PLR值与治疗后肿瘤缓解程度的关系Tab. 4 The association of pretreatment platelet count and PLR with tumor response after treatment
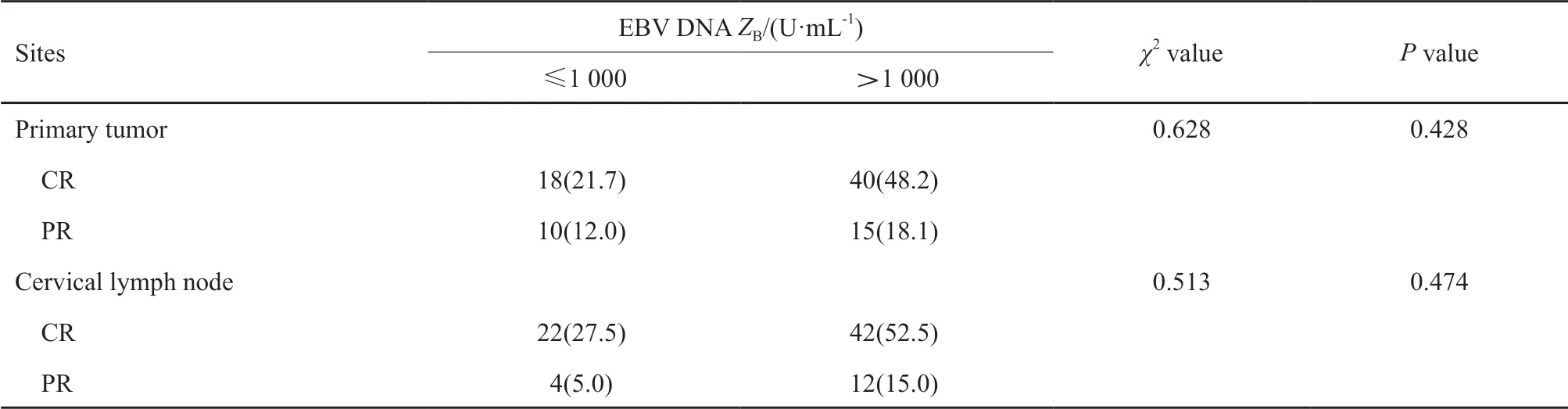
表 5 治疗前EBV DNA水平与治疗后肿瘤缓解程度的关系Tab. 5 The relationship between pretreatment EBV DNA levels and tumor response after treatment[n (%)]
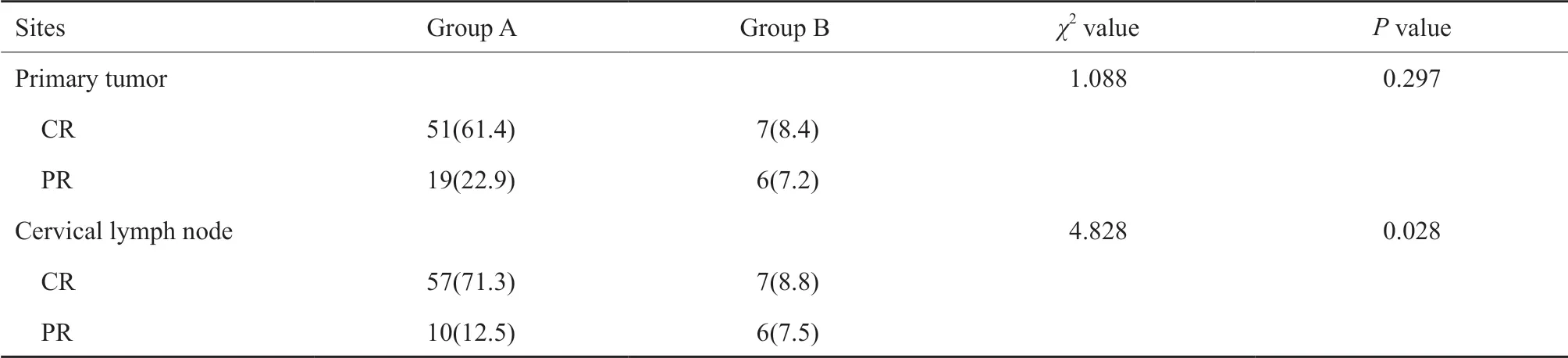
表 6 治疗前联合血小板计数和淋巴细胞计数与治疗后肿瘤缓解程度的关系Tab. 6 The association of pretreatment combination of platelet count and lymphocyte count with tumor response after treatment[n (%)]
3 讨 论
随着放疗设备的更新,放疗技术的改进、影像学诊断技术的进步以及新的、有效的化疗药物的应用,鼻咽癌患者的治疗效果得到不断的提高,早期患者的5年总生存率可达94.0%,而对于局部区域晚期患者而言,5年总生存率为54.0%~69.7%[7-8]。研究表明尼妥珠单抗联合放化疗可提高局部晚期鼻咽癌患者的疗效,改善患者的预后[9]。但必须指出的是,并不是所有的患者均能从尼妥珠单抗的治疗中获益。因此通过研究鼻咽癌患者预后的相关因素能更准确地预测患者的预后,并能帮助临床医师做出正确的临床决策。
血小板在止血及血栓形成过程中发挥着主要的作用,但越来越多的研究表明,血小板在介导肿瘤细胞的生长、扩散及血管生成的过程中也起着重要的作用。肿瘤细胞与血小板可通过直接相互作用及分泌生物活性蛋白,从而协助肿瘤扩散转移,同时血小板与肿瘤细胞形成聚合体,保护肿瘤细胞免受宿主免疫系统的监视[10]。因此血小板计数的增多与肿瘤患者较差的预后相关。PLR把反映肿瘤状态的血小板与反映机体免疫能力的淋巴细胞结合起来,在肿瘤预后的预测中所发挥的作用也引起了广泛的关注。Gao等[11]及Jiang等[12]分别报道治疗前血小板计数及PLR与鼻咽癌患者的临床分期及T分期显著相关,而本研究的结果则显示治疗前血小板计数及PLR与肿瘤的T分期、N分期及临床分期之间无显著的相关性,这与Xie等[13]及Lu等[14]报道的结果相似。除此以外,Xie等[13]及Lu等[14]还分别报道了血小板计数及PLR的升高与较差的预后相关。而本研究的结果则显示对于接受尼妥珠单抗治疗的局部晚期鼻咽癌患者,治疗前血小板计数及PLR与治疗后肿瘤的缓解程度无显著相关性。造成这种研究结果出现差异的原因可能与各个研究所采用的截点值及统计方法不同有关。在Gao等[11]及Xie等[13]的研究中血小板计数的截点值分别取300×109/L和266×109/L,而在Jiang等[12]及Lu等[14]的研究中PLR的截点值分别取108.33和174.00。Gao等[11]采用卡方检验来研究血小板计数与临床特征的关系,而本研究则采用t检验来研究血小板计数与分期之间的关系。有研究发现,血小板计数跟中性粒细胞与淋巴细胞比值的评分较单一指标更能预测鼻咽癌患者的预后[15],本研究也得出相似的结论。对于接受尼妥珠单抗治疗的患者,治疗前联合血小板计数和淋巴细胞计数与治疗后颈部淋巴结的缓解程度显著相关,血小板计数及淋巴细胞计数均正常的患者的颈部淋巴结完全缓解率显著升高。
EBV是一种重要的人类病原体,与未分化鼻咽癌密切相关[16]。研究表明,治疗前血浆EBⅤDNA是EBⅤ相关鼻咽癌肿瘤负荷的标志物,肿瘤负荷越大,EBⅤ DNA拷贝数越高[17-18],EBⅤDNA水平与T分期、N分期及临床分期均显著相关[2,5,19]。而在本研究中,治疗前EBⅤ DNA水平与T分期、N分期及临床分期均无显著相关性。另外,研究表明治疗前血浆EBⅤ DNA水平与鼻咽癌患者的预后密切相关,EBⅤ DNA水平升高是患者预后不良的标志[2,18-20]。但本研究结果则显示治疗前血浆EBⅤ DNA水平与治疗后鼻咽病灶及颈部肿大淋巴结的缓解程度均无显著相关性。目前各个实验室的检测设备、DNA提取、检测的DNA片段、质控、检测极限值等均缺乏统一的标准[21],这可能是造成本研究结果与文献报道不一致的原因之一。
由于简单、方便、费用不高及创伤小,且能在一定程度上反映肿瘤的异质性,因此血液标志物对鼻咽癌的预后影响受到越来越多的重视。但目前各个研究中心的检验设备、试剂及方法等缺乏统一标准,导致研究结果的可比性较差,因此急需制定标准化的检验方法及流程。由于本研究是单中心回顾性研究,样本量较小,且并未对患者的长期生存情况进行分析,因此所得出的结论具有一定的局限性。另外,在本研究中由于部分患者拒绝在治疗后3个月MRI复查,因此采用治疗结束复查的结果来评价疗效,而目前多数文献报道的是在治疗结束后3个月或以上才进行疗效的评价,这就造成本研究的完全缓解率较其他文献[22-24]报道的低,从而在一定程度上影响了血液标志物对近期疗效的预测作用。
综上所述,尼妥珠单抗治疗局部晚期鼻咽癌,治疗前联合血小板计数和淋巴细胞计数较单独血小板计数、PLR和血浆EBⅤ DNA水平更能预测患者的近期疗效。

