胃癌高危因素评分模型构建及对筛查时机、方案选择的价值研究
苗长丰,马云涛,王晓鹏,狐 鸣,杨晓军
1.甘肃省人民医院普外科,甘肃 兰州 730030;
2.甘肃省人民医院西院区普外科,甘肃 兰州730000
胃癌是常见的消化道恶性肿瘤之一,其发病率呈明显上升趋势。我国胃癌年发病率为31.38/10万,死亡率为18.94/10万[1]。与日本和韩国相比,我国早期胃癌检出率低,许多患者在首次诊断时即处于进展期,已失去最佳手术时机,这是我国胃癌5年生存率低于发达国家的主要原因[2-3]。有效普查、加强对高危人群的定期随访是提高早期胃癌诊断率的两种重要途径,这两种途径分别称为人群筛查及伺机性筛查[4]。人群筛查依从性差,耗费的人力、物力巨大,不符合现阶段我国实际国情。而伺机性筛查也称为个体筛查,是一种基于临床表征的筛查方法,花费少,患者依从性高,更易实现[5-6]。因此,本研究通过分析于甘肃省人民医院确诊的387例胃黏膜相关疾病患者的相关资料,确定一个简便可行的评分方案,为提高早期胃癌的检出率提供依据。
1 资料和方法
1.1 对象
收集2014年6月—2017年12月甘肃省人民医院普外科收治的因消化道相关症状就诊的患者作为研究对象,总病例数为387例。纳入标准:①年龄≥18岁;② 均行胃镜及组织学检查;③ 均确诊为胃黏膜相关疾病。排除标准:① 胃癌部位为贲门癌;② 存在精神障碍或其他原因,不能配合完成调查;③ 合并其他恶性肿瘤病史。最终,101例胃癌患者被纳入研究。同时,选取与病例检查时间相近的胃部良性疾病的非胃癌患者作为对照组,最终286例非胃癌患者被纳入对照组。
1.2 标本来源
① 胃组织来源:胃镜检查后,取病变组织至少5块,10%甲醛溶液固定后,石蜡包埋,由病理科诊断。诊断标准参照中国抗癌协会《新编常见恶性肿瘤诊治规范-胃癌分册》中关于胃黏膜病变的诊断标准。② 幽门螺杆菌(Helicobacter pylori,HP)检查标本来源:胃镜下,在胃窦部距幽门约3 cm处,取大弯、小弯侧黏膜组织各1块。③ 血液样本来源:清晨空腹状态下,采集静脉血5 mL,离心分离血清后,低温保存备用。
1.3 研究方法
① 胃癌相关危险因素问卷调查:在广泛阅读国内外文献的基础上,选取较为公认的危险因素,设计调查表。采用访谈方式,由培训合格后的专责护士进行面访后如实填写。纳入的危险因素包括性别、年龄、饮用水类型、家族史、食用新鲜蔬菜频率、食用腌制品频率、HP感染、胃蛋白酶原(pepsinogen,PG)Ⅰ及PGⅠ/Ⅱ等。② HP感染情况:采用组织学改良Giemsa染色法进行判定。③ 胃蛋白酶水平:采用ELISA法进行测定。加样后温育,弃液、拍干、每孔加满洗涤液,如此反复4次。加酶标工作液,温育30 min后重复洗板4次,加入显色剂,震荡混匀,37 ℃下避光显色15 min。加入终止液,在终止后15 min内,测量450 mm波长处的吸光度(D)值。
1.4 模型验证
胃癌高危模型建立后,进行内部验证。采用受试者工作特征(receiver operating characteristic,ROC)曲线分析入选患者的血清PGⅠ、PGⅠ/Ⅱ及总得分的最佳截断点,通过分析比较ROC曲线的曲线下面积、灵敏度及特异度等指标,对诊断实验进行判别分析。
1.5 统计学处理
数据分析均采用SPSS 20.0软件进行,计量资料采用t检验。计数资料的单因素分析采用χ2检验或Fisher精确概率法。多因素分析采用Logistic回归模型进行。根据不同类型的自变量选择不同的赋值方法。① 二分类变量:暴露因素为1,非暴露因素为2。② 无序多分类变量:设置哑变量,以非暴露为参照。③ 数值变量:根据专业知识及实际情况,将数值变量转换为分类变量,以各指标的界值作为标准进行划分。具体的赋值情况见表1。血清PGⅠ、PGⅠ/Ⅱ最佳临界值对胃癌的预测作用采用ROC曲线特征进行分析。P<0.05为差异有统计学意义。
2 结 果
2.1 ROC曲线确定胃癌高风险的血清PGⅠ、PGⅠ/Ⅱ临界值
ROC曲线显示,当PGⅠ为43.7 μg/L时,曲线下面积最大为0.736,其灵敏度为0.529,特异度为0.779。当PGⅠ/Ⅱ为2.2 μg/L时,曲线下面积最大为0.780,其灵敏度为0.578,特异度为0.849。以二者临界值为标准,将二者并联时,对胃癌诊断的灵敏度为71.8%,特异度为75.5%;将二者串联时,灵敏度为90.1%,特异度为34.3%,虽然灵敏度明显上升,但特异度显著下降;由此可知,PGⅠ≤43.7 μg/L且PGⅠ/Ⅱ≤2.1 μg/L是最佳筛查临界值(图1,表2)。
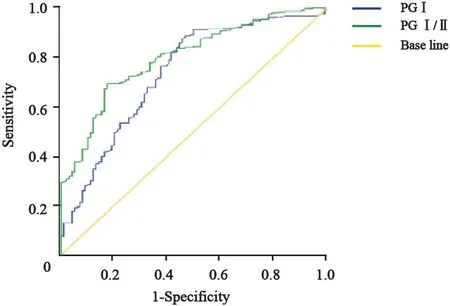
图 1 血清PGⅠ、PGⅠ/Ⅱ对胃癌诊断效能的ROC曲线Fig. 1 ROC curve of serum PGⅠ, PGⅠ/Ⅱ in diagnosis of gastric carcinoma
2.2 影响胃癌发生的单因素分析
单因素分析结果显示,两组患者的性别构成、年龄、饮用水类型、家族史、食用腌制品、HP感染、PGⅠ及PGⅠ/Ⅱ等差异有统计学意义(P<0.05,表3)。

表 1 主要研究指标及赋值情况Tab. 1 Main research indicators and assignment

表 2 血清PGⅠ、PGⅠ/Ⅱ对胃癌高风险患者的灵敏度、特异度比较Tab. 2 Sensitivity and specificity of serum PGⅠand PGⅠ/Ⅱ in patients with high risk of gastric carcinoma

表3 影响胃癌发生的单因素分析Tab. 3 Univariate analysis of gastric carcinogenesis
2.3 影响胃癌发生的多因素分析
将单因素分析中有意义的指标全部纳入多因素Logistic风险模型,结果发现,患者性别、饮用水类型、HP感染、家族史、PGⅠ、PGⅠ/Ⅱ及年龄均是影响患者胃癌发生的独立危险因素(P<0.05,表4)。
2.4 胃癌高危评分模型构建
为了构建定量化的风险模型,便于实际临床应用。将年龄、PGⅠ及PGⅠ/Ⅱ转换为多分类变量后,进行哑变量处理,再次行Logistic多因素分析。以得出的最小回归系数β为基准,计算其余变量β值与之相比的倍数乘以10,即为每个变量相应的权重分数,以此为基础,对各危险因素进行赋值,建立评分模型,可得Y=A×年龄+30×性别+30×饮用水+30×HP(+)+50×家族史+B×PG水平(35~45岁:A=20;46~55岁:A=40;56~65岁:A=70;≥66岁:A=80。当PGI≤43.7 μg/L且PGⅠ/Ⅱ>2.1 μg/L:B=10;PGI>43.7 μg/L且PGⅠ/Ⅱ≤2.1 μg/L:B=30;PGI≤43.7 μg/L且PGⅠ/Ⅱ≤2.1 μg/L:B=80)。详见表5~6。
2.5 胃癌高危评分模型的验证
根据模型对两组患者评分进行验证,结果发现,病例组评分[(209.78±46.98)分]显著高于[对照组(122.37±56.37)分],差异有统计学意义(χ2=13.962,P<0.001)。根据评分结果,绘制胃癌患者相关评分的ROC曲线。结果发现,当临界值为156分时,曲线下面积最大为0.876,灵敏度为0.880,特异度为0.716,Youden指数=0.595。拟合优度经Hosmer-Lemeshow检验后发现,模型HL指标为13.492,P=0.095,表明模型拟合度较好(图2)。

表4 影响胃癌发生的多因素分析Tab. 4 Multivariate analysis of gastric carcinogenesis
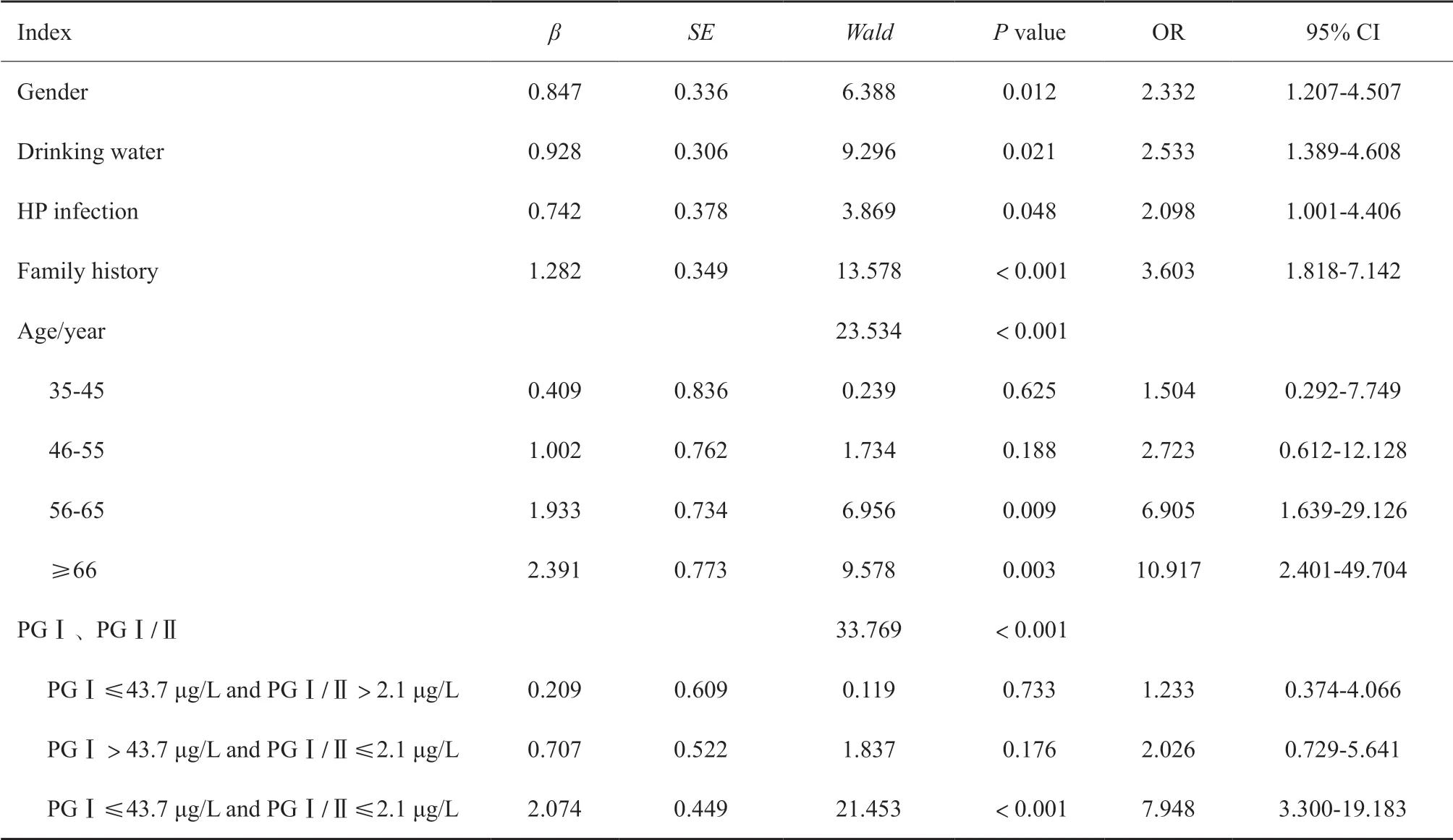
表5 多因素Logistic回归分析Tab. 5 Multivariate Logistic regression analysis

表 6 胃癌各危险因素赋值标准Tab. 6 Criteria for assigning risk factors

图 2 胃癌患者模型评分的ROC曲线Fig. 2 ROC curve of gastric cancer patients' scores
3 讨 论
胃癌的发生是一个多因素、多阶段的病理学过程,除遗传基因作用外,环境致癌物也是重要的参与因素[7]。HP是公认的Ⅰ类致癌因子,萎缩是导致胃癌发生的关键步骤,二者均是患者预后不良的独立预测因子[8]。PG几乎全部由胃黏膜产生,PG水平的高低可准确反映胃黏膜腺体数量及功能状态[9]。根据免疫原性的不同,PG可分为PGⅠ和PGⅡ两类,PGⅠ主要由主细胞、黏液颈细胞分泌,PGⅡ主要由胃体及胃底主细胞分泌,贲门腺及幽门腺也能少量分泌,当黏膜发生萎缩时,PGⅠ显著下降,PGⅡ因胃窦腺发生假幽门腺化生而水平升高。许多研究均表明,PG的动态变化与萎缩性胃炎的发生密切相关,可用于相关疾病的诊断及病情评估[10]。不同国家、不同地区对PG异常的诊断标准差异较大,芬兰与日本学者对PG在胃癌筛查中的作用研究较多,关于PGⅠ异常临界值的报道也不相同,包括≤40 μg/L、≤45 μg/L、≤50 μg/L及≤70 μg/L等,PGⅠ/Ⅱ的临界值也包括≤1.5 μg/L、≤2.0 μg/L及≤3.5 μg/L等。在本研究中,通过ROC曲线发现,PGⅠ≤43.7 μg/L且PGⅠ/Ⅱ≤2.1 μg/L是最佳筛查临界值,此时灵敏度为71.8%,特异度为75.5%,与以往文献报道结果不尽相同,可能原因包括:① 样本来源不同,如居住环境、饮食习惯不同,不同地区胃癌患者的各病因比重不完全相同,因此对PGⅠ、PGⅡ水平的影响大小也不同。② 单中心研究且样本量尚小,尤其是胃癌患者的样本量较小。③ 本研究的对照组为良性胃黏膜相关疾病患者,而不是正常人群,此法在临床中更为实用,但可能会导致临界值上移。
为了构建定量化的风险模型,便于实际临床应用,本研究参考了关于乳腺癌、胰腺癌等研究中的构建方法。在多因素Logistic分析基础上,对各危险因素进行赋值,建立评分模型,最终可得Y=A×年龄+30×性别+30×饮用水+30×HP(+)+50×家族史+B×PG水平(35~45岁:A=20;46~55岁:A=40;56~65岁:A=70;≥66岁:A=80。当PGⅠ≤43.7 μg/L且PGⅠ/Ⅱ>2.1 μ g/L:B=1 0;P G Ⅰ>4 3.7 μ g/L 且PGⅠ/Ⅱ≤2.1 μg/L:B=30;PGⅠ≤43.7 μg/L且PGⅠ/Ⅱ≤2.1 μg/L:B=80)。此模型中涉及的危险因素包括患者年龄、性别、饮用水类型、HP、家族史及PG等,其中年龄、性别、饮用水类型及家族史可通过问诊直接获得,HP及PG检测技术成熟,通过胃镜组织学或血清学检查即可获得,且检测花费少,痛苦小,患者依从性高,易于推广。为了进一步验证上述模型的可靠性,我们根据模型对两组患者评分进行验证,结果发现,病例组评分[(209.78±46.98)分]显著高于对照组[(122.37±56.37)分]。当临界值为156分时,曲线下面积最大为0.876。因此,在模型基础上,我们建议对高危人群实施如下伺机筛查方案:① 对因上消化道不适就诊的患者,进行问卷调查,主要问诊内容包括患者年龄、性别、饮用水类型及家族史等,同时建议患者进行HP、PG检测。② 根据问诊及检查结果,计算模型总分。对总分≥156分者,详细告知胃癌发病的高风险,强烈建议行进一步胃镜检查。对总分<156分者,若患者不愿行胃镜检查,可根据症状可疑程度,先以药物治疗为主,密切随访。本研究立足于门诊筛查,以实用性、简便性为主。但由于成本及样本量限制,本研究中胃癌患者的绝对例数较少(n=101),纳入的相关危险因素还需进一步证明或校正,未来拟在增加样本量的基础上,采用分层分析低、中、高危患者的随访方案。
综上所述,本研究发现,根据建立的胃癌评分模型,对评分≥156分且因消化道相关不适而就诊的患者,应视为高危人群,建议至少每年进行1次胃镜随访。

