免疫磁珠法结合条件培养基进行低密度条件下的神经元原代培养
李玉蕾,颜 慧,苏瑞斌
(军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京100850)
原代培养的神经元因具有能较真实地反映在体神经元特点、实验条件相对恒定、影响因素单一、便于直接观察和各项指标检测等优点,成为神经科学研究领域广泛应用的一种细胞模型[1-3]。在单个神经元生长发育和形态结构研究,突触形成与功能研究,神经元相关蛋白的亚细胞定位和转运以及电生理研究等方面,需要神经元在低密度培养条件下保持良好的生长状态。但神经元作为高度分化的细胞,其生长过程对细胞密度的依赖性较强,常规的神经元原代培养方法无法使其在低密度培养条件下存活。本研究利用免疫磁珠(immunomagnetic bead,IMB)细胞分选技术结合星形胶质细胞条件培养基(astrocyte conditioned medium,A-CM)进行低密度条件下的神经元原代培养。
1 材料与方法
1.1 试剂和仪器
胎牛血清(fetal bovine serum,FBS)、DMEM培养基、Neurobasal培养基、B-27添加剂、含Ca2+和Mg2+的磷酸盐缓冲液(Dulbecco’s phosphate buffered saline,DPBS)和磷酸盐缓冲液(PBS),美国Thermo Fisher Scientific 公司;青、链霉素混合液(100×),北京索莱宝科技有限公司;多聚赖氨酸(poly-L-lysine hydrobromide,PLL)和胰酶,美国Sigma公司;牛血清白蛋白(bovine serum albumin,BSA),北京经科宏达生物技术有限公司;小鼠神经元分离试剂盒、MS柱、磁激活细胞分选仪(magnetic activated cell sorter,MACS),德国Miltenyi Biotec公司;4%多聚甲醛固定液,北京Labgic 技术有限公司;吐温20,国药集团化学试剂有限公司;Triton X-100,北京希凯创新科技有限公司;小鼠160 ku神经丝单克隆抗体、鸡抗胶质原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)多克隆抗体,美国Abcam 公司;Alexa Fluor 488 标记山羊抗小鼠IgG荧光二抗,美国Life Technologies 公司;DyLight 405 标记山羊抗鸡IgG 荧光二抗,美国Jackson Immuno公司;Hoechst33342,美国MP公司;XTD-4体式显微镜,重庆光电仪器有限公司;EVOSf1荧光倒置显微镜,美国AMG公司。
1.2 实验动物
SPF 级新生24 h 内昆明小鼠,雌雄不限,购于斯贝福(北京)生物技术有限公司,实验动物合格证号:SCXK(京)2016-002。
1.3 星形胶质细胞条件培养基的制备
参照张芸等[4]的方法进行星形胶质细胞原代培养。新生24 h 内昆明小鼠,75%乙醇浸泡消毒,断头,沿纵轴撕开皮肤和颅骨,打开颅腔,取出脑组织,体式显微镜下撕去脑膜,取大脑半球,剪碎。加适量胰酶1.5 g·L-1,37℃消化15 min(每5 min震摇1 次),加入等体积含10% FBS 的DMEM 培养基终止消化,玻璃吸管吹打数次至无明显组织块。细胞悬液经70 μm细胞筛过滤,100×g离心10 min后弃上清。用含10%FBS的DMEM培养基吹散细胞沉淀,接种于经PLL预处理的培养瓶,置细胞培养箱培养。第2天更换培养基,培养10 d(每2 d换液1次)后,置37℃摇床15×g振荡18 h,弃培养基。细胞经新鲜培养基洗1 遍,加胰酶1.5 g·L-1消化,传代至75 cm2培养瓶与35 mm细胞培养皿中,并将剩余细胞冻存。经细胞免疫荧光染色鉴定星形胶质细胞的纯度达到要求后,更换含B-27 添加剂的Neurobasal培养基,24 h后更换培养基,原培养基经70 μm细胞筛过滤后即为A-CM。
1.4 免疫荧光法鉴定星形胶质细胞
35 mm细胞培养皿中的细胞弃培养基,PBS浸洗2 次(每次5 min),4%多聚甲醛固定液固定20 min。PBS 浸洗2 次,加含0.2%Triton X-100 的PBS 打孔5 min。PBS 浸洗1 次,加入含10%BSA的PBS 封闭20 min。PBS 浸洗1 次,加一抗(鸡抗GFAP多克隆抗体,1∶100)4℃孵育过夜。含2%吐温20 的PBS 浸洗3 次,加含0.2% Triton X-100 和2.5%BSA 的PBS 打孔5 min;而后加荧光二抗(DyLight 405 标记山羊抗鸡IgG 荧光二抗,1∶100)室温孵育1 h。加含2%吐温20 的PBS 浸洗3 次后,以Hoechst33342 1 μmol·L-1染核5 min,再以含2%吐温20 的PBS 浸洗2 次。用荧光倒置显微镜观察并拍照。
1.5 免疫磁珠法分选神经元
按1.3 取新生24 h 内昆明小鼠大脑,分离海马和皮质,置于不同小烧杯中剪碎,经胰酶消化制成细胞悬液后过筛混匀,而后用台盼蓝染色进行活细胞计数。将细胞悬液以200×g离心5 min,完全吸出上清液。每1×107细胞加含0.5% BSA 的DPBS 缓冲液(简称缓冲液)80 μL和非神经元细胞生物素抗体混合液20 μL,轻柔混匀(不要涡旋),2~8℃孵育5 min。每1×107细胞加缓冲液1 mL 洗涤细胞,4℃、200×g离心5 min,完全吸出上清液。每1×107细胞加缓冲液80 μL和抗生物素微珠20 μL,轻柔混匀(不要涡旋),2~8℃孵育10 min。加缓冲液,调节细胞悬液总体积至500 μL(总细胞数≤1×107)。将MS 柱置MACS 分离器的磁场中,加500 μL 缓冲液润洗MS柱。加细胞悬液,收集含有未标记细胞(即神经元细胞)的流出液。用500 μL缓冲液洗涤柱子3次,继续收集未标记的神经元细胞,与上一步中的流出液合并,经200×g 离心5 min,弃上清,细胞沉淀加入适量A-CM 重悬后用台盼蓝染色计数,按每cm2接种(0.5~1)×104细胞的密度接种至经PLL预处理的24孔板或35 mm培养皿。每48 h半量换液。
1.6 免疫荧光法鉴定神经元
培养6 d 的神经元弃培养基,PBS 浸洗2 次,4%多聚甲醛固定液固定20 min。PBS 浸洗2 次,加含0.2%Triton X-100的PBS打孔5 min。PBS浸洗1次,含10%BSA的PBS封闭20 min。PBS浸洗1次,加一抗(小鼠抗160 ku 神经丝单克隆抗体,1∶100)4℃孵育过夜。加含2%吐温20 的PBS 浸洗3次,含0.2%Triton X-100和2.5%BSA的PBS打孔5 min;加荧光二抗(Alexa Fluor 488 标记山羊抗小鼠IgG荧光二抗,1∶100)室温孵育1 h。含2%吐温20的PBS浸洗3次,荧光倒置显微镜观察、拍照。
2 结果
2.1 制备A-CM所需小鼠星形胶质细胞纯度鉴定
采用抗星形胶质细胞特异性标志物GFAP 抗体进行细胞免疫荧光染色(红色),Hoechst33342标记细胞核(蓝色)进行细胞纯度鉴定(图1)。星形胶质细胞的纯度>95%,达到了制备A-CM 的细胞纯度要求。
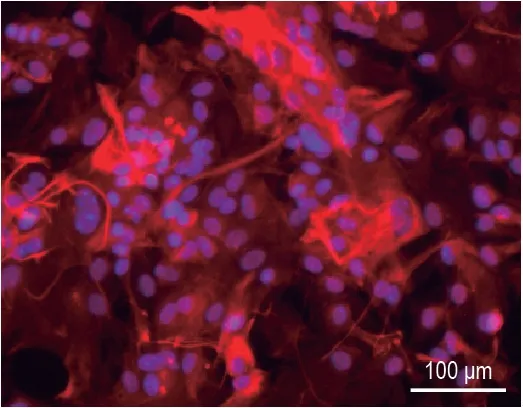
Fig.1 lmmunofluorescence staining of cultured astrocytes with glial fibrillary acidic protein(GFAP)markers.
2.2 lMB细胞分选后小鼠皮质及海马神经元形态观察
倒置显微镜下观察(图2),刚接种的皮质或海马神经元细胞呈悬浮状态,胞体球形,小而透亮。1 d后绝大多数神经元贴壁伸展,产生1~3个短突起,长度10~50 μm。2 d后神经元突起增多,产生二级分支。部分神经元轴突与树突区分明显,突起末端膨大形成生长锥并有许多丝状伪足伸出,表明突起处于生长阶段。个别神经元轴突长度>200 μm。3 d后神经元突起持续增多,产生三、四级分支。部分无轴突神经元发出多个树突形成网状结构,直径为胞体的6~10 倍。5 d 后多数有轴突神经元轴突和树突生长锥明显,无轴突神经元树突的网状结构变得更加密集,表明神经元发育成熟。

Fig.2 Morphology of cultured cerebral cortical and hippocampal neurons at different stages during culture-days in vitro(DlV)1,2,3 and 5.
2.3 lMB细胞分选后小鼠皮质和海马神经元鉴定
采用抗神经元特异性标志物160 ku 神经丝抗体对培养6 d 的神经元进行细胞免疫荧光染色(绿色)(图3)。结果显示,在较低密度下,神经元发育良好,突起多而明显,纯度较高。

Fig.3 lmmunofluorescence staining of DlV 6 cultured cerebral cortical and hippocampal neurons with 160 ku neurofilament medium markers.
3 讨论
与体内或体外高密度培养神经元网络功能分析的复杂性相比,单细胞和小群体分析提高了实验因果关系的精准度。因此,低密度培养条件下的神经元在神经科学研究领域如神经元亚细胞结构变化和离子通道型受体功能等方面发挥着至关重要的作用。然而,维持神经元正常状态依赖于周边神经元和神经胶质细胞的旁分泌营养支持。细胞密度越低,旁分泌支持越少,培养越困难。
目前,神经元的低密度培养主要有3 种方法:①使用含特殊配方的培养基维持神经元的存活,同时抑制神经胶质细胞增殖[5];但该法培养的神经元的表型分化特征不够完全。②在胶质细胞层上方直接接种神经元[6]或在胶质细胞增殖条件下培养神经元,胶质细胞可在神经元下方迅速形成单细胞层[7];该法因神经元和胶质细胞混合培养,不适合活细胞成像或免疫荧光染色。③利用共培养技术,将神经元接种在预先涂有石蜡点作为支撑的盖玻片上,再将其置生长有星形胶质细胞的培养皿中,星形胶质细胞提供神经元生长所需要的营养支持[8];但该法的前期准备工作量较大,操作复杂。
本研究只需预先准备高纯度星形胶质细胞培养物,利用其正常生长过程中分泌的多种神经营养因子制备A-CM,为低密度条件下的神经元提供营养支持。在神经元培养过程中定期半量更换A-CM而无需其他过多的操作即可维持神经元的正常生理状态,且多出的星形胶质细胞可冻存备用。
在对培养神经元纯化过程中,多数研究人员通过在取材过程中剥除脑膜去除成纤维细胞和血管内皮细胞污染,加阿糖胞苷抑制非神经元细胞的增殖,从而提高神经元的纯度[9-10]。阿糖胞苷的作用机制是通过抑制细胞周期S期的DNA合成,从而干扰细胞的增殖。但这一特性也会对神经元产生细胞毒性,影响神经元的存活、形态和功能[11],尤其是在低密度培养条件下。本研究利用IMB 细胞分选技术无需脑膜剥除操作步骤,极大缩短了操作时间及其对神经元存活率的影响;也无需添加阿糖胞苷,缩短了培养周期,提高了实验效率。
IMB技术建立于20世纪80年代。Guesdon和Avrameas[12]在1977 年首先描述了通过丙烯酰胺和琼脂糖的聚合制备的亲水性磁珠的制备方法。1982年,Rembaum等[13]将其应用于细胞分选。目前,细胞分选是IMB应用最主要的一个方面。其基本原理是经过一定处理的IMB 与抗体结合成为抗体载体,再与特异性抗原结合形成抗原-抗体-磁珠免疫复合物,在磁场中通过分选柱时会滞留其中,从而达到分离特异性抗原的目的。包括磁性标记目的细胞的阳性分选和磁性标记非目的细胞的阴性分选。本研究使用的神经元分离试剂盒属于阴性分选,具体来说,是将非神经元细胞如星形胶质细胞、少突胶质细胞、小胶质细胞、内皮细胞和成纤维细胞等利用特异的生物素结合的单克隆抗体进行标记后,再被IMB结合的抗生物素单克隆抗体标记。这些细胞在通过磁场时被截留在MS 柱中,而未标记的神经元细胞得以通过。该法与流式细胞分选技术相比操作过程简单迅速,可实现全程无菌利于细胞的继续培养,细胞活性也不会受到明显影响。
本研究利用IMB细胞分选技术结合A-CM进行低密度条件下神经元原代培养,通过对神经元形态学观察与细胞免疫荧光染色鉴定,培养的神经元显示出正常的生长发育过程和形态结构特点,证明该实验方法简单有效,可重复性高,为神经科学基础研究、相关疾病的机制探讨及药物筛选提供了较理想的实验模型。

