急性冠脉综合征合并高同型半胱氨酸血症病人的临床特点分析及HCY对氯吡格雷抵抗的影响
同型半胱氨酸(HCY)是一种含硫的氨基酸,是蛋氨酸代谢的中间产物,HCY作为独立的心血管危险因素已被广泛接受,是糖尿病、吸烟和高血脂之外的又一危险因子[1]。据大综数据研究报道,血清HCY每升高 5 μmol/L,脑卒中的发生风险增加59%;缺血性心脏病的风险增加32%;每降低3 μmol/L,脑卒中的发病风险降低24%,而缺血性心脏病的风险降低16%[2]。目前关于HCY引起心血管疾病风险升高的原因主要集中于内皮功能受损和血小板聚集增加[3]。前者由于HCY升高致机体氧化应激增强,大量生成氧自由基(ROS)及其他过氧化物而阻碍血管内皮生成一氧化氮(NO),从而损伤内皮细胞[4]。后者机制尚未明确,有文献提出HCY主要通过硫化氢途径诱导血小板聚集[5],导致血栓前状态,从而影响抗血小板药物治疗效果。本研究探讨急性冠脉综合征(ACS)合并高同型半胱氨酸血症病人的临床特点及高同型半胱氨酸血症与ACS病人氯吡格雷抵抗的相关性。
1 资料与方法
1.1 研究对象 选取我院2017年1月—2017年6月初诊为急性冠脉综合征的病人201例。急性冠脉综合征包括急性ST段抬高型心肌梗死、急性非ST段抬高型心肌梗死和不稳定型心绞痛。其诊断主要依靠典型的心绞痛症状、心电图变化及心肌坏死标志物的测量。排除标准:对氯吡格雷过敏或不能耐受;具有抗血小板治疗禁忌证;严重肝脏疾病或凝血功能异常;合并严重脑、肾、肺及造血系统疾病,肿瘤病人;未签署知情同意书者。
1.2 HCY测定方法 入院当天或次日清晨使用EDTA抗凝管采集病人空腹血液2 mL后迅速离心,使用波因特生物科技有限公司生产的HCY检测试剂盒检测血清HCY水平(循环酶学法)。
1.3 研究分组 根据HCY是否大于15 μmol/L分为两组:高HCY组(47 例)、HCY正常组(154例)。
1.4 观察指标 入院当天或次日清晨采集空腹静脉血检测血常规、肝功能、肾功能、血脂、血糖等指标;记录病人既往高血压、糖尿病、吸烟、饮酒、脑梗死等病史,收集病人血浆标本行CYP2C19基因型检测。

2 结 果
2.1 两组临床资料比较 高HCY组男性比例、血尿酸及血肌酐与HCY正常组比较差异有统计学意义(P<0.05),而既往高血压、糖尿病、脑梗死病史及肝功能、血糖、血脂两组比较差异无统计学意义(P>0.05)。详见表1。
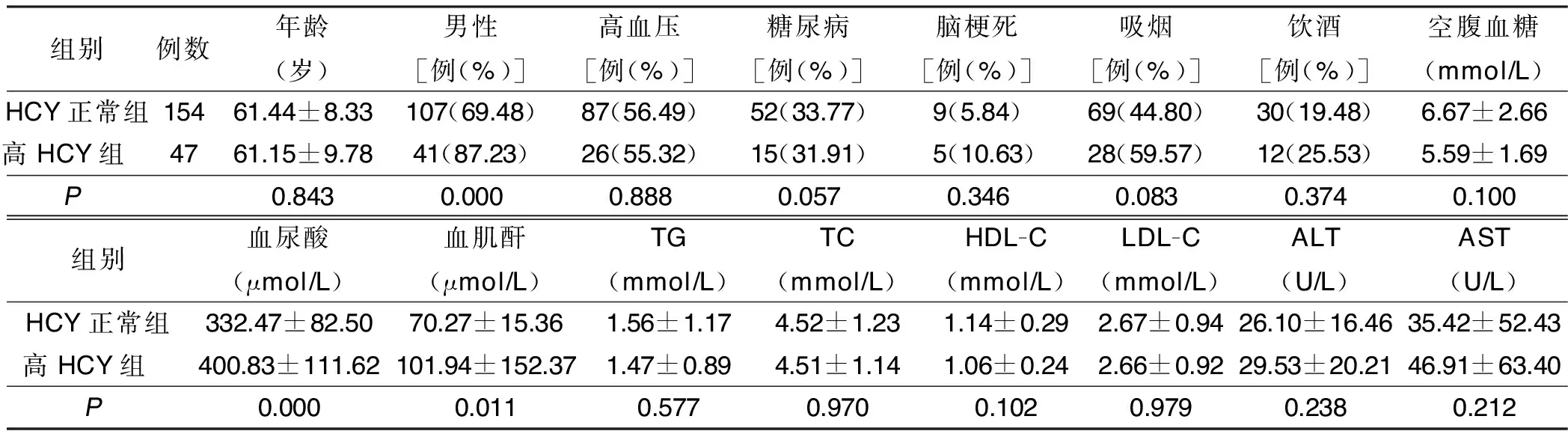
表1 两组临床资料比较
注:TG为三酰甘油;TC为总胆固醇;HDL-C为高密度脂蛋白胆固醇;LDL-C为低密度脂蛋白胆固醇;ALT为丙氨酸氨基转移酶;AST为天门冬氨酸氨基转移酶
2.2 两组氯吡格雷抵抗率比较 高HCY组氯吡格雷抵抗率高于HCY正常组,差异有统计学意义(P<0.05)。详见表2。

表2 两组氯吡格雷抵抗率比较 %
与HCY正常组比较,1)P<0.05
3 讨 论
人体中HCY是由饮食摄入的蛋氨酸(甲硫氨酸)在肝脏中通过与三磷酸腺苷(ATP)在腺苷转移酶作用下形成S-腺苷甲硫氨酸(SAM),再经甲基转移酶去甲基生成S-腺苷同型半胱氨酸(SAH),最终在水解酶作用下去腺苷所产生。其在人体中主要的代谢途径有两种[6],其一是再甲基化途径:在蛋氨酸合成酶(MS)及甜菜碱甲基转移酶(BHMT)催化下,由叶酸及甜菜碱提供甲基供体,重新合成蛋氨酸;其二是转硫化途径:其在胱硫酶β合成酶(CBS)及胱硫醚酶作用下分解为半胱氨酸等。当血浆中HCY水平高于15 μmol/L时被定义为高同型半胱氨酸血症,其对心血管疾病的发生、发展、诊治等各方面均有影响[7]。
在本研究中,高HCY组病人中男性的比率(87.23%)显著高于HCY正常组(69.48%),差异有统计学意义,这一结果与程欣等[8]研究结果相一致,这可能与男性激素水平、饮食习惯(摄入更多含蛋氨酸食物如豆制品、肉类及蔬菜食用量较少)、精神压力、缺乏锻炼等因素相关;而既往高血压、糖尿病、脑梗死等病史两组病人比较差异无统计学意义,提示其较少参与HCY代谢,这一点目前文献尚有争议,需进一步研究加以明确;两组血尿酸、血肌酐水平比较差异有统计学意义,Wang等[9]研究发现,在血尿酸水平相似的情况下痛风病人血中同型半胱氨酸水平高于健康志愿者,且多因素线性回归分析显示,血清HCY与肾小球滤过率呈负相关,提示其与肾功能也具有显著相关性。由此可以看出合并高HCY血症的急性冠脉综合征病人其临床以男性多见,且伴有血尿酸、血肌酐水平改变,需早期对该类病人加用抑制HCY药物治疗,避免加速急性冠脉综合征的病情及导致预后不良。
另一方面,本研究提示高同型半胱氨酸血症与氯吡格雷抵抗之间有相关性,关于氯吡格雷抵抗机制目前尚不清楚,可能是内外因素共同作用所致,外部因素主要包括病人种族、年龄、体质指数、依从性、肥胖、胰岛素抵抗、疾病状态及药物之间相互作用等;内部因素主要与氯吡格雷在体内的吸收和代谢及血小板受体的基因多态性有关[10]。在国内的多项研究中发现,ACS病人药物低反应人群中,大部分携带突变细胞色素CYP2C19基因,该基因可编码体内氯吡格雷代谢过程的关键酶,造成氯吡格雷临床低反应[11]。该基因*2位点缺失会使药物的有效激活酶减少,抗血小板作用降低。在东亚病人中,携带突变*3位点基因较多,造成血小板的高反应性,为心血管疾病的独立危险因素[12]。美国斯坦福大学、食品药品监督管理局(FDA) 等大型机构,在2013 年发布的《对于检测CYP2C19 基因多形性以及血小板活性的抗血小板治疗指南》中明确指出[13],携带突变基因的ACS 病人(包含行经皮冠状动脉介入术后的病人),其产生氯吡格雷药物低反应现象时,可增加氯吡格雷药物剂量,但也会增加术后或预后不良心血管事件发生风险。因此本研究筛选出慢代谢基因型病人作为氯吡格雷抵抗组,发现其与同型半胱氨酸水平具有显著性差别。分析原因可能与氯吡格雷是一种前体药物相关,其需经肝脏代谢才能发挥作用有关。而HCY主要通过肝脏代谢,且高HCY血症对肝脏酶的产生及代谢均有影响。例如氯吡格雷代谢过程中的关键酶——对氧磷酸酶(paraoxonase1,PON1),在循环中由高密度脂蛋白(high density lipoprotein,HDL)携带,同时也参与HCY代谢,PON1活性降低将会通过影响脂蛋白代谢、一氧化氮调节、能量代谢、铁运输和抗氧化防御系统等途径导致脂肪肝,这些途径最终都会显著影响氯吡格雷在病人体内的药物作用[14]。动物实验显示,高HCY血症可下调包括载脂蛋白(ApoA I)、氧化应激相关酶及导致儿茶酚胺类神经递质等相关酶的失活,上调一氧化氮生成相关酶,从而影响氯吡格雷的体内代谢过程[15]。另一方面,高蛋氨酸饮食可能导致肝氧化、氮化压力增加,当被活性巯基氧化时可产生大量的活性氧(reactive oxygen species,ROS),在HCY 氧化过程中产生过氧化酶和过氧化氢,损伤内皮细胞,激发血小板的黏附和聚集,导致血栓形成[16]。此外,HCY可能也会促进炎症反应、胰岛素抵抗[17]、下调血小板P2Y12 受体表达、影响氯吡格雷抗血小板的作用。Raut等[18]指出高同型半胱氨酸血症在体内可通过自氧化产生氧自由基,不仅可致动脉粥样硬化,还会通过凝血酶来激活蛋白酶C,从而抑制血栓调节蛋白的抗血栓作用。另外还发现,一些左室大小及射血分数正常的病人,因其体内高同型半胱氨酸形成的高凝状态,也使其左心室血栓形成风险增加。Woods等[19]在脑动脉血栓为第一表现的病人就诊过程中,其由于同型半胱氨酸代谢中胱硫醚-β合酶的缺乏从而致使反复血栓形成,也证实了同型半胱氨酸代谢过程中由于胱硫醚-β合酶的缺乏从而致使反复血栓形成[19]。
综上所述,同型半胱氨酸对于急性冠脉综合征病人氯吡格雷药物抵抗有影响,且男性、血尿酸及血肌酐水平异常者需更早关注血清HCY变化,尽早干预和治疗。但本研究仍然存在样本数量小、观察时间较短(仅半年)、不能完全排除所有混杂因素等局限性,且各种机制之间相互作用、相互影响,分子生物学机制方面许多问题有待明确,因此还需要更加细致、深入地研究证实。

