急性白血病起始的慢粒急变4例报道并文献复习
张旭艳,涂传清,黎建云,黄 灿,王典文,邹玲丽
(南方医科大学附属深圳宝安医院,广东 深圳510060)
慢性粒细胞白血病(chronicmyeloid leukemia,CML)是一种较为常见的血液系统恶性肿瘤,约占成人白血病的20%,多发生于50岁以上的老年人群,男性较为多见,其病程进展一般较为缓慢[1]。慢粒急变是指慢性粒细胞白血病转变为急性白血病的过程,是慢性粒细胞白血病终末期最为常见的表现,以急粒变最为多见,其余还有急淋变、急单变等[2]。但临床上以急性白血病(acute leukemia,AL)起始的CML十分罕见,文献报道也十分有限,对该病的治疗方法、预后等仍有待进一步研究实践。我院收治4例以AL起始的CML急变病例,其中2例患者在外院接受异基因外周血干细胞移植,疗效满意;1例予以甲磺酸伊马替尼治疗后转为慢性期,再次急变后死亡;另1例诊断后予以羟基脲治疗后死亡。现就以上4例病例进行详细报道,并进行相关文献的复习,探讨其临床特点及治疗方案。
临床资料
1 病例一
患者李××,男性,45岁,因“发现白细胞升高55天”于2014年8月4日入院。一般体格检查:脾中度肿大,无压痛。血常规检查:白细胞:55.67×109/L,中性粒细胞绝对值:25.52×109/L,血红蛋白:98g/L。骨髓形态学检查:增生极度活跃,粒系增生显著,其中中幼、晚幼及杆状核粒细胞明显增多,原始细胞占骨髓有核细胞26%,嗜酸、嗜碱性粒细胞增多,见图1。免疫分型示:原始细胞约占有核细胞25%,主要表达HLA-DR、CD7、CD13、CD33、CD34、CD38、CD117、CD123、cCD3,部分表达CD56,髓系细胞约占有核细胞72.5%,部分考虑存在发育异常。急性白血病AL,MAL(T+M)可能。白血病融合基因:BCR/ABL(p210)(+)。FISH:提示存在t(9,22),阳性率为99%,其中非典型融合信号约占13%。染色体示:49-51,XY,+6,+8,t(9,22)(q34;q11),+10,+19,+der(22)t(9;22)(cp20)。BCR/ABL1融合基因激酶突变阴性;AML预后相关基因突变阴性;腹部B超:脾轻度肿大。诊断:急性混合细胞白血病(双表型慢粒急变);予羟基脲降白细胞,达沙替尼100mg/d靶向治疗。2014年11月复查骨髓示:原始细胞40%;白血病融合基因:BCR/ABL(p210)(+);ABL激酶突变:T315I点突变阳性;融合基因定量:36.46%。考虑急性混合细胞白血病(双表型慢粒急变T315I阳性),予以普纳替尼30mg/d联合DA方案化疗后复查骨髓象提示CR,MRD:0.06%、T315I融合基因定量:3.96%;白血病融合基因:BCR/ABL(p210)(-),诊断为慢性粒细胞白血病慢性期。HLA高分辨配型与胞弟全相合,2014年12月予Bu±Cy+Flu预处理,CsA/FK506+短疗程MTX预防GVHD,回输胞弟供者外周干细胞200mL,CD34+阳性细胞数为3.6×106/L,MNC为3.8×108/kg,回输过程顺利。移植后 +16d,白细胞及血小板植入。移植后多次复查骨髓象示完全缓解,分子学、遗传学均提示正常,腰穿未见白血病细胞;移植后口服环孢素1年,有轻度肝脏GVHD,予间断服用吗替麦考酚酯,2017年2月复查肝功能正常,现仍存活,生存期4+年。
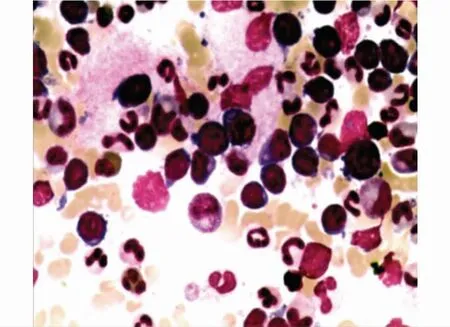
图1 患者患者李××骨髓形态学涂片
2 病例二
患者吴××,男性,37岁,因“乏力、消瘦1月,腹痛3天”于今2014年8月25日入院。查体:中度贫血貌,脾重度肿大,质地硬,压痛。腹部CT平扫检查:脾肿大,脾内多发低密度灶。血常规检查:白细胞:129.72×109/L,中性粒细胞绝对值:76.96×109/L,血红蛋白:87g/L,血小板:63×109/L。骨髓形态学:增生显著活跃,原始细胞占49%(PAS染色阳性),嗜碱性粒细胞增多;免疫分型示:原始异常细胞占27%,主要表达HLA-DR、CD10、CD19、CD20、CD22、CD34、CD38、CD123、cCD79a、DdT,提示急性B淋巴细胞白血病(普通B-ALL可能),见图2;融合基因:BCR/ABL(P210)(+);染色体:46,XY,t(9;22)(q34;q11)[5]/47,idem,+4,-21,+der(22),(9,22);ABL激酶突变:阴性;诊断:①急性淋巴细胞白血病(common B-ALL慢粒急淋变);②脾梗死;入院后予羟基脲降白细胞,达沙替尼100mg/d靶向治疗。2014年9月复查骨髓提示CR骨髓象;FISH:t(9;22)阳性率为25%,达沙替尼加量至140mg/d。2014年12月11日复查骨髓提示CML急变期,原幼淋占92%,外周血占32%;ABL激酶突变:T315I点突变阳性;融合基因定量:36.46%。诊断为:急性淋巴细胞白血病(慢粒急淋变T315I点突变阳性,先后予Hyper CVAD方案化疗1疗程,复查骨髓提示完全缓解骨髓象;MA方案化疗2疗程后复查骨髓象:原幼淋占2%;再次予Hyper CVAD方案化疗1疗程,化疗期间予以多次腰穿+鞘内化疗;与胞妹9个位点相合,2015年5月8日开始FABC+威猛方案预处理,预防GvHD方案为CSA/MMF/MTX,预处理有轻度胃肠道反应。5月18日回输胞妹供者外周干细胞211mL,CD33+阳性细胞数为3.9×106/L,MNC为4.1×108/kg,回输过程顺利。移植后 +12d,白细胞及血小板植入。移植后多次复查骨髓象示完全缓解,分子学、遗传学均提示正常,腰穿未见白血病细胞。移植后出现轻度皮肤GVHD,一直口服环孢素免疫抑制至今,生存期4+年。
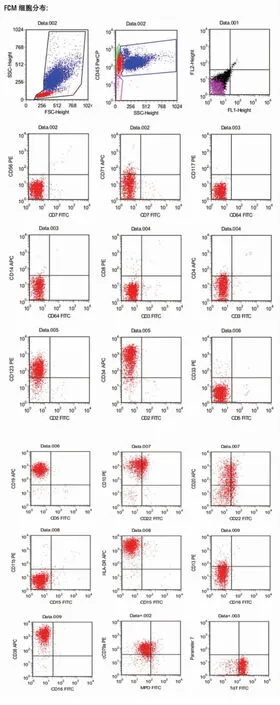
图2 患者吴××免疫分型
3 病例三
患者××,男性,36岁,因“左髋部疼痛1月余,加重伴发热3天”于2015年9月7日入院。查体:中度贫血貌,巨脾,质硬,轻压痛。血常规检查:白细胞:138.10×109/L,中性粒细胞绝对值:48.53×109/L,嗜碱性粒细胞百分比:2.60%,血红蛋白:61.0g/L,血小板:81×109/L。骨髓形态学:增生活跃,其中原始细胞占28%,嗜碱性粒细胞比例偏高;骨髓活检:考虑BL(嗜碱性粒细胞白血病)/CML转BL伴MF,见图3。免疫分型示:原始异常细胞占30%,主要表达CD4、CD7、CD13、CD33、CD38,部分表达CD34,中性粒细胞约占有核细胞的62.5%,部分细胞存在发育异常,考虑AML可能性大;白血病融合基因:P210 BCR/ABL(+);FISH:t(9;22)阳性率为98%,其中非典型信号占48%;染色体示:46,XY,t(9;22)(q34;q11)[20]。B超:肝脏增大,脾脏增大(重度)。上腹部CT:巨脾,并多发低密度灶;髋部MRI示:右股骨头,左股骨头颈部骨质信号改变,多考虑缺血坏死。诊断为:①急性髓系白血病(伴淋系表达慢粒急髓变);②脾梗死;③右股骨头坏死。予甲磺酸伊马替尼400mg/d口服靶向治疗,嘱尽早换用2代TKI酶抑制剂治疗及进行骨髓移植;服药2月后复查骨髓提示完全缓解骨髓象;白血病微小残留示:原始-前体区域细胞约占有核细胞的0.5%,CD34+细胞约占0.47%;其中可见约0.36%(3.6×103)的细胞,考虑为免疫表型异常的残留白血病细胞。间断服药,血小板逐渐减低。2015年11月27日更换为达沙替尼75mg/d 2次。于2015年12月2日因“左眼出血1天”入院,查血常规提示:白细胞:16.78×109/L,中性粒细胞绝对值:6.43×109/L,血红蛋白:93g/L,血小板:57×109/L。骨髓形态学:骨髓象增生活跃,原始细胞占80%(POX染色:阴性);免疫分型示:原始异常细胞占65%,主要表达CD7、CD13、CD33、CD38,部分表达CD34,中性粒细胞约占有核细胞的62.5%,部分细胞存在发育异常,提示急性髓系细胞白血病(AML)。结合病史考虑CML急变。白血病融合基因:P210 BCR/ABL(+);染色体:46,XY,t(9;22)(q34;q11)[3]/50-56,idem?del(7)(q22q33),+8,+10,+13,+15,+19,+21,+21+21,+der(22)t(9;22)[cp12]/46,XY[5]。FISH:t(9;22)阳性率为93%;BCR/ABL融合基因ABL1激酶区发生突变:阴性。仍诊断为:急性髓系白血病(伴淋系表达慢粒急髓变)。2015年12月13日因脑出血死亡。
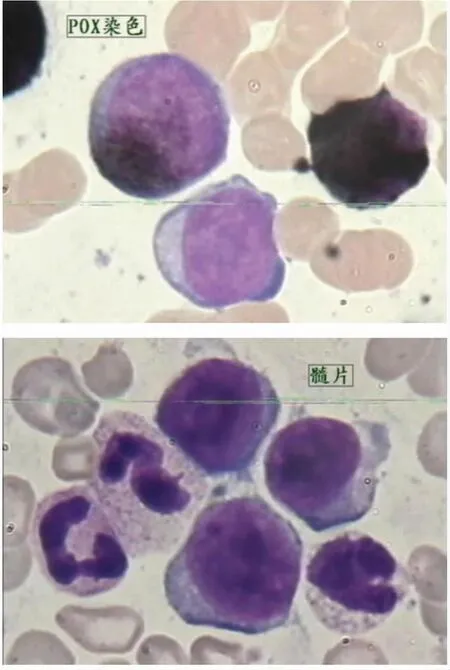
图3 患者××骨髓形态学
4 病例四
患者 ××,男性,72岁,因“乏力,口干1周”于2015年10月7日入院。查体:轻度贫血貌,脾轻肿大,质硬,无压痛。血常规检查:白细胞:280.01×109/L,嗜酸性粒细胞绝对值:2.81×109/L,嗜碱性粒细胞绝对值:9.86×109/L,中性粒细胞绝对值:86.80×109/L,血红蛋白:92.0g/L,血小板:442×109/L;骨髓象:增生显著活跃,粒系增生显著,占93%,其中原始粒细胞占60%,嗜酸性、嗜碱性粒细胞增多;骨髓活检:急性白血病;免疫分型:异常细胞占有核细胞的63.5%,主要表达HLA-DR、CD13、CD33、CD34、CD38、CD117、CD123,提示急性髓系白血病;白血病融合基因:BCR/ABL(P210+);FISH:t(9;22)阳性率为93%,见图4;AML融合基因EVI1阳性。染色体示:46,XY,t(9;22)(q34;q11)[20];B超:脾大。诊断为:急性髓系白血病(慢粒急髓变EVI1+)。予以羟基脲姑息治疗,1年后死亡。
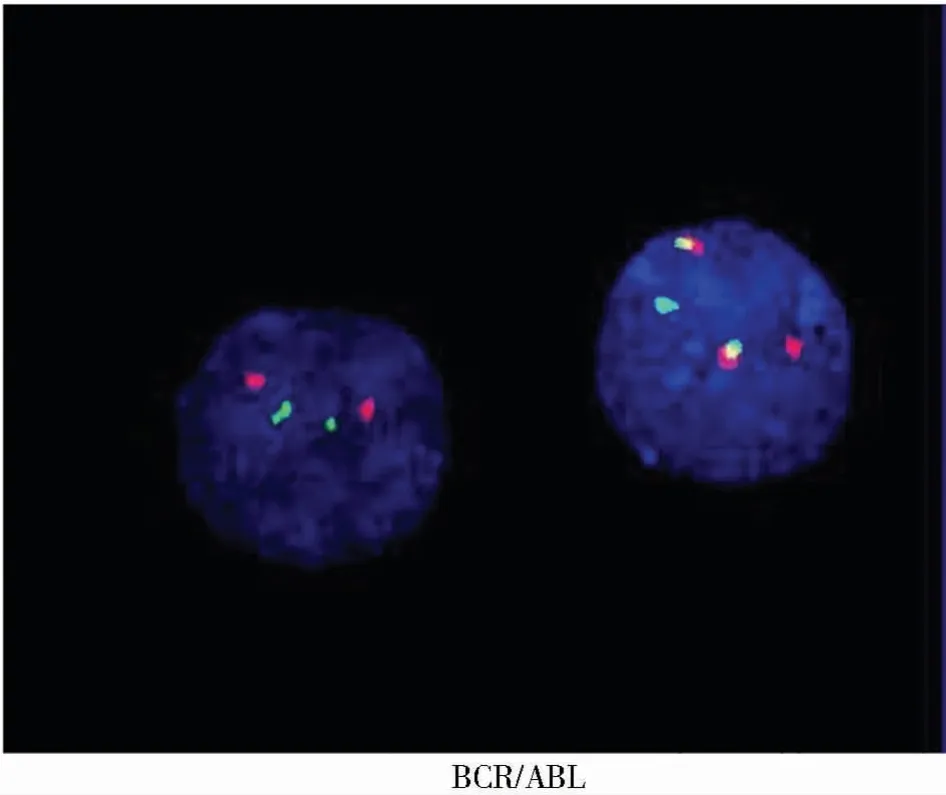
图4 患者××荧光原位杂交(FISH)
讨 论
CML是一类源于造血干细胞的恶性克隆性增殖性疾病,该病的病因目前尚未完全明确,但超过90%的患者会出现费城染色体,即22号染色体长臂与9号染色体发生易位,t(9;22)(q34;q11)[3]。CML可根据骨髓中白血病细胞的数量和症状的严重程度,分为三个期:慢性期(chronic phase,CP)、加速期(accelerated phase,AP)和 急变 期 (blastic phase,BP)[4]。大部分患者在确诊为CML时为慢性期,但在诊断后3~5年内会出现急性变;但也有少部分患者以慢粒急变为首发表现[5]。据统计,在所有慢粒急变患者中,有70%左右为急髓变,包括中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、单核细胞、红细胞或巨核细胞等,也有部分患者为急淋变[6]。但临床上,患者以AL起始的CML急变病例较为少见。本文报道的4例患者,均以AL为首发病例,一例为急性混合细胞白血病、一例为急性淋巴细胞白血病,两例为急性髓系白血病。其中两例患者接受靶向药物及化学药物治疗和异基因外周造血干细胞移植(allogeneic peripheral blood stem cell transplantation,Allo-PBSCT)后,患者获得CR,并长期生存,生存期4+年。目前认为,Allo-PBSCT是治愈CML的唯一手段,尤其是急变阶段,以急性白血病首发病例,有条件尽早行造血干细胞移植[7]。有报道指出,对于不同阶段CML患者,Allo-PBSCT的治愈率有所不同,CP期患者接受Allo-PBSCT治疗后的长期生存率可达到50%~60%,但对于BP期的患者仅为10%~20%[8]。因此,对于BP期患者,予以相应药物治疗使其从BP期转变到CP期是提高患者接受Allo-HSCT后长期生存率的关键。靶向药物酪氨酸激酶抑制剂明显提高CML的缓解率及长期生存期,普纳替尼(Ponatinib)是一种较新的酪氨酸激酶抑制剂,其对BCR-ABL阳性白血病的患者有较为明显的疗效[9-10]。病例一的患者在接受普纳替尼治疗后BP期转变为CP期,再进行Allo-PBSCT治疗。但由于普纳替尼会增加血管重度狭窄或血栓的风险,美国食品药品管理局(FDA)于2013年10月宣布暂停销售。达沙替尼(Dasatinib)是第二代酪氨酸激酶抑制剂,其抑制BCR-ABL酪氨酸激酶活性是伊马替尼的325倍,既往用于CML的治疗,但近年来也被证实可以用于Ph阳性的ALL成年患者,且不会增加患者化疗的毒副作用[11]。彭大鹏等[12]对10例Ph阳性的ALL患者进行达沙替尼治疗,有9例达到完全缓解。与其他酪氨酸激酶抑制剂相似,其主要的血液学不良反应为粒细胞和血小板减少,容易发生出血、感染等并发症。本报道中的病例三慢粒急髓变患者予以甲磺酸伊马替尼治疗后转为慢性期,但患者合并淋系表达、复杂染色体等不良因素,预后差,且患者未及时行异基因造血干细胞移植,短期内再次急变,更换达沙替尼后仍疗效不佳,最终因颅内出血死亡,不排外此类患者容易产生耐药基因。而最后一例患者,老年男性,并伴EVI1表达,在发现急性髓系白血病起病的慢粒急变后,仅采用羟基脲治疗,生存期仅一年。
综上所述,目前以急性白血病起始的慢性粒细胞白血病患者临床上较为罕见,疗效差,使用化疗或靶向药物治疗使骨髓象得到缓解后再进行异基因造血干细胞移植,有望延长此类患者的生存期。

