低氧微环境对胶质瘤细胞增殖和侵袭的影响
时景仁,张文丽,贺文艳,郭晶晶,潘美晨,徐新民,郭 杰,曲 沛,王雅杰
(1.首都医科大学附属北京地坛医院检验科,北京100015;2.首都医科大学附属北京天坛医院,北京100050)
自1955年THOMILINSON等[1]首次发现肿瘤组织内低氧微环境的存在以来,大量研究发现多种实体肿瘤包括脑胶质瘤中,均存在广泛的低氧区域[2-3]。有报道称,随着胶质瘤恶性程度的增加,瘤组织内的氧分压逐渐减低,如WHO IV级胶质瘤的氧分压仅为1%左右[4]。低氧微环境与胶质瘤细胞的增殖、凋亡、侵袭、迁移、血管生成及耐药性等密切相关[3]。低氧诱导因子-1α(hypoxia inducible factor-1,HIF-1α)是介导细胞对低氧微环境进行适应性反应的关键性转录调控因子,通过参与多种靶基因的转录调控影响肿瘤细胞的能量代谢、增殖和凋亡等[5],在各种实体肿瘤细胞中广泛表达。Sox2(SRYlike HMG box 2)是一种肿瘤干细胞转录因子,在胶质瘤细胞中异常表达[6],参与胶质瘤细胞的增殖、凋亡、侵袭、迁移,以及肿瘤耐药、复发等。本研究拟利用低氧工作站模拟体内低氧微环境,研究低氧环境对胶质瘤细胞增殖、侵袭的影响,并初步探讨Sox2在低氧调控细胞增殖和侵袭中的作用。
材料和方法
1 细胞与试剂
人脑胶质瘤A172和U251细胞株购自中国医学科学院北京协和细胞资源中心;DMEM培养基、胎牛血清、胰蛋白酶购自美国Gibco公司;CCK-8试剂盒购自日本同仁化学研究所;Transwell小室、Matrigel胶购自美国BD公司;RIPA裂解液、BCA蛋白定量试剂盒、SDS-PAGE及Western相关试剂购自北京普利莱公司;兔抗HIF-1α多克隆抗体、兔抗Sox2单克隆抗体购自CST公司;化学发光液购自Millipore公司。
2 细胞培养与分组
A172和U251细胞于含10%胎牛血清的DMEM培养基中进行培养。实验分为两组:①常氧组,37℃、5% CO2的孵箱中培养(21%氧气含量);②低氧组,37℃、5%CO2、93%N2的Ruskinn公司低氧工作站中培养(2%氧气含量)。
3 CCK-8法检测细胞增殖水平
取对数生长期的A172和U251细胞,常规胰酶消化后,血球计数板计数细胞,以每孔3×103个细胞的密度接种两个96孔板,每组至少设置5个复孔,一板置于常氧孵箱中培养,一板置于低氧工作站中培养。分别于培养6、24、48、72 h时进行CCK-8检测,每孔加入10μL CCK-8检测试剂,继续培养2 h后,在酶标仪上于450 nm处读取吸光度值。实验重复3次。
4 Transwell检测细胞侵袭能力
取对数生长期的A172和U251细胞,常规胰酶消化后,血球计数板计数细胞,以每孔5×104个细胞接种于Transwell小室中。上室预先铺上基质胶(Matrigel),然后加入300μL无血清DMEM 稀释的细胞悬液,下室加入700μL含20%胎牛血清的DMEM培养基,分别于常氧及低氧环境中培养24 h后,取出Transwell小室,用预冷PBS清洗2次后,再用预冷4%多聚甲醛固定15min,0.5%结晶紫染色0.5 h。小心拭去上室细胞,正置显微镜下计数拍照。实验重复3次。
5 W estern blot检测HIF-1α和Sox2蛋白表达水平
A172和U251细胞分别于常氧及低氧环境中培养24 h后,RIPA裂解细胞总蛋白,BCA试剂盒进行蛋白定量后,取40μg进行SDS-PAGE电泳,然后转印至PVDF膜上,5%脱脂牛奶室温封闭1h,用兔抗HIF-1α多克隆抗体(1∶1000)、兔抗Sox2单克隆抗体(1∶1000)4℃孵育过夜,PBST洗涤3次,加入 辣根过氧化物酶标记的羊抗兔二抗(1∶2000)室温孵育1h,PBST洗涤3次,加入化学发光液在化学发光仪上发光成像检测,图像处理软件Image J测算灰度值。实验重复3次。
6 统计学处理
应用SPSS18.0软件进行数据处理,所有数据均以均数±标准差表示,两组之间差异比较采用t检验,P<0.05为差异具有统计学意义。
结 果
1 低氧对A172和U251细胞增殖的影响
利用CCK-8实验检测细胞在常氧和低氧条件下分别培养6、24、48和72 h的A172和U251细胞增殖水平。结果发现,在两种细胞中,常氧组和低氧组细胞的增殖活性均随时间推移逐渐增加,且低氧组细胞增殖水平高于常氧组,差异具有统计学意义;但在培养至72 h时两组细胞增殖水平无明显差异。
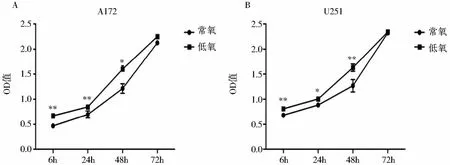
图1 常氧及低氧培养条件下A172和U251细胞增殖活性随时间变化
2 低氧对A172和U251细胞侵袭的影响
采用Transwell实验检测A172和U251细胞在常氧和低氧条件下培养24 h的侵袭水平。结果表明,两种细胞的低氧组穿透细胞数均多于常氧组,差异具有统计学意义,P<0.05。
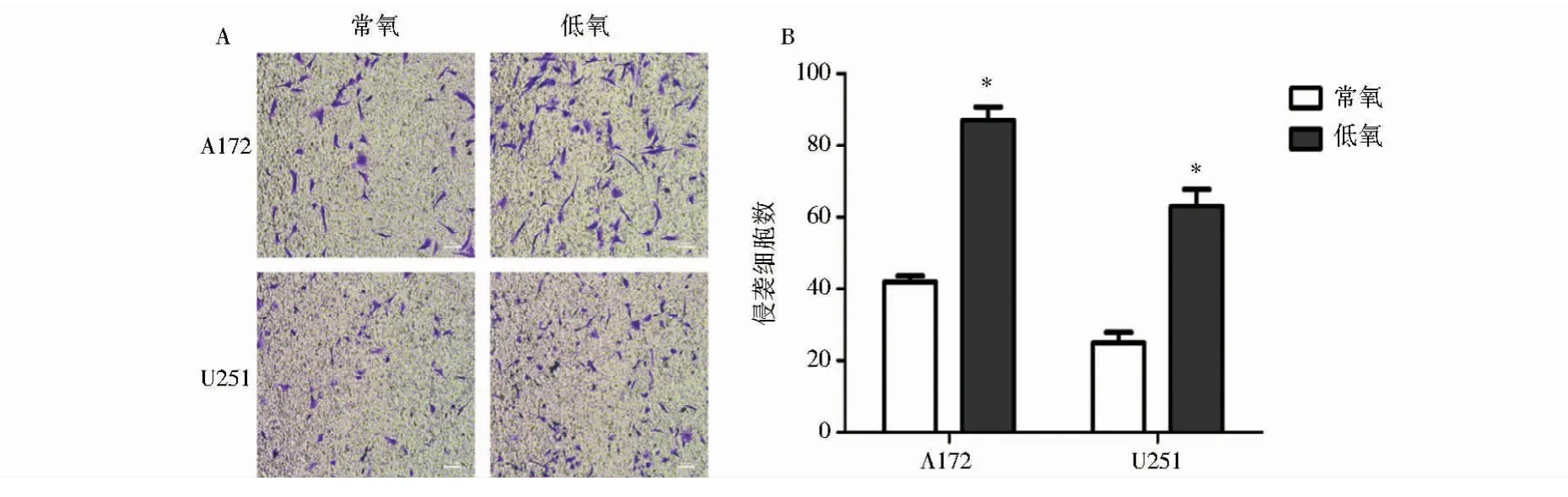
图2 常氧及低氧培养条件下A172和U251细胞侵袭能力
3 低氧对A172和U251细胞HIF-1α、Sox2蛋白表达水平的影响
采用Western blot检测A172和U251细胞在常氧和低氧条件下培养24 h的HIF-1α、Sox2蛋白表达水平,结果用HIF-1α/GAPDH 和Sox2/GAPDH 表示。结果显示A172低氧组HIF-1α/GAPDH 为0.85±0.08,Sox2/GAPDH为1.24±0.06,常氧组HIF-1α/GAPDH为0.31±0.05,Sox2/GAPDH 为0.62±0.05;U251低氧组HIF-1α/GAPDH为0.26±0.06,Sox2/GAPDH为1.09±0.10,常氧组HIF-1α/GAPDH 为0.73±0.11,Sox2/GAPDH 为0.57±0.06。A172和U251细胞低氧组HIF-1α和Sox2蛋白表达水平均高于常氧组,差异有统计学意义(P<0.05)。
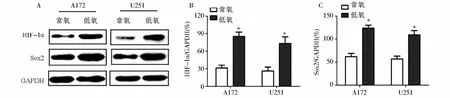
图3 常氧及低氧培养条件下Sox2表达水平
讨 论
随着对肿瘤微环境的深入研究,人们发现肿瘤细胞中的低氧微环境是一个不容忽视的重要因素。低氧可引起肿瘤细胞发生一系列生物学改变,如细胞代谢的变化、基因表达及基因表型改变、蛋白合成变化等[7-9],从而影响肿瘤的增殖、凋亡、新生血管生成、迁移、侵袭等生物学特性[10-12]。因此利用肿瘤细胞进行体外研究时需充分考虑低氧微环境对细胞的影响。
体外构建低氧环境培养细胞系的方法主要有两种:一是通过降低培养环境中氧分压的物理方法,最常用的方法为通过控制三气培养箱中氧气或氮气的输入量,用传感器来实现对氧含量的控制,进行O2、N2和CO2三气控制,达到供氧减少的目的;二是利用化学方法使细胞用氧障碍,即在培养介质中加入氰化物[13]、连二亚硫酸钠[14]或氯化钴[15]等造成细胞用氧障碍或使培养基内的氧气耗尽。但是由于三气培养箱不是封闭装置,不能保证整个培养过程中箱内环境尤其是氧浓度的恒定,而化学方法在诱导低氧发生的同时,还会引起其他各种生化改变,这两种方法均不能很好的模拟肿瘤体内低氧微环境。而低氧工作站涵盖了培养箱、活细胞工作站、生物安全柜的功能,不仅能够严密控制氧气的含量,而且当细胞需要进行处理或观察的时候,无需从培养箱中转入
转出,因此箱内环境如温度、pH值、氧浓度等均不会发生改变,能够很好地模拟肿瘤生长微环境。
本研究利用低氧工作站构建体外低氧微环境,进行胶质瘤细胞生物学特性的研究,同时检测了低氧诱导因子-1α(HIF-1α)的表达。结果发现,低氧环境中胶质瘤细胞的增殖及侵袭能力均高于常氧,且HIF-1α 的表达明显增加,这与既往报道一致[3,16]。但是细胞在培养至72 h时,低氧组与常氧组增殖活性无明显差异,考虑原因可能是96孔板面积较小,培养至72 h时两组细胞汇合度均达到最高,因此未检测出差异。
Sox2作为一种干细胞转录调控因子,不仅在肿瘤干细胞的干性维持上发挥作用,且与胶质瘤、肺癌、乳腺癌、食管癌、结肠癌、脑膜瘤、鼻咽部肿瘤、卵巢癌、宫颈癌等多种肿瘤密切相关[17]。临床研究发现,Sox2在胶质瘤组织中常表现为高表达,且随着胶质瘤恶性程度的增加表达升高[18],并与胶质瘤患者的预后密切相关[19]。基础研究发现,在胶质瘤细胞中过表达Sox2能够促进细胞增殖、侵袭和转移,而利用siRNA干扰其表达后,细胞增殖能力受损[20],侵袭和迁移能力也大大降低[6]。说明Sox2在胶质瘤的发生发展中发挥着重要作用。
目前关于低氧条件下胶质瘤细胞中Sox2表达水平的研究较少。为了解低氧环境中胶质瘤细胞中Sox2的表达水平,本研究利用Western blot对常氧和低氧培养条件下胶质瘤细胞中Sox2蛋白的表达情况进行了检测,结果发现低氧组细胞中Sox2蛋白的表达水平明显高于常氧组,表明低氧微环境促进了Sox2蛋白的表达,从而可能参与细胞增殖及侵袭能力的调控。由于Sox2的上游调控通路主要有Shh、Wnt、FGFR和TGF-β四条[21],Sox2具体通过哪条通路发挥作用需要深入研究。另外,HIF-1α和Sox2蛋白表达趋势一致,此二者之间是否存在调节关系亦需进一步验证。

