青蒿素联合吉西他滨对结肠癌细胞株增殖和凋亡的影响
柯于培, 秦一雨, 舒 涛*
(1.锦州医科大学附属第三医院,辽宁 锦州121000;2.江苏医药职业学院博士后创新实践基地,江苏盐城224005)
结肠癌是消化系统最常见的恶性肿瘤之一,在我国消化道恶性肿瘤发病率中排第二位,发病率逐年升高[1]。近年来随着外科手术和肿瘤治疗方案发展,结肠癌患者生存期和生存率在一定程度上得到了改善,但对于部分在确诊时已处于中晚期的患者来说,大多数已经丧失根治性手术的机会,即使手术切除后出现转移复发的概率也很高。研究表明,晚期结肠癌,尤其是合并远处转移的患者总体中位生存期不超过20 个月[2]。由于目前临床上对该类患者以化疗为主,故探索新型有效的化疗策略对于提高疗效至关重要。
近年来,中医药在肿瘤治疗中的作用逐渐受到重视,一方面患者在手术后可通过中医药干预来扶助正气,促进术后快速恢复,预防肿瘤复发;另一方面,对于一些中晚期患者可采用放化疗联合中医药治疗策略来发挥协同抗癌或增效减毒作用,延长生存期,改善生存质量[3-4]。青蒿素是黄蒿中的一种活性成分,屠呦呦教授因发现其抗疟功效而获得诺贝尔生理/医学奖,近年来研究发现,青蒿素除了抗疟活性外还具有广泛的药理活性,如在体内或体外可抑制多种肿瘤(如白血病、结肠癌、乳腺癌、肺癌、前列腺癌、肝细胞癌等) 的生长和发展[5-10]。课题组前期研究发现,青蒿素能抑制胆囊癌细胞增殖,诱导细胞凋亡[11];本实验将青蒿素、吉西他滨联合应用于结肠癌细胞株LOVO、HT29,观察两者对细胞增殖和凋亡的影响,并初步探讨其分子机制,为开拓临床治疗结肠癌用药新方案提供理论依据。
1 材料
人结肠癌细胞株(LOVO、HT29) 购自中国科学院典型培养物保藏委员会细胞库;人结肠上皮细胞FTC 购自美国ATCC 细胞库;青蒿素、青链霉素购自美国Sigma 公司;吉西他滨购自美国Eli Lilly 公司;DMEM 细胞培养液购自美国Gibco 公司;胎牛血清和胰蛋白酶购自美国Hyclone 公司;Annexin V-FITC 试剂盒购自美国BD 公司;WST-1、JC-1、蛋白提取试剂盒购自上海碧云天生物技术有限公司;PVDF 膜 购 自 美 国Millipore 公 司; 抗p-ERK1/2、 BAX、BCL-2、Caspase-3、细胞色素C 一抗以及二抗购自美国Santa Cruz 生物公司;ECL 化学发光试剂盒购自美国Pierce公司;X-OMAT-Blue film 购自美国Kodak 公司。
2 方法
2.1 细胞培养 LOVO、HT29、FTC 细胞均采用含10%胎牛血清、1 mmol/L 非必需氨基酸、1%青链霉素的DMEM培养基培养在5%CO2、37 ℃条件下的培养箱中,均为贴壁细胞,每天换液,2 ~6 d 传代一次。当细胞汇合程度达80%时,0.25%胰蛋白酶消化传代,继续按上述方法培养。
2.2 Western blot 检测青蒿素对p-ERK1/2、bax、bcl-2 等蛋白在LOVO、HT29 细胞中表达水平的影响。根据蛋白提取试剂盒说明书操作提取细胞浆蛋白和线粒体蛋白,Bradford 法测定各样本中蛋白含有量,95 ℃水浴变性5 min后,将30 μg 蛋白样品加到SDS-PAGE 胶中进行电泳和转膜(0.2 μmol/L PVDF 膜),印记膜用脱脂奶粉封闭,分别加入目的单克隆一抗(1 μg/mL) 在4 ℃下孵育过夜,再加入二抗(0.2~0.5 μg/mL) 在常温下孵育2 h,ECL 化学发光试剂盒对HRP 信号进行检测,X 光片曝光显影。βactin 蛋白作为内参。
2.3 WST-1 取对数生长期LOVO、HT29 细胞接种于96孔板中,细胞密度约为5×103/孔,细胞贴壁过夜,随机分为对照组 (PBS)、青蒿素组 (0、5、10、20、40、80、160 μmol/L)、 吉 西 他 滨 组 (0、 1、 2、 4、 8、 16、32 μmol/L)、联合用药组1(2 μmol/L 吉西他滨联合0、5、10、20、40 μmol/L 青蒿素)、联合用药组2(10 μmol/L 青蒿素联合0、1、2、4、8 μmol/L 吉西他滨)。处理72 h 后,各组细胞加入WST-1 试剂,37 ℃下孵育2 h,检测在450 nm波长下的光密度值 (OD 值),计算细胞存活率[ (实验组OD 值/对照组OD 值) ×100%]。
2.4 药物协同作用分析 建立青蒿素、吉西他滨量效曲线,所得IC50分别设为A 和B,标于坐标轴上(A 标于X轴,B 标于Y 轴),连接A、B 两点的直线为相加线,代表两者作用是相加的,同法得到联合用药时的IC50,两者浓度分别设为2、10 μmol/L,其半数抑制的等效点(a,b)如果在A、B 连线上,表示联合用药为相加作用;在该连线以下,表示联合用药为协同作用;在该连线以上,表示联合用药为拮抗作用。
2.5 Annexin V-FITC 双染法 将细胞随机分为对照组(PBS)、青蒿素组(10 μmol/L)、吉西他滨组(2 μmol/L)、联合用药组(青蒿素10 μmol/L、吉西他滨2 μmol/L)。取对数生长期细胞进行试验,加入药物处理48 h 后,收集细胞至少1×105个,PBS 冲洗后,依次加入FITC-Annexin V和PI 染色液,避光条件下孵育,通过流式细胞仪进行荧光检测。
2.6 线粒体膜电位检测 分组同“2.5” 项。药物处理48 h后取5×105个细胞,重悬于0.5 mL 细胞培养液中,加入0.5 mL JC-1 染色工作液,37 ℃下孵育20 min,4 ℃下600×g 离心3 min,收集细胞,1 mL JC-1 染色缓冲液(1X)冲洗细胞2 次,适量JC-1 染色缓冲液(1X) 重悬,通过流式细胞仪进行荧光检测。检测JC-1 单体时,激发光波长设置为490 nm,发射光波长设置为530 nm;检测JC-1 聚合物时,激发光波长设置为525 nm, 发射光波长设置为590 nm。
2.7 统计学分析 通过SPSS 19.0 软件进行处理,数据以表示,3 组及3 组以上数据统计采用方差分析(One-way ANOVA),两两比较选择LSD 法,所有实验均重复至少3 次。以P<0.05 表示差异有统计学意义。
3 结果
3.1 青蒿素联合吉西他滨联合应用协同抑制LOVO、HT29细胞生长 表1、图1A 显示,吉西他滨可抑制LOVO、HT29 细胞生长,具有浓度依赖性,在0 ~2 μmol/L 范围内2 种细胞生长并未受到显著抑制,而在4~8 μmol/L 范围内明显受到抑制,IC50分别为7.68、8.18 μmol/L。
表1、图1 B 显示,青蒿素对2 种细胞的抑制作用也具有浓度依赖性,在0 ~20 μmol/L 范围内无显著抑制作用,而在40~160 μmol/L 范围具有显著抑制作用,IC50分别为57.34、54.22 μmol/L。
表1、图1C、1D 显示,联合用药组1、联合用药组2均能显著抑制2 种细胞增殖。与10 μmol/L 青蒿素联合时,对吉西他滨的IC50分别为3.12、3.49 μmol/L;与2 μmol/L吉西他滨联合时, 对青蒿素的 IC50分别为 24.57、22.36 μmol/L。通过Isobologram 分析发现,所得IC50落在相加线左下方,表明2 种药物具有协同作用,见图1 E、1F。

图1 青蒿素、吉西他滨对LOVO、HT29 细胞生长的抑制作用
表1 各组OD 值测定结果n=3)

表1 各组OD 值测定结果n=3)
注:与对照组比较,*P<0.05
组别 浓度/(μmol·L-1) LOVO HT29对照组 — 0.963±0.056 0.958±0.039联合用药组1 0 μmol/L 吉西他滨+10 μmol/L 青蒿素 0.952±0.017 0.925±0.025 1 μmol/L 吉西他滨+10 μmol/L 青蒿素 0.822±0.014* 0.824±0.019*2 μmol/L 吉西他滨+10 μmol/L 青蒿素 0.641±0.038* 0.698±0.041*4 μmol/L 吉西他滨+10 μmol/L 青蒿素 0.521±0.005* 0.564±0.024*8 μmol/L 吉西他滨+10 μmol/L 青蒿素 0.331±0.025* 0.341±0.026*联合用药组2 2 μmol/L 吉西他滨+0 μmol/L 青蒿素 0.956±0.025 0.903±0.02 2 μmol/L 吉西他滨+5 μmol/L 青蒿素 0.856±0.029* 0.818±0.018*2 μmol/L 吉西他滨+10 μmol/L 青蒿素 0.641±0.037* 0.698±0.041*2 μmol/L 吉西他滨+20 μmol/L 青蒿素 0.509±0.026* 0.576±0.013*2 μmol/L 吉西他滨+40 μmol/L 青蒿素 0.334±0.018* 0.349±0.032*青蒿素组 0 0.975±0.009 0.980±0.009 5 0.961±0.031 0.943±0.029 10 0.952±0.017 0.925±0.026 20 0.922±0.014 0.862±0.029*40 0.717±0.042* 0.667±0.021*80 0.429±0.022* 0.421±0.011*160 0.216±0.076* 0.241±0.026*吉西他滨组 0 0.979±0.022 0.987±0.008 1 0.948±0.016 0.951±0.006 2 0.931±0.023 0.903±0.02 4 0.828±0.013* 0.881±0.031*8 0.656±0.025* 0.623±0.013*16 0.431±0.032* 0.406±0.041*32 0.256±0.025* 0.221±0.007*
3.2 青蒿素、吉西他滨联合应用诱导LOVO、HT29 细胞凋亡 表2、图2 显示,与对照组比较,10 μmol/L 青蒿素组、2 μmol/L 吉西他滨组LOVO、HT29 细胞凋亡比例并未显著增加(P>0.05),但联合用药组2 种细胞凋亡比例显著升高(P<0.05)。
表2 各组细胞凋亡率(%,n=3)

表2 各组细胞凋亡率(%,n=3)
注:与对照组比较,*P<0.05
组别 LOVO HT29对照组 5.462±0.368 6.833±0.409青蒿素组 5.558±1.053 6.725±0.562吉西他滨组 5.525±1.106 7.692±0.566联合用药组 16.910±0.984* 16.243±0.846*
3.3 青蒿素、吉西他滨联合应用诱导线粒体膜电位下降 图3 显示,在对照组、青蒿素组、吉西他滨组中,LOVO、HT29 细胞内线粒体维持较高的膜电位,红色荧光较强,绿色荧光非常弱;联合用药组红色荧光强度显著减弱,绿色荧光强度显著增强(P<0.05),表明线粒体膜电位下降。
表3 各组JC-1 二聚体/单体荧光比值n=3)

表3 各组JC-1 二聚体/单体荧光比值n=3)
注:与对照组比较,*P<0.05
组别 LOVO HT29对照组 12.795±0.648 9.166±1.181青蒿素组 12.725±1.392 9.391±1.066吉西他滨组 12.191±0.739 9.525±0.745联合用药组 2.576±0.393* 1.576±0.398*
3.4 青蒿素、吉西他滨联合应用调控ERK1/2 信号通路和凋亡相关蛋白表达 表4、图4 显示,p-ERK1/2 在LOVO、HT29 细胞中的表达显著高于在结肠正常上皮细胞(FTC)中,青蒿素组、联合用药组p-ERK1/2 蛋白表达显著降低(P<0.05),而吉西他滨组与对照组无显著差异 (P >0.05)。青蒿素、吉西他滨联合应用后,bax、胞浆细胞色素C 表达升高,而bcl-2、线粒体细胞色素C 表达降低,表明青蒿素、吉西他滨可以促进细胞色素C 从线粒体释放至胞浆。另外,青蒿素、吉西他滨联合应用后细胞内caspase-3 显著增多(P<0.05),表明它被激活。
4 讨论
提高结肠癌药物疗效是有待攻克的临床难题,探索新型治疗策略对提高疗效和改善预后意义重大。1979 年,青蒿素作为抗疟药物最初由屠呦呦教授发现,此后它的其他药理作用逐渐被人挖掘,在过去的15 年间,青蒿素及其衍生物的抗肿瘤功效受到学者们的重视[12],该成分可通过抑制增殖、诱导凋亡、抑制迁移侵袭和肿瘤血管生成等多种途径发挥抗肿瘤作用[13-14]。课题组前期发现青蒿素可诱导胆囊癌细胞凋亡,抑制细胞增殖[11],本实验对青蒿素与目前临床常用化疗药物吉西他滨在结肠癌中的联合应用进行了初步探讨。
首先,通过WST-1 实验发现青蒿素、 吉西他滨对LOVO、HT29 细胞生长具有显著抑制作用,具有浓度依赖性。虽然两者单用在低浓度时对细胞增殖无显著抑制作用,但联合应用后即可显著抑制其增殖,并通过Isobologram 分析发现具有协同作用。
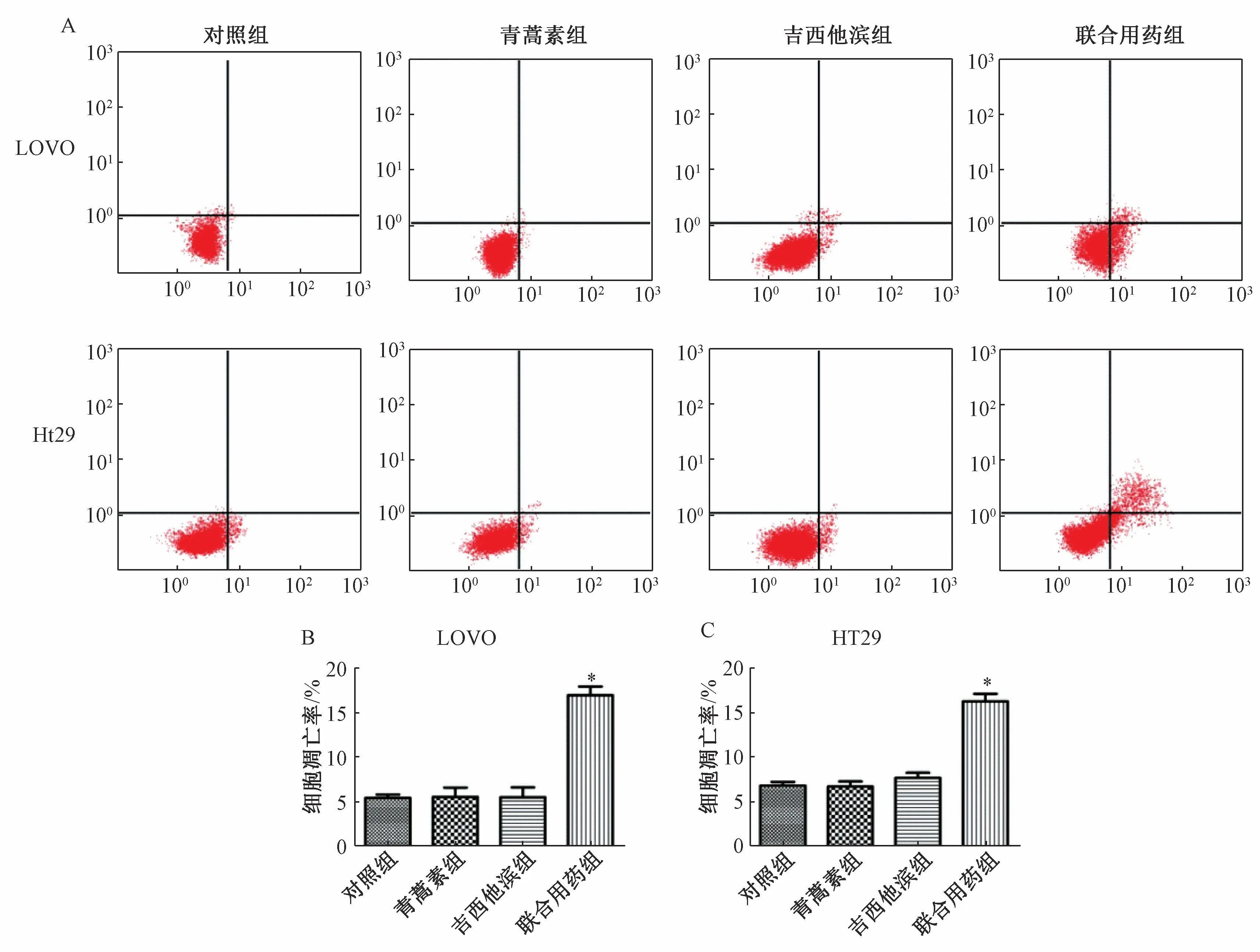
图2 青蒿素、吉西他滨对LOVO、HT29 细胞凋亡的诱导作用
表4 各组灰度值n=3)

表4 各组灰度值n=3)
注:与对照组比较,*P<0.05
细胞 组别 p-ERK1/2 bcl-2 线粒体细胞色素C 胞浆蛋细白胞色素C bax Caspase-3 GAPDH LOVO 对照组 1 1 1 1 1 1 1青蒿素组 0.323±0.011 1.01±0.041 0.983±0.073 0.979±0.09 1.005±0.041 1.011±0.038 1.011±0.012吉西他滨组 1.139±0.006 1.005±0.086 1.021±0.092 0.982±0.083 0.998±0.046 1.017±0.029 1.014±0.043联合用药组 0.354±0.024 0.361±0.044* 0.425±0.007* 2.62±0.121* 3.851±0.152*2.530±0.015*1.029±0.091 HT29 对照组 1 1 1 1 1 1 1青蒿素 0.397±0.035 1.036±0.115 0.982±0.051 0.996±0.025 1.052±0.072 1.058±0.057 1.035±0.029吉西他滨组 1.021±0.080 0.978±0.023 1.016±0.102 1.029±0.085 1.041±0.073 1.024±0.009 1.034±0.038联合用药组 0.397±0.017 0.335±0.0561* 0.335±0.046* 2.870±0.262* 3.121±0.123*2.953±0.078*1.018±0.039
接着,检测青蒿素、吉西他滨对LOVO、HT29 细胞凋亡的作用。FITC-Annexin V/PI 实验显示,两者在低浓度时不能诱导细胞凋亡,但联合用药后即可显著诱导其凋亡。细胞凋亡分为线粒体途径凋亡、死亡受体途径凋亡、内质网途径凋亡,线粒体膜电位的下降是细胞凋亡早期的一个标志性事件。JC-1 是一种广泛用于检测线粒体膜电位的理想荧光探针[15],在线粒体膜电位较高时,它聚集在线粒体的基质中形成聚合物,产生红色荧光;在线粒体膜电位较低时,它不能聚集在线粒体的基质中,此时JC-1 为单体,产生绿色荧光[16],通过JC-1 从红色荧光到绿色荧光的转变检测到细胞膜电位的下降,表明青蒿素、吉西他滨联合应用可诱导线粒体膜电位崩溃。然后,进一步检测线粒体凋亡途径成员bax、bcl-2、细胞色素C 表达,表明青蒿素联合吉西他滨主要通过诱导线粒体膜电位崩溃,释放细胞色素C 到胞浆内,进而激活caspase-3,导致细胞凋亡。

图3 青蒿素、吉西他滨对线粒体膜电位下降的诱导作用

图4 青蒿素、吉西他滨联合应用对ERK1/2 信号通路的影响
ERK1/2 信号转导通路是MAPK 信号转导通路家族中的一员,与细胞增殖、分化、凋亡等过程有着密切关系,是调控线粒体凋亡的重要因素[17]。在许多肿瘤中它通常处于过度激活状态,同时p-ERK1/2 表达异常增高,可诱导肿瘤细胞对吉西他滨耐药[18],而许多药物或试剂可以通过抑制ERK1/2 信号通路进而诱导线粒体介导的细胞凋亡[19-20]。本实验发现, 与结肠正常上皮细胞相比, p-ERK1/2 在LOVO、HT29 细胞中表达显著增高,并且青蒿素及联合用药可显著抑制p-ERK1/2 表达, 表明抑制ERK1/2 信号通路可能是青蒿素、吉西他滨发挥协同抗癌作用的重要机制。
综上所述,青蒿素、吉西他滨可通过抑制ERK1/2 信号通路激活来诱导结肠癌细胞凋亡,抑制细胞增殖,两者联合应用可望成为新型有效结肠癌的治疗方案。
——青蒿素

