脊索瘤的影像特征及预后分析
张璐 窦银聪 程天明 张玉霞 葛英辉
脊索瘤是一种起源于中轴骨脊索残留组织的低度恶性骨肿瘤,发生率占所有原发性恶性骨肿瘤的3%~4%[1]。肿瘤生长缓慢,但具有较高的局部侵袭性[2]。有高达40%~60%的脊索瘤病人在疾病的发展过程中出现了远处转移[3]。由于病人的临床症状和影像表现缺乏特异性,高达70%的脊索瘤病人被误诊或漏诊[4]。因此,充分认识脊索瘤的影像征象,并确定肿瘤部位及侵犯范围,进行早期诊断并手术完全切除具有重要意义。同时探索影响脊索瘤复发和转移的相关因素,为选择合适的治疗方案、减少复发和转移提供参考依据。
1 资料与方法
1.1 一般资料 收集2009年1月—2015年12月河南省人民医院经手术病理证实的脊索瘤病人41例,男25例,女16例,年龄7个月~72岁,中位年龄53岁。其中接受过CT检查的有36例,有MRI检查的30例,5例有单光子发射体层成像(SPECT)检查记录。纳入标准:①术前均行CT或MRI检查;②检查前未经任何治疗。③术后临床及随访资料完整(出院时要求病人术后1~6个月复查CT和MRI)。排除标准:①术前已行放化疗;②病理标本源自穿刺活检而非手术切除的;③失访及随访期间死于其他疾病者。
1.2 设备与方法 CT检查采用16层螺旋CT(Brilliance 16,Philip 公司)和 64 层 CT(VCT,GE 公司)扫描设备。病人采取仰卧位,扫描范围:颅底扫描平行于听眶线,从枕骨大孔到颅底;脊柱扫描以病变椎体为中心,向上下分别多包括2个正常椎体。骶尾部扫描从腰椎下部到骶尾椎下缘。扫描参数:管电压120 kV,曝光量200~280 mAs,准直0.625 mm×64,转速 0.5 s/r,螺距 1.0,层厚及层间距均为1.25 mm。MRI扫描采用3.0 T超导MR成像设备(MAGNETOM Trio,西门子公司),应用相控阵脊柱线圈。 成像参数:T1WI,TR/TE 2 500/27 ms;T2WI,TR/TE 5 000/140 ms;层厚 5 mm,层间距 1 mm,FOV 175 mm×280 mm,矩阵 114×256。 增强扫描采用钆双胺(GE医疗公司),浓度为 0.05 mmol/mL,剂量为0.1 mmol/kg,经肘静脉团注对比剂,注射流率2.0 mL/s。 SPECT(Infinia Hawkye 4,GE 公司)采用99Tcm作为示踪剂获取全身骨显像。
1.3 统计学处理 采用SPSS 19.0统计软件对数据进行统计分析。以病人术后无复发或转移时间为应变量,选取年龄、性别、发病部位、肿瘤大小、是否发生局部浸润、是否伴骨质破坏、肿瘤内是否有钙化以及病理类型共8个可能的相关因素为自变量,采用Kaplan-Meier法计算脊索瘤术后复发率,采用Log-rank法和Cox比例风险模型对可能影响脊索瘤术后复发或转移的因素进行单因素和多因素分析。P<0.05为差异有统计学意义。
2 结果
2.1 随访和病理 41例脊索瘤中,发生在脊索两端共30例(骶尾部21例、颅底9例),非脊索两端11例[颈椎2例、胸椎1例、胸椎脊髓内1例、腰椎椎体2例、腰椎椎管内硬膜下1例、外周组织4例(即右心室1例、心包1例、背部皮下1例、胸壁软组织1例)]。其中,18例发生原位复发,12例合并远处转移,分别转移至腹股沟区、臀大肌、骨盆骨及肺组织等(表1)。41例脊索瘤病人依据组织病理分型分为普通型 31例(76%)、软骨型 7例(17%)、低分化型3例(7%)。普通型术后平均无复发或转移时间为30个月,软骨型为41个月,低分化型为9个月。

表1 12例转移病例具体情况
2.2 影像表现
2.2.1 CT表现 30例骶尾部及颅底脊索瘤病人在CT上表现为受累椎体或斜坡膨胀性溶骨性破坏,伴周围密度不均的软组织肿块,23例病灶内可见不规整散在分布的钙化影或骨化影。3例行CT增强扫描,软组织团块呈现“蜂窝状”强化。腰椎体脊索瘤表现为受累椎体溶骨性骨质破坏伴椎体周围不规则软组织肿块影(图1)。1例外周(心包)脊索瘤表现为胸腔内巨大肿块影,密度不均,内见脂肪影及点状钙化影,肺组织及心脏明显受压(图2)。
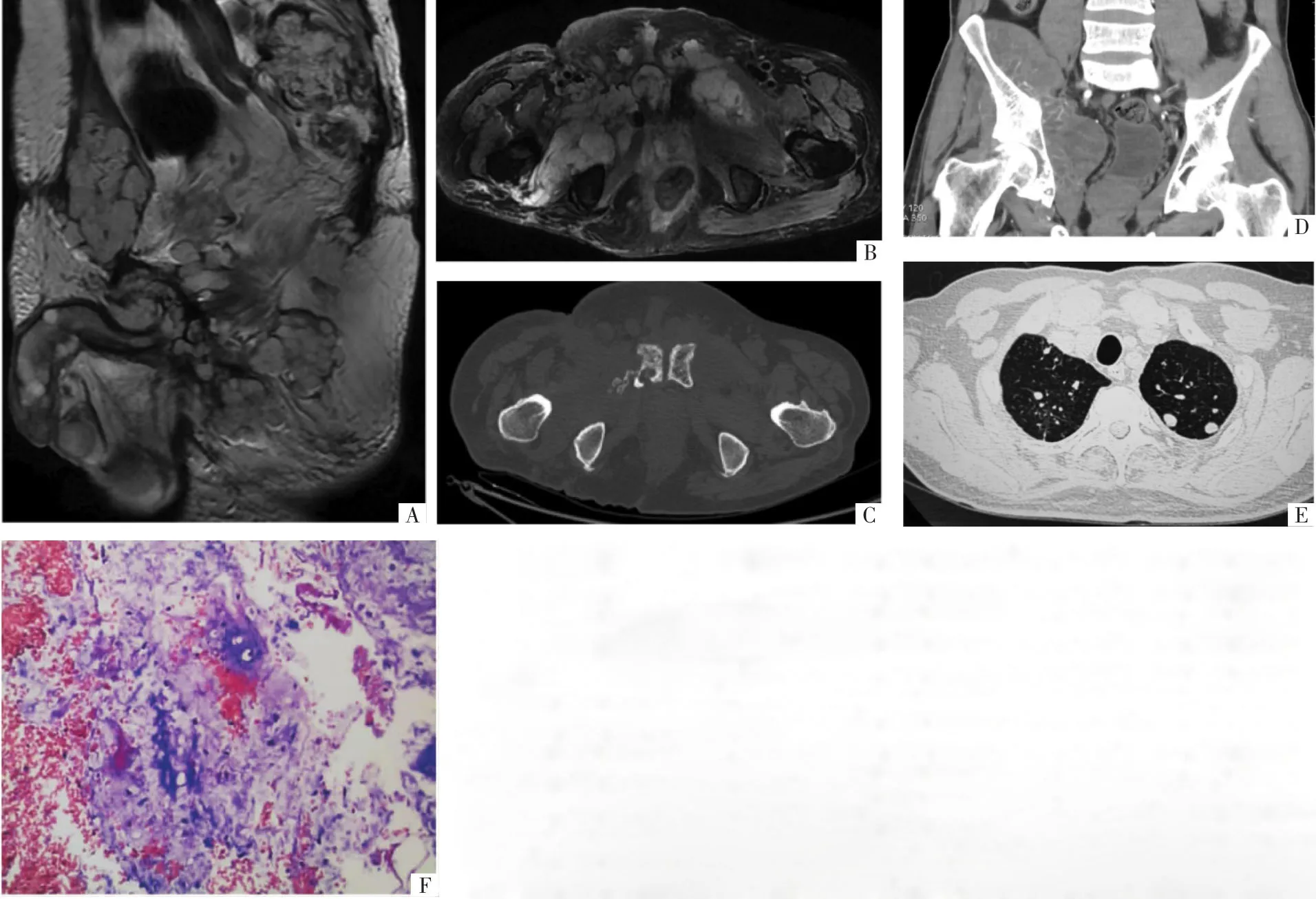
图1 病人男,64岁,原骶尾部脊索瘤,9年共复发8次。复发肿瘤随复发次数的增加范围明显增大。A、B图分别为矢状面、横断面T2WI,骨盆区、双侧大腿根部内侧多发软组织肿块表现为 “卵石状”聚集的明显高信号团块结节,其间有低信号间隔影。C图,横断面CT示耻骨联合右侧溶骨性破坏伴软组织肿块。D图,冠状面CT增强扫描示右侧骨盆区软组织肿块明显不均匀强化。E图,CT示双肺部可见多发转移性小结节。F图,病理图示黏液样基质背景中散在分布少许小圆细胞(HE,×400),结合免疫组化结果[S-100蛋白阳性、胶原纤维酸性蛋白(GFAP)阳性、D2-40阳性、上皮膜抗原(EMA)阴性]诊断脊索瘤。
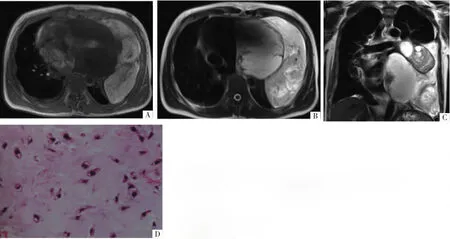
图2 病人男,38岁,咳嗽、胸闷、左侧胸背部疼痛1个月余。A-C图分别为横断面T1WI、T2WI和冠状面T2WI,示左纵隔及心包下边界清楚的团块状混杂T1WI低信号、T2WI高信号影,并可见肿块凸向左侧胸腔,心脏明显受压右移。D图为病理图,示黏液样背景中分布多角细胞(HE,×400),结合免疫组化[S-100 蛋白阳性、波形蛋白(vimentin)阳性、EMA阴性]诊断心包来源脊索瘤。
2.2.2 MRI表现 5例脊椎部脊索瘤软组织肿块呈“蘑菇状”(图3)。T2WI上肿块特征性表现为“卵石状”聚集的明显高信号团块结节,其间有低信号间隔影(图1、4)。1例胸椎脊髓内脊索瘤表现为脊髓增粗,占位效应明显,边界较清晰,Gd-DTPA增强扫描几乎不强化(图5)。

图3 病人男,72岁,臀部及大腿部疼痛3个月。A-C图分别为MRI矢状面T1WI、T2WI、增强T1WI,显示“蘑菇状”软组织肿块影,T1呈混杂稍低信号,T2呈明显高信号,增强后呈明显不均匀团块样强化。D、E图均为冠状面T1WI增强,显示肿块向椎管内突出。F图为横断面T2WI。G、H图分别为CT矢状面重组和横断面影像,显示腰4椎体后部溶骨性骨质破坏,形态欠规整,边缘硬化。I图为病理图,镜下示主要为碎骨组织,少量异常病变成分,诊断脊索瘤(HE,×400)。
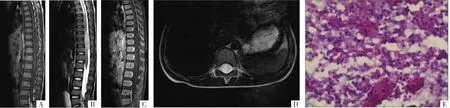
图5 病人女,8岁,腹痛,脐周淋巴结肿大20 d,双下肢无力,伴大小便潴留3 d。A-C图分别为胸腰椎矢状面T1WI、T2WI和增强T1WI,D图为横断面T2WI,示胸9-11椎体平面脊髓梭形增粗,呈T1WI稍高信号、T2WI稍高信号影,占位效应明显,边界清晰,增强扫描几乎不强化。E图为病理图,示黏液背景下见弥漫性分布的小圆细胞及变性的血管样结构(HE,×400),结合免疫组化[细胞角蛋白(cytokeratin)阳性、波形蛋白(vimentin)阳性、EMA阴性,S-100蛋白阳性]诊断脊索瘤。
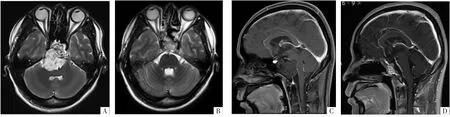
图4 病人男,28岁,复视、头晕1月余,行经鼻蝶斜坡占位切除术。A图,横断面T2WI示术前斜坡骨质破坏并周围团块样T2WI高信号影,病变位于斜坡上硬膜外,脑干受压向背侧移位。B图,鞍区肿瘤切除术后,脑干受压解除。C、D图,矢状面增强T1WI上术前术后改变。
2.3 影像学与病理学对照 普通型脊索瘤其内以经典细胞为主,大量的黏蛋白基质内可见由条索状纤维间隔分隔而成的小叶状结构,其内可见较多富含黏蛋白的空泡细胞,此为典型MRI征象上的表现为明显高信号、其间低信号间隔影的病理基础。软骨型脊索瘤在黏液样基质背景中散在分布软骨样细胞,CT上常可见散在钙化或骨化影。低分化型脊索瘤以去分化梭形细胞肉瘤为主,肿瘤体积较大,信号混杂,缺乏典型脊索瘤MRI征象,CT上骨质破坏区周围骨硬化不明显。
2.4 脊索瘤术后复发和转移因素的相关分析 41例脊索瘤病人中12例复发、6例复发并转移、6例转移,发生于术后1个月~4年不等,1、2、4年复发或转移率分别为 33%(13例)、47%(18例)、81%(24例)。
单因素分析结果显示普通型和低分化型脊索瘤、发生局部浸润(肿块边缘与周围组织呈现齿状或细条状影侵入相邻组织,界限不清楚,周围脂肪间隙模糊为发生局部浸润)以及伴周围骨质破坏的脊索瘤病人术后复发和转移的危险性高于其他脊索瘤病人(P<0.05),不同年龄、性别、肿瘤部位、大小以及瘤内是否伴钙化各因素之间,对于脊索瘤病人术后复发和远处转移时间的差异无统计学意义(P>0.05)(表 2)。
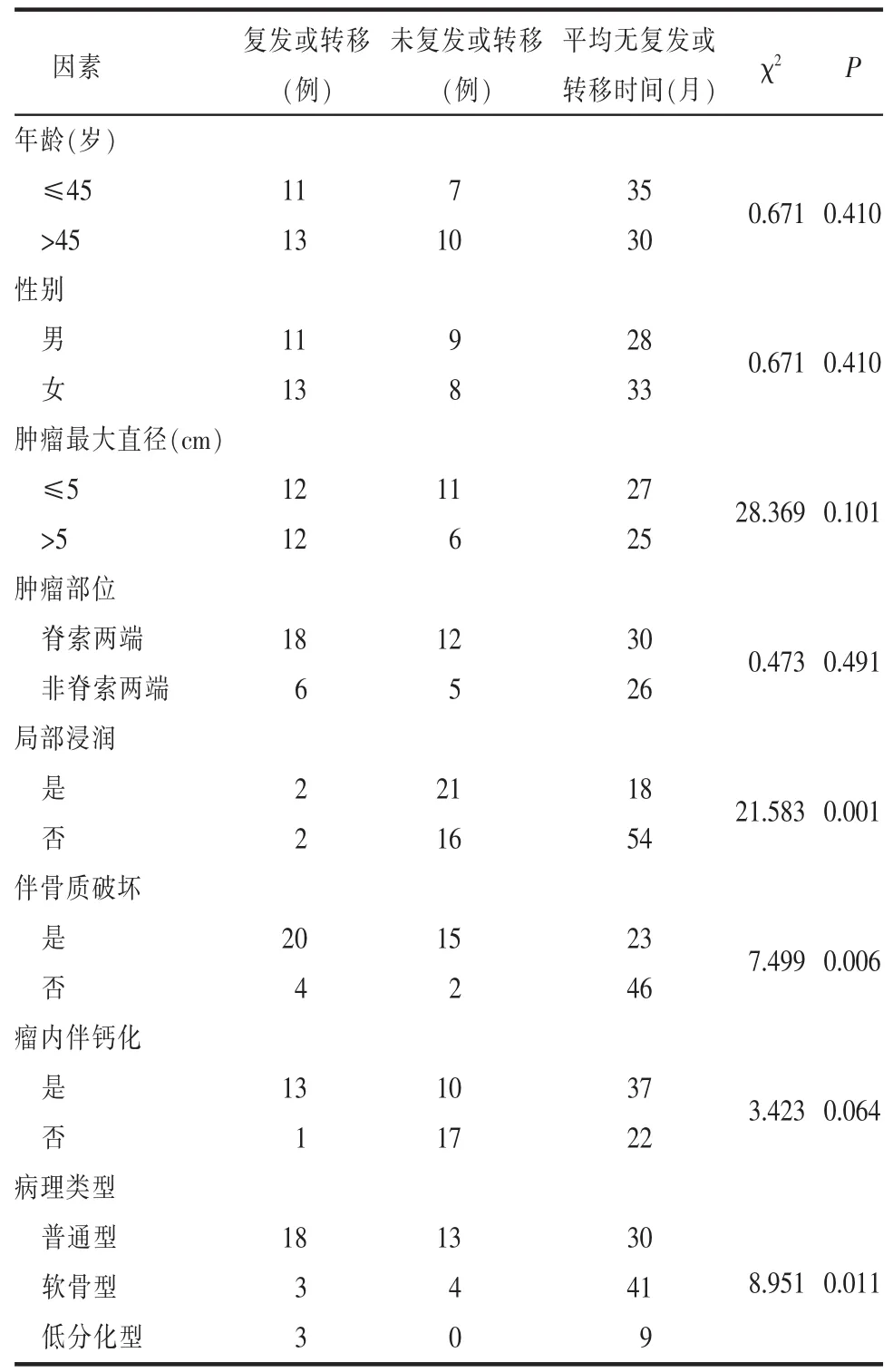
表2 24例脊索瘤病人复发或转移影响因素的单因素分析
将筛选出的是否发生局部浸润、是否伴骨质破坏及病理类型这三个因素纳入Cox比例风险模型进行多因素分析,结果显示普通型和低分化型脊索瘤、发生局部浸润是影响脊索瘤病人复发或转移的独立危险因素(P<0.05)(表 3)。
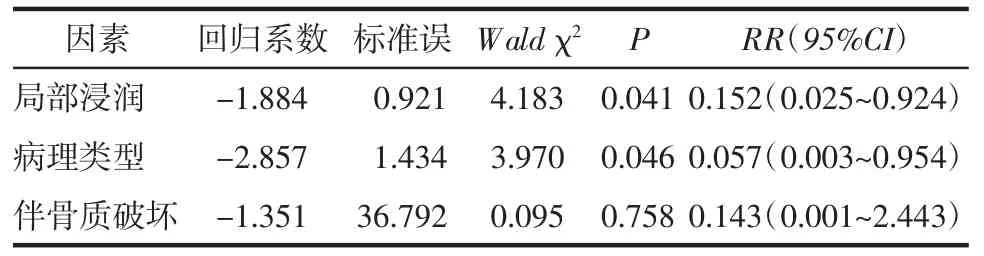
表3 脊索瘤复发或转移预测因素的Cox回归分析结果
3 讨论
脊索瘤来源于残存或异位的胚胎性脊索组织,是继骨肉瘤、软骨肉瘤和纤维肉瘤之后发生率最高的原发性恶性骨肿瘤。主要好发于40岁以上的中老年。男女均可发病,发病率无差异。文献报道脊索瘤好发于脊柱两端,即骶尾部(50%)及颅底蝶枕软骨结合处(35%)[5],本研究中发生于脊柱两端以外的脊索瘤占26.8%(11/41例),远高于文献[5]报道,包括了较大比例在非典型部位发生的脊索瘤。另外本研究首次针对脊索瘤的临床特点以及影像征象与预后的关系进行探讨。
3.1 脊索瘤的影像诊断及鉴别 脊索瘤主要表现为溶骨性骨质破坏及不规则状软组织肿块,内部常伴钙化,MRI表现以“卵石状”聚集的T2WI明显高信号团块间有低信号间隔影为特征。骶尾部的脊索瘤须与转移瘤、骨巨细胞瘤和神经鞘瘤相鉴别。转移瘤多呈跳跃性分布,膨胀性改变少见,溶骨性破坏明显,较少表现为椎体旁孤立软组织肿块[6];骶尾部骨巨细胞瘤好发于骶骨1~3椎体,呈偏心性膨胀性溶骨性生长,可呈特征性肥皂泡样改变,有包壳,内部无钙化可资鉴别[7];神经鞘瘤有明显的穿出椎间孔的征象,且易伴有囊变坏死或出血[8]。颅底脊索瘤应与软骨肉瘤、鼻咽癌相鉴别[9]。颅底脊索瘤通常起源于颅底中线部位,而软骨肉瘤则多起源于岩枕裂,偶见颅底中线部位发病[10];鼻咽部恶性肿瘤常常侵犯部位更靠前,常以累及鼻咽后壁及侧壁为主,且伴随头颈部淋巴结的肿大[11],脊索瘤则以累及枕骨斜坡为主。
3.2 脊索瘤影像征象与复发或转移相关因素分析 CT联合MRI有助于评估肿瘤的部位、大小、边界、肿瘤内部成分和边缘浸润情况。脊索瘤好发于脊索两端,但通过本组病例研究发现,肿瘤是否发
生于脊索两端与本组病人的预后没有显著关联。肿瘤的大小对病人术后复发或转移的影响有不同的报道。Lee等[12]随访409例脊索瘤病人发现,肿瘤体积大是病人死亡风险增加的独立影响因素。但本组分析结果显示肿瘤体积大小不是影响复发或转移的独立预测因素。这可能与本组研究对象仅为住院治疗病人,肿瘤大小的分布比较局限且样本量较小有关。脊索瘤内部常有散在钙化,CT上显示更为敏感,MRI上表现为T1WI及T2WI双低信号影。本研究发现肿瘤内是否伴散在钙化不会对脊索瘤术后复发或转移时间造成显著影响。所以肿瘤内伴钙化的这个因素仅可作为脊索瘤的影像诊断依据,不能作为判断预后的指标。脊索瘤具有较高的局部侵袭性,MRI显示肿瘤的边界更为敏感和清晰。发生局部浸润病人的复发或转移率明显增高[13]。因为脊椎局部解剖复杂、血管丰富、手术显露困难,如果发生局部浸润,肿瘤往往难以彻底切除,术后复发或转移率极高[14]。CT可以更好地显示局部骨质破坏。脊索瘤发生局部骨质破坏的概率极高,说明肿瘤生长期较长、恶性程度较高;同时会增加手术切除的难度和风险,也会增加脊索瘤术后复发的概率。目前有国外文献[15]报道,高达40%~60%的脊索瘤病人在疾病的发展过程中发生了远处转移,晚期可转移至肺、骨、软组织、淋巴结、肝和皮肤等部位。
3.3 病理类型与复发或转移相关因素分析 组织病理学上脊索瘤可分为普通型(经典型)、软骨型和低分化型3种亚型。最常见的是普通型,表现为相对较低的侵袭型。本研究中普通型占76%。软骨型脊索瘤的镜下特点为大量的黏蛋白基质内可见由条索状纤维间隔分隔而成的小叶状结构,且其内可见较多富含黏蛋白的空泡细胞。另外,还含有数量不等的透明软骨样区域。软骨型脊索瘤发病年龄较轻,易与软骨肉瘤混淆,但其预后较普通脊索瘤和软骨肉瘤好。低分化型脊索瘤罕见,侵袭性较强,预后较差。Zou等[16]研究表明病理类型是影响脊索瘤术后预后的相关因素。本研究结果显示,普通型脊索瘤术后平均无复发或转移时间为30个月,软骨型为41个月,低分化型为9个月。7例软骨型脊索瘤术后发生复发或转移的概率(3/7,43%)明显小于普通型(18/31,58%)或低分化型(3/3,100%),即肿瘤的病理类型与预后明显相关,软骨型脊索瘤预后最好,其次是普通型,低分化型预后最差。
3.4 本研究的不足 ①研究样本数较少,本院2009年1月—2015年12月接诊的脊索瘤病人远多于41例,但很大一部分是外院手术病理复发后来诊,未能纳入本研究;②影像检查资料不全面,本组病人同时行CT和MRI检查仅17例,导致分析影像特征时比较局限,不能分别针对CT或MRI征象展开详细分析。
4 结论
总之,脊索瘤是一种复发风险高且有可能发生远处转移的疾病,掌握其典型的影像特征有助于对本病的早期诊断、术前及术后评估。本研究表明低分化型脊索瘤、发生局部浸润以及伴骨质破坏的脊索瘤病人术后复发和转移的危险性较高。年龄、性别、肿瘤部位、最大直径以及肿瘤内是否有钙化不会对脊索瘤术后复发或转移时间造成显著影响。

