宫颈原发性粒细胞肉瘤的MRI诊断及文献复习
彭剑峰 王虹壬 王娟婷 江鹤灵
粒细胞肉瘤(granulocytic sarcoma,GS)是由原始粒细胞或不成熟的髓细胞在髓外增生或浸润形成的肿瘤性包块。1811年首次由Burns报道,1988年Davey提出髓外髓系细胞肿瘤的概念,将其分为原发性GS(非白血病性GS)和白血病髓外浸润GS(白血病性GS)[1]。GS可累及任何部位,原发于宫颈者罕见。就2018年2月于广州市花都区人民医院诊治的1例宫颈原发性粒细胞肉瘤(primary granulocytic sarcoma,PGS)病人情况报告如下,并复习相关文献。
1 资料与方法
1.1 一般资料 病人女,39岁,阴道流血3个月余,B超发现宫颈巨大实性占位来我院诊治,妇科检查:宫颈突出不规则肿物,大小约10 cm×8 cm,边界清,质地中等,接触性出血(+)。肝、胆、脾、胰腺及双肾CT未见异常。MRI考虑宫颈恶性肿瘤。骨髓穿刺未见异常。行开腹全宫切除+双侧附件切除+大网膜部分切除术。病人于术后接受化疗,电话随访病人2个月,病情稳定未见其他情况发生。
1.2 检查方法 采用Philips Achieva 1.5 T超导型MR扫描设备,体部相控阵线圈,扫描范围从耻骨联合上缘至髂嵴区域。首先采用快速自旋回波(TSE)序列行 T1WI(TR/TE 400~600 ms/10 ms)及 T2WI(TR/TE 3 000~5 000 ms/80 ms)检查,扫描层厚 3~5 mm,层间距 1.0~1.5 mm,视野(FOV)30 cm×40 cm,矩阵480×480,激励次数3次;横断面扩散加权成像(DWI)序列,b值取 0和 800 s/mm2。增强对比剂为钆喷替酸葡甲胺(Gd-DTPA,剂量 0.1 mmol/kg),肘静脉注射,注射流率2.5 mL/s,给药后行横断面及矢状面T1WI抑脂序列扫描。
1.3 影像分析及病理检查 由2名高年资影像科医师及1名病理科医师对影像资料与病理特征进行对比,并分析两者之间的关系。以10%甲醛溶液固定病理标本,石蜡包埋、切片,苏木精-伊红(HE)染色,显微镜下观察组织形态学表现,并行免疫组织化学检测。
2 结果
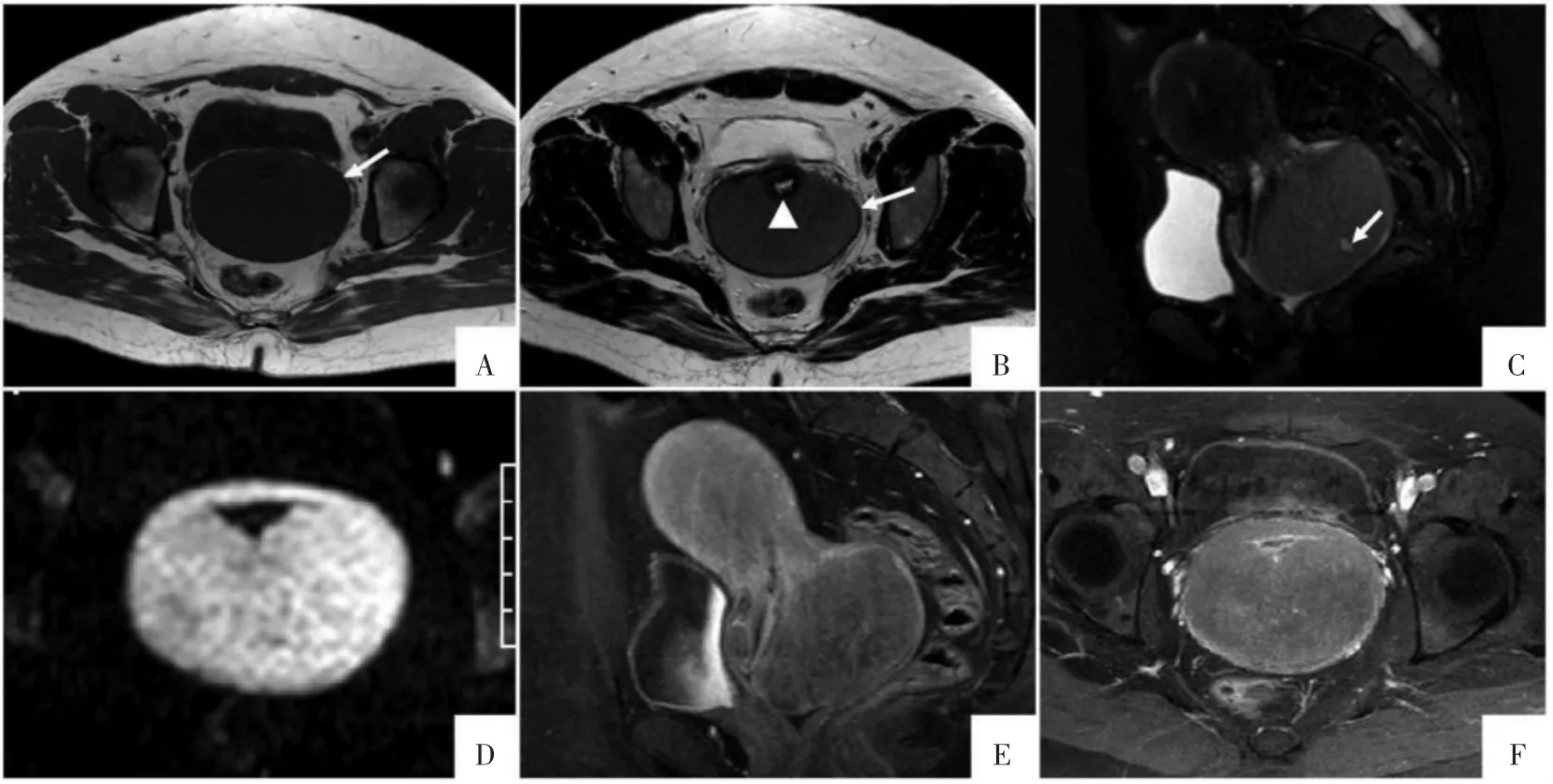
图1 宫颈PGS MRI表现。A图为T1WI横断面影像,宫颈肿物呈均匀等信号(↑)。B图为T2WI横断面影像,宫颈肿物呈均匀稍高信号(↑),宫颈基质环变薄,宫颈黏膜线受压移位(▲)。C图为T2WI抑脂矢状面影像,稍高信号宫颈肿物内见更高信号的小囊变(↑)。D图为DWI横断面影像,b值800 s/mm2,均匀高信号肿块环绕宫颈生长,边界清晰。E、F图为T1WI抑脂增强矢状面和横断面影像,Gd-DTPA增强后肿块强化较均匀,强化程度低于正常子宫肌层。
2.1 MRI表现 宫颈壁显著增厚,见环绕宫颈生长肿物,对比正常子宫肌层,呈均匀T1WI等信号、T2WI稍高信号影,其内见一小囊变,DWI呈均匀高信号,边界清晰,增强后呈均匀中度强化,强化程度较正常子宫肌层低,宫颈基质环相对均匀变薄,宫颈黏膜线完整,受压偏移(图1)。2.2 手术与病理特征 病人于MRI检查后15 d进行了开腹全宫切除及双侧附件切除术。术中见宫颈弥漫性增厚,有一大小约11 cm×9 cm×7 cm的灰白灰褐色肿物,切面呈灰白色、质嫩,局灶呈灰红色(图2A),子宫内膜未见明显异常。镜下见瘤细胞弥漫分布,浸润性生长,残存少许固有腺体,瘤细胞中等大小相对一致,胞质少,胞核呈圆形、卵圆形及不规则形,核分裂象易见 (图2B)。免疫组化结果:MPO(+++),LCA(+++),CD99(+++),CD34(+++),CD117(+++),PAX5(+/-),Ki67(60%~70%+),CD1a、CD2、CD3、CD45RO、CD20、CD79a、CD10、Bcl-6、MUM1、CD5、CyclinD-1、CD30、ALK、SMA、P63、S-100、Syn、CK、TDT均为(-)。诊断宫颈GS(未成熟细胞型)。
3 讨论
GS又称绿色瘤,是一种较为少见的髓细胞系恶性肿瘤,常为急性髓细胞性白血病(acute myeloid leukemia,AML)或其复发的髓外表现,可累及全身各组织器官,以皮肤、淋巴结、软组织和骨骼常见,肾脏是最常见的内脏受累器官[2],亦有累及中枢神经系统、喉部和泪腺等的报道[3-4],而累及女性生殖系统者罕见。极少数女性生殖系统GS发生在AML等血液系统疾病之前,表现为宫颈孤立性包块,称为宫颈PGS,其诊断必须同时符合以下条件[5]:①既往无AML、骨髓增生异常综合征(myelodysplastic syndrome,MDS)或骨髓增生性疾病(myeloproliferative disorder,MPD)病史。 ②骨髓活检无 AML、MDS和MPD证据。③确诊宫颈GS后30 d内未发展为AML。
3.1 宫颈PGS的临床特点 宫颈PGS罕见,发病年龄为20~65岁,平均年龄39岁[5]。本研究统计国内外文献[2,5-9]报道27例宫颈PGS,发病年龄为20~65岁,平均年龄41岁,与佐等[5]统计的18例宫颈PGS的发病年龄相近,其中24/27(88.9%)以不规则阴道流血为首发症状就诊,部分合并痛经、下腹不适、腰痛等临床症状。目前国内外文献报道的宫颈PGS多为病理及临床病例报道,已知MRI个案报道仅为2例[2,9]。本病例发病年龄39岁,临床表现为不规则阴道流血,与文献[2,5-9]符合。

图2 宫颈PGS病理结果。
3.2 宫颈PGS的病理特点及MRI表现 PGS根据组织学形态中髓细胞分化成熟程度分为3型[10]:①主要由原始粒细胞组成的原始细胞型;②主要由早幼粒细胞组成的未成熟细胞型;③主要由较成熟、分化好的髓细胞组成的成熟细胞型。临床最常见的是未成熟细胞型,本例亦属于此型。光学显微镜下瘤细胞弥漫分布且瘤细胞中等大小相对一致,胞质少,胞核呈圆形或椭圆形、不规则形,核分裂象多见。PGS镜下表现与淋巴瘤类似,又因为缺乏AML等相关血液学证据,极易误诊。Menasce等[11]报道85.7%(12/14)的PGS早期误诊为非霍奇金淋巴瘤。与Yamauehi等[12]和Leenman等[13]的研究观点相同。本例病例术前活检同样误诊为淋巴瘤,术后依靠免疫组化检测确诊为GS。
宫颈PGS恶性程度较高,瘤细胞大小相对一致,排列紧密,核质比例大,肿瘤密度相对较均匀,囊变、坏死及钙化少见[5]。因此,相对子宫肌层,T2WI呈等或稍高信号,T1WI呈等或稍低信号,DWI呈明显高信号,信号均匀,边界清晰,较均匀中度强化。Shinagare等[14]研究69例GS病人的MRI表现,与肌肉信号比较,T1WI上75.6%呈等信号、24.4%呈低信号,T2WI上95.1%呈轻度高信号,76.3%均匀强化。此外,亦有宫颈PGS信号不均,内见小囊变的报道[2]。本病例T2WI为稍高信号,T1WI呈等信号,与文献报道相符,而偏心区域见一小囊变,可能由于肿块生长速度快,体积较大,局部血供缺乏导致囊变。宫颈PGS起源于宫颈间质,沿宫颈长轴或包绕宫颈生长,因此宫颈黏膜多不受侵犯。本病例肿块DWI上呈均匀高信号,边界清晰,并见环绕宫颈生长,而且宫颈黏膜显示完整清晰,仅表现为受压偏移改变,具有一定特征性。
3.3 宫颈PGS的鉴别诊断 良性宫颈增大疾病DWI常呈等信号,结合MRI特点,与宫颈PGS鉴别不难。①子宫腺肌瘤:子宫颈局限性增大,边界不清,信号不均,T1WI及T2WI内可见不同时期混杂信号出血灶,子宫结合带增厚。②平滑肌瘤:往往局限于宫颈一侧,当发生变性时,水分或血液增多,T2WI表现为低信号肿块内斑片状高信号,此时两者容易鉴别;如肌瘤未发生变性,T2WI常呈均匀低信号,且信号低于子宫结合带。
宫颈PGS还需与DWI高信号的恶性宫颈增大疾病鉴别。①宫颈癌:T2WI宫颈肿块呈高信号,T1WI等低信号,信号不均匀,常见坏死,强化更明显,宫颈基质环及黏膜线常被破坏。②平滑肌肉瘤:T2WI信号相对更高,囊变出血多见,可见假包膜形成,且强化程度较子宫肌层更明显。③淋巴瘤:宫颈淋巴瘤与GS均为造血系统肿瘤,其镜下组织学形态及MRI表现相似,鉴别诊断主要依靠免疫组化检测。
因此,当遇到无AML病史宫颈孤立性肿块,特别是MRI显示该肿块环绕宫颈生长,T2WI均匀稍高信号,T1WI低信号,DWI明显受限,但宫颈黏膜线完整,增强后均匀中度强化时,除了要考虑淋巴瘤,也要考虑到PGS的可能性,确诊需要结合病理免疫组化检测。

