基于脂肪酸分析的中国南方沼蛤食性研究
董浩韬 杜至力 张锐坚 刘颖诗

摘要:沼蛤(Limnoperna fortunei)作为亚洲地区淡水环境中主要的土著双壳贝类群之一,其滤食生理活动对水环境产生重要的影响。本研究以沼蛤以及浮游生物(plankton)、悬浮有机颗粒(POM)和沉淀有机颗粒(SOM)为研究对象,检测以上研究对象的脂肪酸标志物,分析沼蛤可能的食物来源。根据脂肪酸标志物检测结果,沼蛤主要摄食绿藻纲(Chlorophyceae)、隐藻纲(Cryptophyceae)、甲藻纲(Dinophyceae)、细菌和陆源有机物。
关键词:沼蛤;食性分析;脂肪酸
中图分类号: X174 文献标识码:A 文章编号:2095-672X(2019)05-0-04
DOI:10.16647/j.cnki.cn15-1369/X.2019.05.064
Abstract:Limnoperna fortunei (L. fortunei ) is one of the most abundant freshwater bivalves in southeast Asia, with wide-ranging direct and indirect impacts on ecosystems. To estimate material flows in the habitats of L. fortunei, a fatty-acid analysis was applied to assess the feeding spectrum of L. fortunei in southern China. Based on the fatty acid data, it was estimated that L. fortune consumed or selectively accumulated Chlorophyceae, Cryptophyceae, Dinophyceae, bacteria and terrestrial organic matter.
Keyword:Limnoperna fortunei;Feeding ecology;Fatty acid
沼蛤(Limnoperna fortunei),同種异名湖沼股蛤(Limnoperna lacustris),又称金贻贝(Golden mussl)、淡水壳菜,是一种亚洲淡水贻贝,属软体动物门(Mollusca),双壳纲 (Bivalvia),贻贝科(Mytilidae),股蛤属(Limnoperna)[1]。沼蛤原产于东南亚地区的淡水河流和湖泊中,曾入侵香港的原水供水系统,其在管道及泵房造成生物污损密度达每平方米11,000个[2]。由于沼蛤具有很强的适应性和群集性,沼蛤的侵入影响原有水生食物链的平衡,并改变原水体中的底栖生物群落结构。
沼蛤以滤食悬浮物为主,而悬浮物则主要来自水层和底质,包括各种粒径大小的浮游生物、水底再悬浮的有机质、矿物碎屑以及微生物等[3-5]。其中,矿物碎屑往往又是浮游生物、藻类、原生动物和细菌等有机质的载体[6]。水环境中有机质来源的多样性导致了沼蛤食物来源组成复杂。目前,本地区对沼蛤的研究集中在其作为生物污损物种的生理习性和治理[7]等方向,而对它的食性分析及其对浮游生物的影响则较少。
近年来,脂肪酸标志法在研究双壳贝类食物来源的领域中得到应用。例如,许强[8]分析了相孔扇贝、紫贻贝和长牡蛎的食物来源;高菲等[9]分析了刺参的食物来源,还有姜绪[10]研究了虾夷扇贝食物来源对生长和呼吸代谢的影响。因此,脂肪酸标志法可为研究确定沼蛤的食物组成并进一步了解它们的摄食倾向提供新的途径。本研究选择原水管中附着生长的沼蛤为研究对象,应用脂肪酸标志法分析沼蛤可能的食物来源。
1 材料与方法
1.1 样本采集和预处理
研究所用plankton样本、POM样本和SOM样本于2016年3 - 11月期间每月取自广东西江流域(23°08′12″N,112°48′7″E,地理位置如图1所示)。采样点水质长期属于 I 类地表水。采用孔径为60 ?m的浮游生物网于水深2 - 8m,在垂直方向反复多次拖网采集plankton样本。采集30 L淡水并分装存于经酸洗预处理的聚乙烯瓶中,用于过滤分离提取POM样本。使用沉淀颗粒采集器(直径为300 mm,PC-300, Mooring Systems Inc., Cataumet, MA)于8 - 10m水深处采集SOM样本。在采集上述样本的同时,用深潜的方式采集河床深度为2 - 10m的沼蛤样本(体长 ≥ 22 mm)。所有样本采集后需迅速存于4℃冷藏环境中,然后运至实验室进行预处理。
上述样本在检测之前均需进行预处理。plankton样本首先进行冷冻干燥,然后研磨成粉末装在经酸洗预处理的聚乙烯袋中-80℃保存;用于过滤提取POM的水样,首先采用孔径为200 ?m的筛网去除大颗粒物,然后再用玻璃纤维滤膜过滤,用超纯水洗出过滤物,冰冻干燥并装在经酸洗预处理的聚乙烯袋中-80℃保存;SOM样本首先进行冰冻干燥,然后用300 ?m的钢筛网去除大颗粒物,并装在经酸洗预处理的聚乙烯袋中-80℃保存;在提取消化腺组织之前,沼蛤样本需采用经过滤的河水培养24h,然后采用塑料刀解剖,所得的消化腺组织最后用超纯水超声清洗。10个沼蛤样本的消化腺组织为一个待测样本,每个待测样本首先冰冻干燥,并装在经酸洗预处理的聚乙烯袋中-80℃保存。
1.2 脂肪酸标志法
脂肪酸分析所用器具均为玻璃制品,使用前用需450℃灼烧4h除去干扰物。脂肪酸分析操作参考Parrish[11]和许强[8]等人的研究,主要步骤包括:总脂抽提、脂族分离(仅用于沼蛤样本)、脂肪酸甲酯(FAME)制备与纯化和气相色谱分析。
1.2.1 总脂抽提
用研钵磨碎冻干组织成粉状,称取0.5 g样本加入离心管,加入10 mL二氯甲烷/甲醇(2:1,v/v)混合液;加入2.5 mL超纯水,漩涡混合30 s,超声(冰浴)提取5 min;3000rpm×5min离心分层;双吸管吸出下层二氯甲烷相至称重小瓶;离心管中加入二氯甲烷5 mL,重复提取一次;吸出下层相,和第一次提取合并;40℃水浴N2吹干总脂,称重得到总脂肪重量;加入0.5 mL二氯甲烷重溶,总脂4℃冷藏待分析。
1.2.2 脂族分离
配制正己烷/无水乙醚/乙酸(90:10:1,v/v)展层剂50ml,加入双槽层析缸中;用移液枪吸取总脂样本在硅胶G层析板上划线点样,每板4个样,并同时点TAG标准品。N2吹干溶剂;层析板放入层析缸中,每次兩个板;吹干溶剂后喷4% I2-甲醇溶液显色,对照标准品位置切下黄褐色TAG部分转移至10 mL玻璃试管中,加入3 mL二氯甲烷,漩涡混合30 s提取,2500rpm×5min离心,取上清液至称重小瓶,40℃水浴N2吹干;加入1 mL二氯甲烷重浴。
1.2.3 脂肪酸甲酯(FAME)制备与纯化
吸取含脂量1-5mg的脂肪样本至色谱瓶,N2吹干溶剂,加入500 μL正己烷,充入N2气拧紧盖子震荡,80℃×2h水浴;取出后置冷水浴中冷却,加入250μL正己烷和125μL超纯水,充分震荡提取FAME;静置或1500rpm×5min离心加速分层,吸取上层相至小试管,下层相重复加入500μL正己烷提取一次,上层相则与第一次提出合并;上层相N2浓缩至200μL左右;短滴管塞入棉花团,称0.5g柱层析硅胶装柱至滴管高度的一半,一倍柱体积二氯甲烷和正己烷/乙醚(95:5)分别冲柱后上样,两倍柱体积正己烷/乙醚(95:5)洗脱,洗脱液收集至10 mL试管中;40℃水浴N2浓缩至500μL,转移至2 mL色谱瓶中,继续浓缩至合适体积,充入N2气置于-20℃保存待分析。
1.3 气相色谱分析
仪器为岛津GC-9A气相色谱仪,色谱柱为DB-FFAP毛细管色谱柱。进样体积1μL。载气用氢气,流速1.5mL/min。进样口温度250℃。单个色谱峰对照Cod Liver Oil(Sigma Co.,USA)标准品定性。对所有出峰进行面积归一化后确定每种脂肪酸在总脂中的相对百分含量[12-13]。
根据沼蛤可能获取的食物来源[3,4,6,14],本节试验选取以下几种脂肪酸作为其各主要食物来源的标志(见表1):
1.4 数据处理
数据分析采用SPSS软件(版本号19.0)。脂肪酸标志物数据的分析,统计了平均值和标准差,并采用LSD(Fishers least significant difference)方法分析最小显著差异。
2 结果与讨论
2.1 脂肪酸标志物检测结果
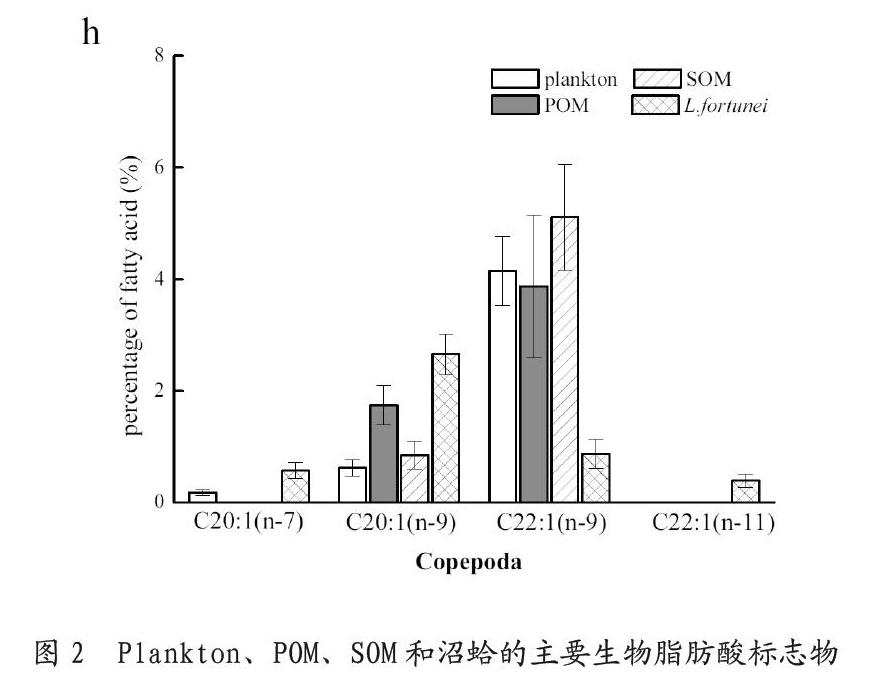
plankton、POM、SOM和沼蛤样本的脂肪酸组成见表2。在饱和脂肪酸(SFAs)中,SOM的饱和脂肪酸(SFAs)相对比例最高(49.73%),其后从高到低依次为POM、plankton和沼蛤。C14:0、C16:0和 C18:0是各样本的SFAs主要标志物,但相对比例存在显著差异(P < 0.05)。各样本的单一不饱和脂肪酸(MUFAs)相对比例为21.85% - 29.99%,其中主要标志物为C16:1(n-7 + n-9)、 C18:1(n-7)、 C18:1(n-9)、 C20:1(n-9) 和C22:1(n-9)。在个样本的MUFAs中,C18:1(n-7)和C20:1(n-9)是沼蛤的主要脂肪酸标志物,而plankton、POM和SOM的主要脂肪酸标志物则为C16:1(n-7 + n-9) and C22:1(n-9)。各样本的多元不饱和脂肪酸(PUFAs)相对比例为11.23% - 33.93%,其中SOM的PUFAs相对比例最低,而沼蛤的PUFAs相对比例最高。在支链饱和脂肪酸(BrFAs)中,各样本均含有15-iso、16-iso、16-anteiso和17-iso等主要标志物, SOM的15-iso和17-iso相对比例明显高于其他样本。
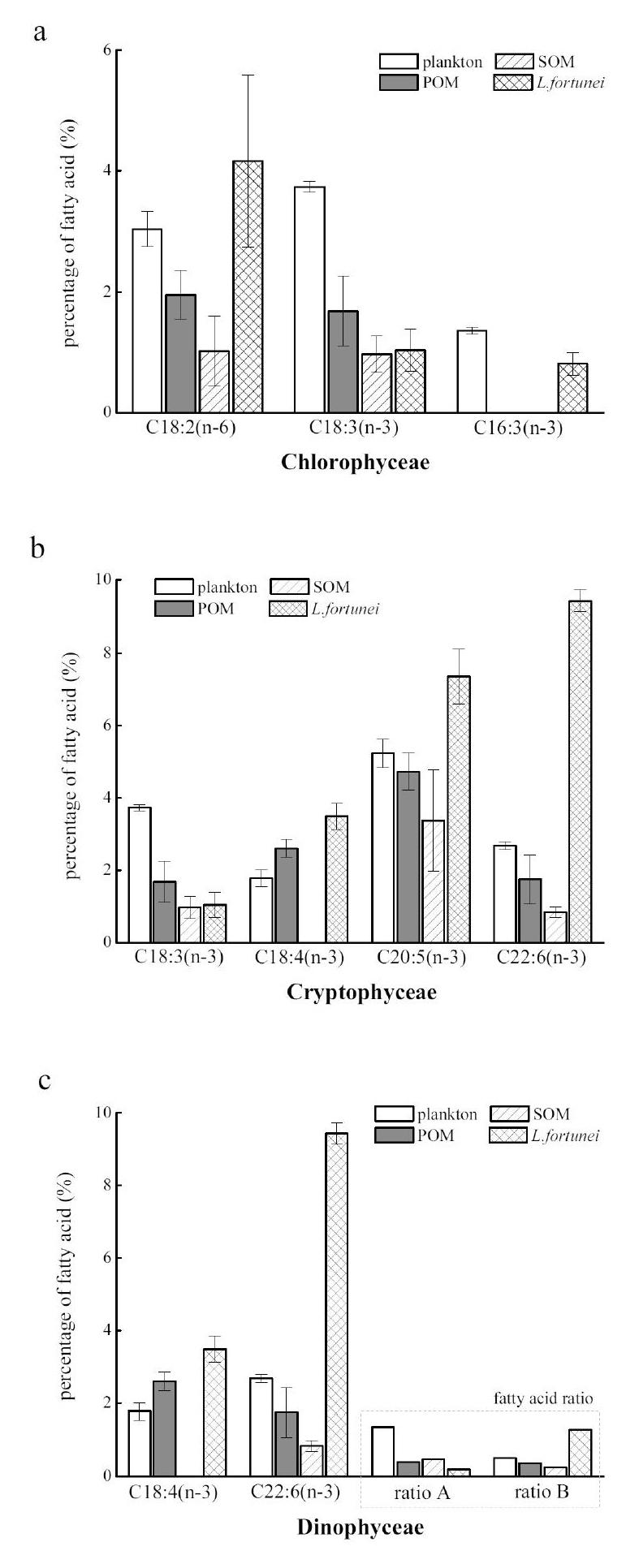
参考表1的生物脂肪酸标志物,以判断沼蛤的摄食倾向。沼蛤样本中含有较高的隐藻脂肪酸标志物(C18:4(n-3)、C20:5(n-3) 和 C22:6(n-3),图2 (b))和甲藻脂肪酸标志物(C18:4(n-3)、 C22:6(n-3)、C16:1 (n-7)/C16:0 = 0.19、DHA/EPA = 1.28,图2(c))。相较之下,plankton、POM和SOM的生物脂肪酸标志物,则主要为绿藻(C18:3(n-3)和C16:4(n-3),图2 (a))、硅藻(C16:2(n-4)、C16:3(n-4)、C16:1(n-7)/C16:0 = 0.19、DHA/EPA = 1.28,图2 (d))、蓝藻(C18:3(n-3),图2 (e))、腐殖质(C18:0)和植物碎屑(C20:0和C22:0,图2 (g))。
2.2 结果讨论
从图2的脂肪酸比例组成可知,plankton、POM和SOM样本的脂肪酸比例组成存在显著差异,其中,plankton样本主要组成物为绿藻、隐藻、硅藻和蓝藻;POM主要组成物为植物碎屑;SOM主要组成物为异养细菌和桡足类。尽管plankton的脂肪酸标志物包含了绿藻、隐藻、硅藻和蓝藻等藻类,但其相对比例较低,而POM中藻类的相对比例也比较低。POM和SOM中含有较高比例的SFAs (C18:0, C20:0 and C22:0)和BrFAs,代表植物碎片、生物假粪、生物排泄物和软体动物分泌物是POM和SOM的主要组成物质[15]。
不同类型的淡水贻贝其脂肪酸标志物组成存在显著差异。与斑马纹贝(D. polymorpha)相比[15],C20:5(n-3)和C22:6( n-3)在沼蛤中占比较高。此外,有研究指出,C22:6(n -3)与C20:4 (n-6)的比值影响水生生物的繁殖和生长[16]。斑马纹贝的C22:6(n -3)与C20:4 (n-6)比值约为1.44[15],而黑龙江河兰蛤(Potamocorbula amurensis)C22:6(n -3)与C20:4 (n-6)的比值则为2(Canuel et a l. 1995)。在本研究中,沼蛤的C22:6(n -3)与C20:4 (n-6)的比值(2.02,见表2)高于斑马纹贝和黑龙江河兰蛤。
有研究指出[17-18],貽贝主要摄食藻类并通过消化腺将藻类异化为主要代谢能源。如图2a所示,C18:2(n-6)主要是经由藻类合成的脂肪酸[19],但其在沼蛤体内的相对比例高于plankton、POM和SOM;同样地,C18:4(n-3)作为隐藻和甲藻的脂肪酸标志物[20],其在沼蛤体内的相对比例也高于plankton、POM和SOM。其原因可能在于,沼蛤摄食绿藻、隐藻和甲藻等,并选择性地吸收或积累C18:2(n -6) and C18:4(n-3)在体内。相比较之下,硅藻(图2 a)在plankton、POM和SOM的相对比例则高于沼蛤。然而,Gladyshev等人[18]指出,大部分贻贝会选择性地摄食并将硅藻异化为甘油酯,以此作为代谢能源,但本研究未从脂肪酸标志物的数据中证实这个观点。
Nichols等人[21]指出,部分贻贝可从异养微生物摄取并积累碳源和氮源。不同种类的微生物其代表脂肪酸标志物存在显著差异[22],例如i17:0和17: 0代表硫酸盐还原微生物,而C18:1(n-7)则代表蓝细菌、硫氧化微生物和好氧微生物。因此,本研究中沼蛤主要是摄食蓝细菌、硫氧化微生物和好氧微生物等。由于plankton、POM和SOM中腐殖质、植物碎屑和桡足类的脂肪酸标志物相对比例高于沼蛤,故此推断沼蛤不偏好摄食腐殖质、植物碎屑和桡足类。由于沼蛤的陆源有机物脂肪酸相对比例较高(见表2),因此Gladyshev等人[18]认为沼蛤是通过摄食异养微生物间接吸收积累陆源有机物,或是利用纤维素酶和半纤维素酶直接同化陆源有机物。
3 结论
本研究探讨了中国南方沼蛤的摄食特征,通过脂肪酸标志物检测,在沼蛤消化腺上检测到绿藻、隐藻、甲藻、异养细菌和陆源有机物等脂肪酸标志物,根据上述物质在沼蛤体内的相对比例,判断沼蛤主要摄食藻类、异养微生物和陆源有机物。
参考文献
[1]王祯瑞.中国动物志:软体动物门.双壳纲.贻贝目[M].北京:科学出版社,1997.28-42,210-213.
[2]Boltovskoy D, Karatayev A, Burlakova L, et al. Significant ecosystem-wide effects of the swiftly spreading invasive freshwater bivalve Limnoperna fortunei[J]. Hydrobiologia, 2009, 636(1): 271-284.
[3]Molina F R, Paggi J C, Devercelli M. Zooplanktophagy in the natural diet and selectivity of the invasive mollusk Limnoperna fortunei[J]. Biological invasions, 2010, 12(6): 1647-1659.
[4]Karatayev A Y, Padilla D K, Minchin D, et al. Changes in global economies and trade: the potential spread of exotic freshwater bivalves[J]. Biological Invasions, 2007, 9(2): 161-180.
[5]Karatayev A Y, Boltovskoy D, Padilla D K, et al. The invasive bivalves Dreissena polymorpha and Limnoperna fortunei: parallels, contrasts, potential spread and invasion impacts[J]. Journal of Shellfish Research, 2007, 26(1): 205-213.
[6]NEWELL R. The role of detritus in the nutrition of two marine deposit feeders, the prosobranch Hydrobia ulvae and the bivalve Macoma balthica[C]//Proceedings of the Zoological Society of London. Blackwell Publishing Ltd, 1965, 144(1): 25-45.
[7]Lopez G R, Levinton J S. Ecology of deposit-feeding animals in marine sediments[J]. Quarterly Review of Biology, 1987: 235-260.
[8]许强.贝藻混养系统中贝类食物来源的定量分析[D].青岛:中国科学院海洋研究所, 2007.
[9]高菲,许强.运用脂肪酸标志法分析刺参食物来源的季节变化[J].水产学报,2010(3):760-767.
[10]姜绪.底播虾夷扇贝的生长、食物来源及呼吸代谢研究[D].南京:南京农业大学,2013.
[11]Parrish C C. Determination of total lipid, lipid classes, and fatty acids in aquatic samples[M]//Lipids in freshwater ecosystems. Springer New York, 1999: 4-20.
[12]Stübing D, Hagen W, Schmidt K. On the use of lipid biomarkers in marine food web analyses: An experimental case study on the Antarctic krill, Euphausia superba[J]. Limnology and oceanography, 2003, 48(4): 1685-1700.
[13]Li X, Fan X, Han L, et al. Fatty acids of some algae from the Bohai Sea[J]. Phytochemistry, 2002, 59(2): 157-161.
[14]Cataldo D, Vinocur A, Inés O, et al. The introduced bivalve Limnoperna fortunei boosts Microcystis growth in Salto Grande reservoir (Argentina): evidence from mesocosm experiments[J]. Hydrobiologia, 2012, 680(1): 25-38.
[15]Makhutova O N, Sushchik N N, Gladyshev M I, et al. 2011. Is the fatty scid composition of freshwater zoobenthic invertebrates controlled by phylogenetic or trophic factors?. Lipids. 46(8):709-721.
[16]Ahlgren G, Vrede T, Goedkoop W. 2009. Fatty Acid Ratios in Freshwater Fish, Zooplankton and Zoobenthos - Are There Specific Optima?. Lipids in Aquatic Ecosystems. 147-178.
[17]Brett M T, Goldman C R. 2006. Daphnia fatty acid composition reflects that of their diet. Limnology and Oceanography. 51(5):2428-2437.
[18]Gladyshev M I, Sushchik N N, Anishchenko O V, et al. 2011. Efficiency of transfer of essential polyunsaturated fatty acids versus organic carbon from producers to consumers in a eutrophic reservoir. Oecologia. 165(2):521-531.
[19]Maria-Jos? C, Boschker H T S, Wim A. 2007. Fatty acid profiles of algae mark the development and composition of harpacticoid copepods. Freshwater Biology. 53(1):77-90.
[20]Gugger M, Lyra C, Suominen I, et al. 2002. Cellular fatty acids as chemotaxonomic markers of the genera Anabaena, Aphanizomenon, Microcystis, Nostoc and Planktothrix (cyanobacteria). International Journal of Systematic and Evolutionary Microbiology. 52(3): 1007-1015.
[21]Nichols S J, Garling D. 2000. Food-web dynamics and trophic-level interactions in a multispecies community of freshwater unionids. Canadian Journal of Zoology. 78(5): 871-882.
[22]Napolitano G E. 1999. Fatty acids as trophic and chemical markers in freshwater ecosystems. Lipids in Freshwater Ecosystems. 21-44.
收稿日期:2019-03-18
作者簡介:杜至力(1986-),男,硕士,工程师,研究方向为水污染控制。

