艾地苯醌对癫痫大鼠反复自发癫痫发作的影响
崔小丽,蒋 锋,山 媛,赵 瑞,王 乐,袁 婕,张 强,胡 军*
(陕西省人民医院神经内一科,西安 710068;*通讯作者,E-mail:monkey8031@163.com)
线粒体在人体细胞中功能重大,为人体重要的能量提供器官,它将外界摄取来的氨基酸、葡萄糖等小分子物质,通过位于其内膜上呼吸链的氧化磷酸化作用来产生能量供应机体需求。癫痫为神经系统病变中的常见病,其一重要特征为发作的不可预知性[1,2],癫痫发作为脑神经元的异常同步激活及异常神经网络的形成。目前有30%的癫痫患者为药物难治性,这需要从其他机制入手,寻找新的抗癫痫药物。癫痫持续状态后能量代谢出现异常改变,线粒体的作用受到破坏。艾地苯醌与经典药物辅酶Q10相似,它的亲脂电子载体和内源性抗氧化功能在所有细胞线粒体膜中均具有[3],作用于线粒体的治疗越来越受到人们重视,艾地苯醌独特的优势—穿越血脑屏障,使其受到研究者的关注,有研究表明,艾地苯醌通过调节大鼠海马的抗氧化状态、DNA损伤、钠-钾ATP的激活对匹罗卡品诱导的癫痫大鼠有神经保护作用[4],本研究观察艾地苯醌能否减少癫痫持续状态大鼠静默期后的反复自发发作及可能机制探讨。
1 材料和方法
1.1 材料
健康清洁级别的SD(Spraque-Dawley)雄性实验大鼠,共42只,购于西安交通大学实验动物管理中心,动物合格证号:SCXK(陕)2007-001,动物体质量200-250 g,给予饮水自由、标准饮食,饲养环境:温度(25±1)℃、湿度60±2%、照明12 h(早8:00-晚8:00)的光暗环境。
1.2 方法
1.2.1 实验动物分组 建模时死亡6只,将36只SD大鼠按随机数字表等分为正常对照组,模型组及艾地苯醌干预组(每组12只)。
1.2.2 模型建立 首先将氯化锂(3 meq/kg,美国Sigma公司)注射于实验大鼠的腹腔,17-20 h后将匹罗卡品(30 mg/kg,美国Sigma公司)注射于大鼠腹腔。为减轻建模时胆碱能作用,溴甲基东莨菪碱(1 mg/kg,美国Sigma公司)注射于大鼠皮下,时间点为使用匹罗卡品前15-20 min,建模后约10 min观察大鼠癫痫发作,发作等级按Racine法[5]评定(0级:无任何行为变化;Ⅰ级:面肌抽动,包含眨眼、节律性咀嚼、胡须抖动等;Ⅱ级:Ⅰ级+湿狗样动作及节奏性点头;Ⅲ级:Ⅱ级+前肢阵挛;Ⅳ级:Ⅲ级+后肢站立;Ⅴ级:Ⅳ级+摔倒)。当癫痫大鼠出现Ⅳ级及以上SE表现并延续70 min,将地西泮注射液(10 mg/kg,西安利君精华药业有限公司)注射于大鼠腹腔使发作停止,将等量生理盐水注射于对照组大鼠腹腔。建模终止30 min后,在每只实验大鼠的皮下给予10 ml生理盐水注射,用于补给建模时的耗损,死亡率明显降低。造模后2 d,给予大鼠常规糊状鼠粮,造模成功率约为80%。
1.2.3 艾地苯醌干预 艾地苯醌(60 mg/kg,山东西亚化学工业有限公司)溶于含5%羧甲基纤维素(carboxymethyl cellulose,CMC,山东西亚化学工业有限公司)的生理盐水中,建模终止后24 h,艾地苯醌干预组开始给予灌胃,每天1次,共28 d,其余两组实验大鼠均给予等量含5%CMC的生理盐水进行灌胃。
1.2.4 录像观察大鼠行为学变化 由于匹罗卡品致痫大鼠模型,癫痫持续状态(status epilepticus,SE)后的反复自发性癫痫发作(spontaneous recurrent seizures,SRS)发生在白天的次数和单次持续时间较晚上明显增多。所以录像均选在白天(早8:00-晚8:00)。自癫痫持续状态后第15天开始录像,连续录像观察分析2周。观察视频由两个实验者分析,分析统计各实验组达到发作标准的持续时间和发作次数。
1.2.5 组织制备 连续给药28 d后,以10%水合氯醛(3.5 ml/kg)将各实验组大鼠进行麻醉,将胸腔打开后迅速暴露膈肌,将心包膜剥离,通过左心室直接到达主动脉,将针头牢固,瞬时将右心耳剪破,迅速灌注含0.37%的硫化钠(Na2S)的生理盐水,首先灌洗150 ml冲干净血液,后使用固定液4%多聚甲醛(4 ℃,pH=7.4)灌洗固定,先较快速度灌注200 ml,再缓慢灌注200 ml。揭开颅骨,取出脑组织,入4%多聚甲醛进行固定4-6 h,后入30%蔗糖溶液,4 ℃放置,持续到组织沉淀,冰冻切片机恒温切取脑片,将海马部分以冠状位连续切片,设置厚度30 μm。
1.2.6 Timm染色及评分标准 配制Timm染色液:50%阿拉伯胶60 ml(阿拉伯胶30 g+去离子水60 ml,搅拌混匀,放置24 h后用双层纱布滤过),10 ml柠檬酸缓冲液(一水柠檬酸25.5 g+二水柠檬酸钠23.5 g+去离子水100 ml),5.6%的对苯二酚30 ml,17%硝酸银0.5 ml,将以上试剂于染色前在黑暗的实验室搅拌均匀。
Timm染色步骤:在暗室将海马切片入Timm染色液里孵育1.5 h;在暗室用自来水冲刷海马切片15 min;将海马切片自暗室移出,再次用自来水冲刷15 min;常规脱水、透明、封片:依次入70%,80%,90%,100%乙醇各5 min,再入二甲苯(Ⅰ)、二甲苯(Ⅱ)各15 min,最后用中性树胶封固。
海马齿状回内分子层的Timm颗粒染色评分标准[6]:0分,无Timm颗粒;1分,Timm颗粒偶见,呈散在的点片状分布;2分,Timm颗粒较多,呈片状分布;3分,Timm颗粒分布接近连续;4分,Timm颗粒呈接近连续或连续分布的浓密状;5分,Timm颗粒呈连续分布层状带。
2 结果
2.1 癫痫大鼠行为学录像分析
癫痫大鼠给予匹罗卡品腹腔注射后约15 min,出现Ⅰ、Ⅱ级发作,继而出现后肢站立等Ⅳ级及以上的发作。
2.2 艾地苯醌干预后减少了大鼠SRS的次数及持续时间
模型组和艾地苯醌干预组发作持续时间分别为(1 143.20±117.61)s和(148.27±35.32)s。模型组和艾地苯醌干预组发作次数分别为71±11.63和11.29±3.41。艾地苯醌干预组发作的次数和持续时间较模型组明显减少,差异有统计学意义(P<0.01)。
2.3 艾地苯醌干预对海马齿状回异常的苔藓纤维芽生(mossy fiber sprouting,MFS)的影响
各实验组Timm染色结果见图1,各实验组海马齿状回Timm染色评分结果见图2。正常对照组Timm染色评分为0.48±0.16,模型组为4.68±0.21,艾地苯醌干预组为1.61±0.31。与正常对照组相比,模型组的MFS明显增加(P<0.05);与模型组相比,艾地苯醌干预组MFS减少明显(P<0.05)。

A.模型组 B.正常对照组 C.艾地苯醌干预组图1 艾地苯醌对各组癫痫大鼠海马苔藓纤维芽生的影响Figure1 Effect of idebenone on hippocampal mossy fiber sprouting in epileptic rats
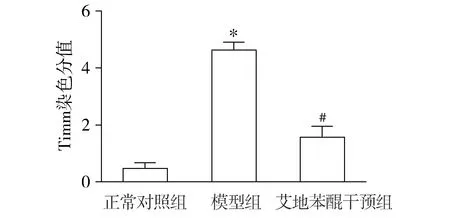
与正常对照组相比,*P<0.05;与模型组相比,#P<0.05图2 各组MFS半定量评分比较Figure 2 Semi-quantitative analysis for MFS in each group
3 讨论
癫痫是神经科最为常见的疾病之一[1],全球大概有6千万病患受该病困扰,有部分患者治疗效果欠佳,目前药物不能阻止该疾病或阻断其发展,仅仅是控制发作症状。长时间的癫痫发作和不能较快完全控制发作,对社会及患者身体和心理均影响极大,这将导致患者生活质量下降,经济负担加重。癫痫的一个临床特征是反复自发发作,据估计高达50%的患者发病源于一开始的创伤,如癫痫持续状态、中风、脑外伤等,高达30%的癫痫患者对目前抗癫痫药物反应欠佳,有实验表明[7],生物要素和环境要素均促成了药物难治性癫痫的产生。尽管有大量的临床前及临床研究,但对癫痫发生的机制仍了解有限。在癫痫发作期神经网络激活,能量需求增加,脑代谢和脑血流量增加[6,8],这和氧化应激有关[9,10]。有研究表明,在健康大鼠脑室内注射葡萄糖的类似物D-2-脱氧葡萄糖,以达到缓慢部分阻断脑内糖酵解,可以诱发癫痫发生[9,11]。现有研究表明,迅速并持续阻断脑内葡萄糖消耗,可导致氧化应激,进而导致癫痫发生[12]。有研究表明[13],三种不同的癫痫模型中,给予丙酮酸可以抗惊厥发作。这表明能量代谢在癫痫发生中意义重大。除了增强有氧代谢外,多余的葡萄糖通过无氧代谢转化为乳酸,在癫痫患者、癫痫动物及体外癫痫模型均可见癫痫发作时有乳酸堆积[14]。单羧酸转用蛋白介导乳酸的摄取和释放,这依赖于转运蛋白的亲和力和浓度梯度[15]。由于跨膜离子梯度的恢复是由能量消耗泵机制介导的,因此癫痫发作对大脑的能量代谢造成了巨大的负担。破坏了能量代谢,改变了神经活动后组织跨膜离子浓度梯度的改变,进而导致了癫痫发作,这在线粒体脑病[16]和颞叶癫痫[17]中均可见。
艾地苯醌为一可溶性的辅酶Q10类似物,较辅酶Q10更易于穿过血脑屏障[18],可以激活线粒体功能、促进ATP的生成、抗氧化及去除自由基。艾地苯醌已被用来治疗神经退行性疾病和病因为线粒体功能障碍的患者[19]。临床前实验报道艾地苯醌有神经保护作用,可对抗β淀粉样蛋白产生的神经毒性,既往研究表明艾地苯醌对癫痫大鼠有神经保护作用[4]。本研究发现,艾地苯醌可以减少癫痫持续状态大鼠后期的反复自发发作。海马齿状回颗粒细胞轴突的异常抽芽,即苔藓纤维芽生(mossy fiber sprouting,MFS),为癫痫中一个重要的病理变化[20],MFS的形成发生在两个阶段:①损伤本身导致了神经元的激活和释放生长因子;②颗粒细胞轴突的生长和延伸[21]。在形态学上,海马齿状回包含三层:自内向外为多形细胞层、颗粒细胞层、分子层,分子层为无细胞层,包含颗粒细胞的顶树突和传递信息的兴奋末梢,这些信息或来自于内嗅皮层,或来自于联合投射区。颗粒细胞层密集分布着小直径的胞体(即颗粒细胞),颗粒细胞轴突延伸到门区,首先投射到兴奋性中间神经元(苔藓细胞)和抑制性中间神经元,然后穿过透明层,到达突触,连接CA3区的锥体神经元。在癫痫的海马齿状回组织,门区丢失了苔藓纤维的投射靶点,异常的苔藓纤维,并延伸到内分子层,与颗粒细胞树突的近端部分形成兴奋性突触连接。
在内侧颞叶癫痫动物模型中,可见到苔藓纤维轴突重组在内侧颞叶癫痫的标本中,使用Timm染色,可以见到大量浓密的富含锌颗粒的苔藓纤维,在海仁酸诱导的癫痫模型及其他癫痫动物模型中也有类似的发现[22,23]。在海仁酸诱导癫痫持续状态前给予哌立福辛预处理,可以抑制神经元的死亡和MFS,减少反复自发发作[24]。在匹罗卡品诱导的SE大鼠模型中,给予静脉输注大鼠骨髓间充质干细胞,有神经保护作用,可以减少认知损害、抑制MFS,其结论是,移植可能通过抑制异常MFS来减少癫痫的发生[25]。我们的研究表明艾地苯醌可以减少苔藓纤维芽生,与上面这些研究一致。减少苔藓纤维芽生可能是减少癫痫发生的机制之一
本研究表明,艾地苯醌可以减少癫痫持续状态后自发性癫痫发作,提示艾地苯醌成为临床上治疗癫痫的新方法。我们还需要进一步探讨其他给药时间窗、给药时间的长短及其他可能的机制研究,以期临床上能够治疗难治性癫痫。

