灯盏花素抗心肌细胞缺氧/复氧损伤的保护作用
刘永浩 周 敏
南昌大学药学院江西省基础药理学重点实验室,江西省南昌市 330006
当心脏缺血后再次恢复血液供应时,会造成大量心肌细胞损伤,即心肌缺血再灌注损伤(Myocardial ischemia-reperfusion injury,MIRI)。MIRI直接影响患者的预后,其机制可能与钙超载、氧自由基、细胞凋亡等[1]多种因素有关。灯盏花素(Bregenin,Bre)属于黄酮类化合物,具有抗炎、抗氧化、抗心肌缺血等多种生物学活性,对脑组织、心肌、肾脏、肺等组织器官缺血再灌注损伤均表现出一定的保护作用[2-5]。目前灯盏花素对心肌MIRI保护作用机制仍不明确。本实验通过利用原代心肌细胞拟建立缺氧/复氧(Anoxia/reoxygention,A/R)模型,以氧化应激损伤和细胞凋亡为切入点,研究 Bre 对心肌细胞A/R损伤的保护作用机制,为下一步深入研究提供实验依据。
1 材料与方法
1.1 药物与试剂 灯盏花素(Bre),中国药品生物制品检定所;DMEM培养基,美国Gibco公司;胎牛血清(FCS),杭州四季青生物制品有限公司;MTS,Ameresco公司;GSH-Px、SOD、MDA、LDH检测试剂盒,南京建成生物工程研究;AnnexinV-FITC试剂盒,BD Biosciences;其他试剂均为分析纯。
1.2 实验用原代心肌细胞 参照刘丹等[6]方法:选取1~3d新生大鼠的心脏处理后,剪成1mm2大小的碎泥状,加8ml 0.1%的胰酶,37℃水浴8min,静置数分钟弃上清,重复多次,至碎块消失,收集混悬液上清,用MEM培养基(含15%FBS)终止消化,离心(4℃,1 000rpm 8min),收集细胞沉淀用MEM培养基(含15%FBS)混匀后,200目滤网过滤,常规培养2h,除去成纤维细胞,将上清用MEM培养基(含15%FBS)轻柔混匀,调整细胞数为5×105cells/ml,按2.5×106接种到60mm培养板中,放入细胞培养箱3d后,按照实验要求进行分组实验。
1.3 方法
1.3.1 心肌缺氧/复氧(A/R)损伤模型的建立:将原代心肌细胞弃培养液,用缺氧液(5%CO2-95%N2混合气体饱和)轻洗1次,再加入缺氧液并置于A/R装置(持续充满5%CO2-95%N2混合气体),37℃孵育3h后,弃去缺氧液,用复氧液(5%CO2-95%O2混合气体饱和)清洗1次,再加入复氧液并置于A/R装置,37℃孵育2h(缺氧液、复氧液参照Koyama[7]、Xu[8]等方法配制)。
1.3.2 实验分组:(1)Control组(对照组):原代心肌细胞常规培养箱(5%CO2-95%空气)37℃孵育3h后,再换成复氧液置于常规培养箱孵育2h;(2)A/R组(缺氧/复氧组):按1.3.1方法建立A/R损伤模型;(3)Bre+ A/R组(灯盏花素组):取原代心肌细胞分别加入浓度为20、40、80μM的灯盏花素,常规培养箱孵育24h,然后进行A/R损伤处理。
1.3.3 MTS比色法检测细胞存活率:将已接种原代心肌细胞(覆盖率70%~80%)的96孔培养板吸出培养基,每孔100μl培养基加入MTS溶液20μl(检测步骤根据试剂盒说明书操作),在常规培养箱孵育1~4h,490nm读取吸光度值,记录结果。
1.3.4 生化系列指标检测:将各实验组心肌细胞收集后,超声破碎并离心,取上清,按照试剂盒说明书进行相关操作,将配制的溶液用分光光度计在特定波长(MDA 532nm,SOD 550nm,GSH-Px,LDH 412 nm)读取吸光度值,记录结果。
1.3.5 Annexin V-FICT/PI双染法检测心肌细胞凋亡:将前期处理收集的细胞用400μl的1×Binding Buffer悬浮细胞,浓度大约为1×106cells/ml,添加5μl Annexin V-FITC,混匀后避光,置2~8℃冰箱孵育15min;加入10μl PI,轻混后再避光,置2~8℃冰箱孵育5min,在1h内用流式细胞仪检测。
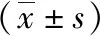
2 结果
2.1 灯盏花素对原代心肌细胞A/R损伤后细胞存活率、LDH 活性和细胞凋亡的影响 如表1所示,与对照组相比,A/R组细胞存活率明显降低 (P<0.01),培养液中LDH 活性明显升高(P<0.01),A/R损伤模型构建成功;与A/R 组相比,Bre处理组(20、40、80μM)细胞存活率呈剂量依赖性升高(P<0.01),培养液中LDH 活性逐渐降低(P<0.01)。与对照组相比,A/R 组细胞凋亡数明显增加(P<0.01),心肌细胞经A/R损伤后凋亡明显;与A/R 组相比,Bre处理组(20、40、80μM)凋亡细胞数明显降低(P<0.01)。

表1原代心肌细胞A/R损伤后细胞存活率、LDH活性和细胞凋亡的影响
注:与对照组比较,*P<0.01;与A/R 组比较,▲P<0.01。
2.2 灯盏花素对原代心肌细胞A/R损伤后SOD、GSH-Px和MDA含量的影响 如表2所示,与对照组相比,A/R 组细胞内抗氧化物酶 SOD 及 GSH-Px 活性均明显降低(P<0.01),MDA的含量明显增加(P<0.01),A/R损伤模型建立成功;与A/R 组相比,Bre处理组(20、40、80μM)的抗氧化酶SOD 及 GSH-Px 的活性明显增加(P<0.01),MDA的含量明显减少(P<0.01)。

表2原代心肌细胞A/R损伤后SOD和GSH-Px活性以及MDA含量的影响
注:与对照组比较,*P<0.01;与 A/R组比较,▲P<0.01。
3 讨论
近年来,经皮腔内冠脉血管成形术、体外循环心脏外科手术、动脉搭桥术、溶栓疗法等手段的建立和推广应用,心脏在短时间内缺血再次恢复血氧供应过程中造成的心肌缺血再灌注损伤(MIRI),已成为影响心脏血管外科手术疗效的一大难题。Fliss等[9]研究发现MIRI中心肌细胞死亡本质上有可能是细胞凋亡。MIRI中细胞凋亡的发生与再灌注恢复氧供应过程中的氧化应激损伤[10-11]密切相关。研究发现,活性氧的过度产生所致的氧化应激是造成细胞凋亡的关键[12]。机体内抗氧化物酶可清除氧自由基,其中超氧化物歧化酶(SOD) 可清除超氧阴离子,而谷胱甘肽过氧化物酶(GSH-Px)可清除脂质过氧化物(MDA),MDA可反应氧自由基的含量。因此提高抗氧化物酶的活性、减少脂质过氧化物的产生可以抑制细胞凋亡,提高细胞存活率,达到心肌细胞保护作用。
灯盏花素,具有抗心律失常作用,能抑制MIRI引起的细胞凋亡[13]。有研究表明,灯盏花素可通过清除氧自由基,减少氧化应激损伤发挥肝脏、脑组织MIRI保护作用[14-15]。在本实验中,利用原代心肌细胞作为研究对象,A/R损伤前用灯盏花素进行预处理后,结果发现:与A/R组相比,细胞内SOD和GSH-Px活性升高,脂质过氧化产物MDA含量明显减少,细胞存活率得到提高,细胞凋亡减少。实验结果表明,心肌细胞经过灯盏花素预处理能有效地提高其A/R损伤后的抗氧化物酶活性,减少脂质过氧化物的产生,抑制细胞凋亡,从而达到对心肌细胞的保护作用。
综上所述,灯盏花素心肌保护作用机制可能与其减少氧化应激损伤,抑制细胞凋亡密切相关。本实验为下一步深入探讨灯盏花素心肌的保护作用机制提供了新的实验数据。

