通过miR-202与炎性细胞因子调控关系影响慢性牙周炎病理发展
潘 祁 王培娜
牙周炎是一种慢性、非特异性感染性疾病,是口腔两大类疾病之一,在世界范围内均有较高患病率[1]。慢性牙周炎是最常见的一类牙周炎,约占牙周炎患者的95%,由长期存在的慢性牙龈炎向深部牙周组织扩展而引起,主要临床特征有牙龈炎症、牙周袋形成、临床附着丧失、牙槽骨吸收,严重者可出现牙齿松动、移位,最后导致牙齿缺失。由于附着于牙面的牙菌斑中的微生物所引起牙周支持组织破坏的慢性感染性疾病,细菌积聚于牙齿表面或直接侵入并同时产生大量毒性产物直接破坏牙周组织,或者引发了宿主免疫反应和炎症反应,间接性地导致了牙周组织的损伤。
细胞因子是一种小的水溶性肽或糖蛋白,基本功能是分子之间的信号传导。它们由粒细胞、内皮细胞以及其他的一些细胞通过自分泌或旁分泌方式产生。细胞因子的一些亚型是促炎介质如白细胞介素(interleukin,IL)、肿瘤坏死因子(tumor necrosis factor,TNF)等,称为炎性细胞因子,对控制炎症反应起着十分重要作用。目前认为牙周炎导致牙周组织的破坏主要通过两种途径:牙周致病菌及其产物的直接破坏和过度的宿主反应所造成的间接破坏[2~5]。目前认为后一种途径是造成牙周组织破坏的主要原因。在宿主反应的过程中,一系列炎症介质包括IL、TNF 等起到了重要作用,它们不仅可以直接导致牙周组织的破坏,还可以进一步影响宿主的炎症和免疫反应进程,加重牙周组织的破坏。IL 是非常重要的细胞因子家族,它们在免疫细胞的成熟、活化、增殖和免疫调节等一系列过程中均发挥重要作用,参与免疫应答和介导炎症反应,与牙周炎有密切的关系。
微小RNA(miRNA)对免疫系统以及炎症性疾病的调控具有复杂性和网络性,目前的研究表明miRNA 对不同的细胞、在不同的时空、靶向不同基因的调控作用表现出明显差异,其机制并未完全澄清[6,7]。因此,深入了解 miRNA 的生物学活性、了解其调控的靶基因以及其精细的调控途径,为我们研究miRNA 的免疫调控作用提供借鉴和经验,也有助于探讨miR-202 在慢性牙周炎以及其他所有相关疾病防治中的意义。
资料和方法
1.研究对象:选取自2015年5月至 2018年3月于我院口腔科就诊的85 例慢性牙周炎患者为慢性牙周炎组,选取本院同期体检的健康志愿者51 例为对照组,两组患者基线资料比较均无统计学差异(P>0.05),见表1。本研究经院伦理委员会批准,患者知情同意。
2.唾液标本采集:唾液标本采集按照Rhodus 改良的方法[8]收集非刺激性全唾液,采集时间为上午9:00~11:00,采集前禁食、水 1 小时,并用蒸馏水漱口1 次。避免抽烟、剧烈运动及情绪剧烈波动等。采样时受试者采取正位、端坐,采集时嘱患者向4℃无菌Eppendorf 管内吐出,间歇性持续5 分钟。将所得样本立即于4℃,3000rpm,15min 离心取上层液体,将收集好的唾液上清冻存于-80℃冰箱,待检测。

表1 两组一般资料比较
3.常规牙周检查:由两名事先经过统一培训的医师使用Florida 探针对所有研究对象全口牙周检查(第三磨牙除外)。主要内容包括6 个位点(近中颊侧、正中颊侧、远中颊侧、近中舌侧、正中舌侧、远中舌侧)的牙周探诊深度(periodontal depth,PD)、附着丧失(attachment loss,AL)、菌斑指数(plaque index,PLI)、牙龈指数(gingival index,GI)。根据探诊深度、牙龈指数、附着丧失、X 线片显示牙槽骨吸收程度来衡量牙周炎的程度。
4.ELISA 检测:从-80℃冰箱中取出待测标本,在室温中放置10 分钟,使其充分融化,取出ELISA试剂盒(TNF-α、IL-1β、IL-6、IL-8 及 IL-10),使其平衡至室温。按照试剂说明书设置标准品检测孔:每块ELISA 反应板设置8 孔标准孔,在第一孔中加入100μl 样品稀释液,然后加入100μl 标准品,充分混匀后,用移液器吸取1001μl 混合液,并加入第二孔中,然后加入100μl 样品稀释液混匀,依次倍比稀释8 次,使之体积均为100μl。液器吸取100μl 待检样品加入ELISA 反应板,轻轻混匀,然后加盖封板膜放入37℃恒温箱中抗原抗体反应2小时。孵育结束后用洗板机洗板,洗5 次,每次45秒,然后在吸水纸上轻拍,去除ELISA 孔中水分。用移液器吸取100μl 第一抗体工作液加入ELISA 反应孔中,轻轻混匀,放于37℃恒温箱中孵育1 小时。孵育结束后用洗板机洗板,洗5 次,每次45 秒,然后在吸水纸上轻拍,去除ELISA 孔中水分。板结束后在ELISA 反应孔加入100μl 辣根过氧化物酶标记的二抗,轻轻混匀,37℃温育1 小时。孵育结束后用洗板机洗板,洗5 次,每次45 秒,然后在吸水纸上轻拍,去除ELISA 孔中水分。板结束后每孔加入底物A 液和 B 液各 50μl,轻轻混匀,37℃温育 30 分钟。取出ELISA 反应板,加入50μl 终止液,轻轻混匀。将ELISA 反应板放置酶标仪中,在450nm 波长处测定各孔的OD 值。将ELISA 反应板放置酶标仪中,在450nm 波长处测定各孔的OD 值。检测样本中相应细胞因子(TNF-α、IL-1β、IL-6、IL-8 及 IL-10)的含量。
5.Western Blot 检测:首先从转染48h 后的细胞中提取总蛋白,采用BCA 蛋白浓度测定试剂盒测定蛋白浓度,然后在SDS-聚丙烯酰胺凝胶小孔内添加50μg 经过变性处理后的蛋白质,再进行浓缩胶层80V 恒压一段时间,当样品在分离胶层压成一条线时电压调至120V,继续电泳,电泳后于冰上0.25mA 转膜2h,丽春红染色10min 观察转移效果,满意后,洗膜缓冲液(tris buffered saline tween,TBST)缓冲液洗膜后在5%脱脂奶粉与摇床上孵育2h;加入一抗(1:500 兔抗人 p21 多抗,1∶5000 兔抗人GAPDH 单抗)置于4℃封闭过夜;洗膜后加入羊抗兔 IgG/HRP 二抗(1:2000),室温孵育 1h,采用增强化学发光法(ECL)显影得到蛋白印记条带,用Tanon 软件分析条带灰度值,相对定量结果以实验条带灰度值/β-actin 条带光密度值表示,内参照为β-actin。
6.qRT-PCR 检测:应用 ABI StepOne Plus 实时定量PCR 仪,严格按照TaKaRa 公司SYBR Premix Ex TaqPCR 反应试剂盒的操作说明进行检测。
7.统计学分析:实验数据应用SPSS 22.0 软件分析,计量资料用表示,两样本均数比较采用独立样本t检验,多个样本均数间比较采用单因素方差分析,两两比较采用LSD 法。计数资料用率表示,组间比较采用χ2检验。P<0.05 为差异有统计学意义。
结 果
1.在慢性牙周炎组与正常对照组唾液中miR-202 的表达水平:我们通过检测miR-202 在慢性牙周炎组与对照组唾液上清中的表达水平,结果显示,慢性牙周炎组唾液上清中miR-202 表达水平为2.46±0.62,正常对照组唾液上清中miR-202 表达水平为0.73±0.24,经独立样本t检验,慢性牙周炎组唾液上清中miR-202 表达显著高于正常对照组,差异有统计学意义(P<0.01),见图1。
2.miR-202 在慢性牙周炎各组唾液上清中表达水平:在1 实验结果研究基础上,我们继续通过检测miR-202 在正常对照组、轻度牙周炎组、中度牙周炎组、重度牙周炎组唾液上清中的表达情况。结果显示,轻度牙周炎组唾液上清中miR-202 的表达水平为1.76±0.43;中度牙周炎组为2.69±0.61;重度牙周炎组为4.08±0.69,经单因素方差分析组间差异有统计学意义(F=16.332,P<0.01),见图2。结果提示各组唾液上清中miR-202 表达存在差异,均显著高于正常对照组,并呈现正相关性,且其差异有统计学意义(q=6.321,8.447,9.368;P=0.001,0.000,0.000)。
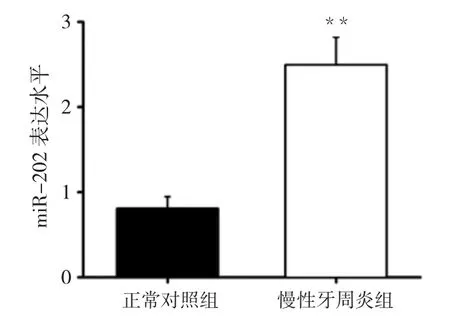
图1 在慢性牙周炎组与正常对照组唾液中miR-202 的表达水平(±s)
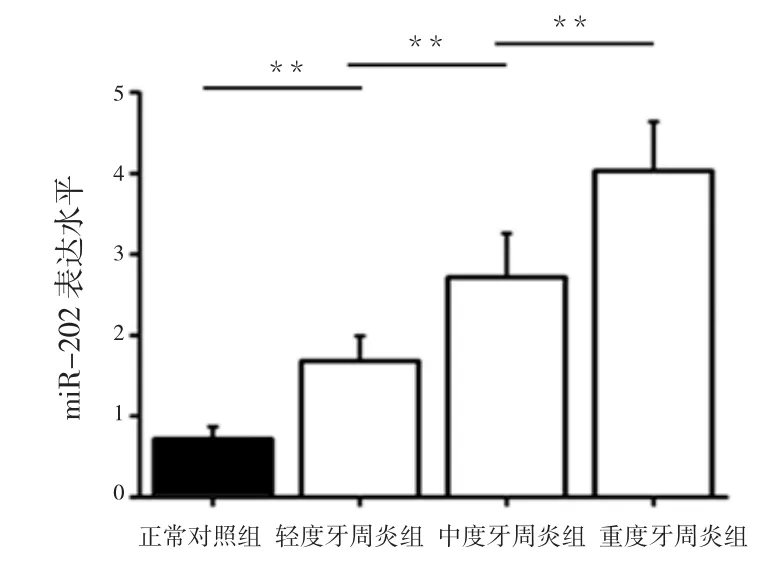
图2 miR-202 在慢性牙周炎各组唾液上清中表达水平(±s)
3.比较慢性牙周炎各组间唾液上清中miR-202表达相关分析:我们为更加确定miR-202 表达水平在各组间唾液上清的相关性,将各组间再经多重比较(表2)。miR-202 在轻度牙周炎、中度牙周炎、重度牙周炎唾液上清中之间表达水平显著呈现上调趋势(P<0.01)。

表2 各组间唾液上清中miR-202 表达相关分析
4.miR-202 与慢性牙周炎临床指标的相关性:我们通过观察检测慢性牙周炎患者的临床指标:牙龈指数(GI)、牙周探诊深度(PD)、菌斑指数(PLI)、附着丧失(AL)。结果显示,miR-202 在唾液上清中的表达水平与各牙周临床指标均呈显著正相关(表3)。
5.慢性牙周炎患者唾液上清中 TNF-α、IL-1β、IL-6、IL-8 及 IL-10 水平变化:我们通过ELISA 方法检测慢性牙周炎患者组和正常对照组人群唾液上清中 TNF-α、IL-1β、IL-6、IL-8 及 IL-10的表达水平,结果显示,慢性牙周炎患者唾液上清中TNF-α、IL-1β、IL-6、IL-8 均显著高于正常对照组,而IL-10 呈现低表达(表4),差异有统计学意义(P<0.05)。
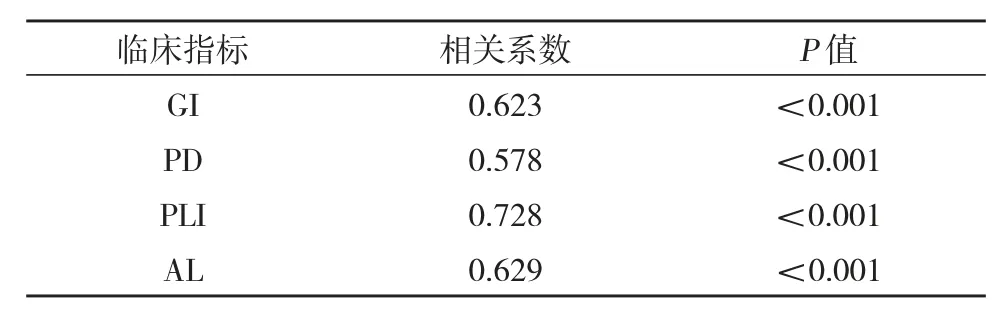
表3 miR-202 与慢性牙周炎临床指标的相关性
表4 两组唾液中 TNF-α、IL-1β、IL-6、IL-8 及 IL-10 水平比较(±s)
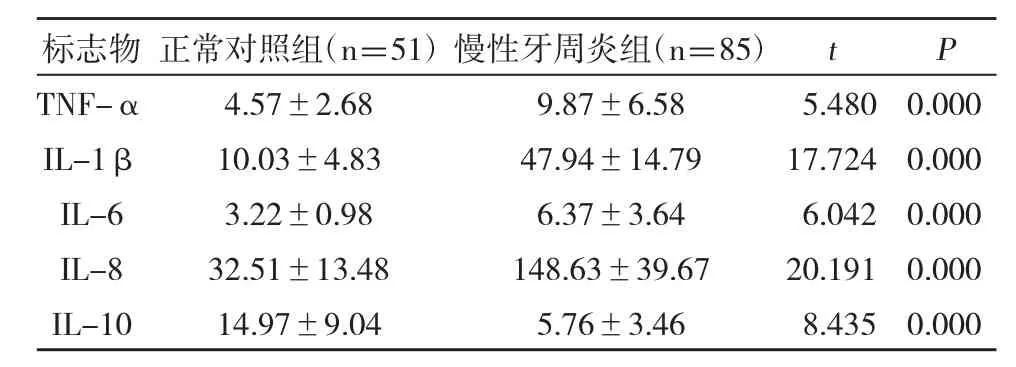
表4 两组唾液中 TNF-α、IL-1β、IL-6、IL-8 及 IL-10 水平比较(±s)
标志物TNF-α IL-1β IL-6 IL-8 IL-10正常对照组(n=51)4.57±2.68 10.03±4.83 3.22±0.98 32.51±13.48 14.97±9.04慢性牙周炎组(n=85)9.87±6.58 47.94±14.79 6.37±3.64 148.63±39.67 5.76±3.46 t P 5.480 17.724 6.042 20.191 8.435 0.000 0.000 0.000 0.000 0.000
6.TNF-α、IL-1β、IL-6、IL-8 及 IL-10 在慢性牙周炎患者中蛋白水平变化:通过Western Blot 方法检测慢性牙周炎患者组和正常对照组人群中TNF-α、IL-1β、IL-6、IL-8 及 IL-10 的蛋白表达水平,同ELISA 检测结果相同,慢性牙周炎患者中TNF-α、IL-1β、IL-6、IL-8 均显著高于正常对照组,而IL-10 呈现低表达(图3)。
7.miR-202 与 TNF-α、IL-1β、IL-6、IL-8 及IL-10 表达水平的相关性:我们将慢性牙周炎患者治疗前唾液上清中miR-202 的表达水平分别与唾液上清中 TNF-α、IL-1β、IL-6、IL-8 及 IL-10 的表达水平进行相关分析,结果显示,TNF-α 的相关系数 r 值为 0.527,(P<0.001),与 miR-202 呈正相关;IL-1β 的相关系数 r 值为 0.483,(P<0.001),同样和miR-202 呈正相关;IL-6 及IL-8 的相关系数r值分别为 0.424(P<0.001)、0.391(P<0.01) 也和miR-202 呈正相关,而IL-10 的相关系数r 值为-0.322(P<0.01)则与 miR-202 呈负相关性,见表5。

图3 TNF-α、IL-1β、IL-6、IL-8 及 IL-10在慢性牙周炎患者中蛋白水平变化
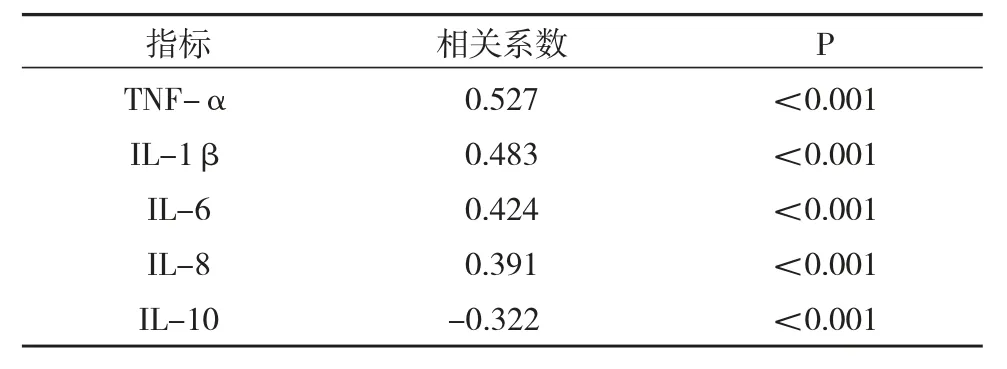
表5 miR-202 与 TNF-α、IL-1β、IL-6、IL-8 及IL-10 表达水平的相关性
讨 论
慢性牙周炎是最常见的一类牙周炎,约占牙周炎患者的95%,由长期存在的慢性牙龈炎向深部牙周组织扩展而引起,主要临床特征有牙龈炎症、牙周袋形成、临床附着丧失、牙槽骨吸收,严重者可出现牙齿松动、移位,最后导致牙齿缺失。由于附着于牙面的牙菌斑中的微生物所引起牙周支持组织破坏的慢性感染性疾病,细菌积聚于牙齿表面或直接侵入并同时产生大量毒性产物直接破坏牙周组织,或者引发了宿主免疫反应和炎症反应,间接性地导致了牙周组织的损伤[9]。
miRNAs 是由21~24 核苷酸所组成并且存在于真核细胞当中的一个非编码小分子RNA,通过抑制蛋白的转录和翻译来调节细胞行为。miRNAs 不仅在细胞凋亡、迁移、增殖、分化等生理过程中发挥作用,也与炎症疾病的发生发展有密切关系。研究表明,miRNAs 具有炎症负反馈调节机制[10]。大量研究发现,miRNA 在调节和维持免疫功能方面发挥着极其重要的作用,miRNA 的异常表达紧密联系慢性炎症发病过程[11]。包括miR-202 在内的,与慢性炎症相关的miRNA 分子中在慢性炎症发生和发展过程中发挥着重要作用。miRNA-202 在免疫细胞的分化和功能调控、炎症因子的信号转导、自身免疫性疾病、病毒感染及肿瘤发生、发展过程中的作用。近年来,miRNA 在牙周炎的发生、发展及预后中的作用成为研究的热点之一,已经得到证实的有miR-146、miR-155 等微小RAN 对慢性牙周炎发生发展机制的调节作用。本研究通过检测miR-202 在慢性牙周炎组与对照组唾液上清中的表达水平,发现慢性牙周炎组唾液上清中miR-202 表达水平明显高于正常人群,这提示miR-202 也可能参与慢性牙周炎的发生发展。
通过检测正常人群及不同严重程度牙周炎患者唾液中miR-202 的表达情况,发现各组慢性牙周炎患者的唾液上清中miR-202 表达存在差异,均显著高于正常对照组,并呈现正相关性,且其差异有统计学意义。为更加确定miR-202 表达水平在各组间唾液上清的相关性,将各组间再经多重比较,结果显示,miR-202 在轻度牙周炎、中度牙周炎、重度牙周炎唾液上清中之间表达水平显著呈现上调趋势。我们通过观察检测慢性牙周炎患者的临床指标:牙龈指数(GI)、牙周探诊深度(PD)、菌斑指数(PLI)、附着丧失(AL)。结果显示,miR-202 在唾液上清中的表达水平与各牙周临床指标均呈显著正相关。上述所有结果说明miR-202 与慢性牙周炎的严重程度密切相关,病情越严重,miR-202 表达水平越高。
TNF 是具有多种生物学活性的糖蛋白,也是唯一具有细胞毒作用的细胞因子,是炎症反应的启动物质,是最早发挥作用的前炎性因子。牙周炎过程中,TNF-α 的主要作用有刺激黏附分子、趋化因子的表达和炎性介质的产生,启动炎症反应,增加破骨细胞的形成和活性,增加基质金属蛋白酶的产生,导致结缔组织的破坏,刺激基质细胞凋亡从而限制了牙周组织的修复。有学者发现随着牙周炎症的发展,龈沟液中TNF-α 及其受体的总量均明显升高[12]。
IL-1 是一种单核细胞因子,主要由单核细胞和巨噬细胞产生,其分为IL-1α 和IL-1β 两种。IL-1β 是多效性细胞因子,具有广泛的细胞免疫调节作用,包括促进胸腺细胞、T 细胞活化、增殖和分化;促进破骨细胞形成和骨吸收;激活核转录因子NF-kappa B 的信号通路,进而NF-kappa B 上调IL-1β 基因的表达,加重牙周病变。这些炎症介质能刺激破骨细胞和胶原酶,导致骨和牙周结缔组织破坏,牙周组织修复能力丧失等。有研究表明,在炎症部位的龈沟液中IL-1β 的水平与慢性牙周炎的临床指标密切相关[13]。
IL-6 是一种多功能细胞因子,在机体的免疫应答及炎症反应中均起着重要作用。可诱导成骨细胞产生破骨细胞分化因子及基质金属蛋白酶,二者都促进牙槽骨的吸收,能轻度抑制成骨细胞碱性磷酸酶的活性和胶原的合成,从而抑制牙槽骨吸收后新骨的形成,可以抑制牙周膜的修复,抑制成纤维细胞等牙周膜细胞生长,并降低成纤维细胞附着,导致牙周膜修复能力减弱、牙周附着丧失,形成深牙周袋。IL-6 可参与牙周炎的炎症反应,促进炎症细胞的聚集、活化并促进炎症介质的释放。研究发现,在病变牙周组织及牙周炎患牙的龈沟液中IL-6 水平明显高于正常,且与牙周组织破坏的严重程度有关[14]。
IL-8 炎症因子则是由巨噬细胞和内皮细胞所分泌,作为一种白细胞多肽调节因子,IL-8 主要是通过金属蛋白质水解及细胞外基质蛋白降低,从而破坏正常牙周组织加重炎症感染。IL-8 可以趋化中性粒细胞,促进粒细胞吞噬效应,是机体重要的炎症调节因子。近年来,有研究证实,IL-8 与牙周炎的发生发展密切相关。有人发现IL-8 在牙周炎的病变牙龈组织中其表达明显升高,在经过牙周基础治疗后,多数患者的IL-8 水平有不同程度降低,这表明去除局部细菌、菌斑及其刺激因素后,龈沟液内IL-8 的水平趋于正常[15]。
IL-10 是机体内重要的免疫抑制因子,可抑制机体的免疫应答水平,降低炎症反应,促进组织修复及愈合,其主要由Th2 细胞、单核巨噬细胞和活化的B 细胞产生。IL-10 可抑制单核细胞依赖性Th1细胞增殖,抑制 IL-2、TNF-α、IL-6、GM-CSF 等一系列细胞因子的合成及其活性。近年来研究发现,IL-10 可作为一种抗炎因子,抑制炎症因子的合成和刺激保护性抗体的产生,参与牙周炎的产生和发展[16]。Goutoudi 等发现慢性牙周炎患者体内IL-10水平较健康人群表达降低,经过牙周基础治疗后,其局部炎症反应减轻,IL-10 的表达水平增加,说明IL-10 可能通过对促炎因子的抑制作用,参与了牙周的修复过程。
miR-202 能通过依赖细胞核因子-KB(nuclear hcmr-KB,NF-KB)的方式表达上调,实现对TLR信号通路的负反馈调节,从而防止炎症反应过激。为了探讨miR-202 与炎性细胞因子之间的相关性。本研究通过ELISA 方法检测慢性牙周炎患者组和正常对照组人群唾液上清中TNF-α、IL-1β、IL-6、IL-8 及IL-10 的表达水平,结果显示,慢性牙周炎患者唾液上清中 TNF-α、IL-1β、IL-6、IL-8 均显著高于正常对照组,而IL-10 呈现低表达。Western Blot 方法检测结果同ELISA 一致。相关分析结果显示,TNF-α、IL-1β、IL-6、IL-8 的表达与 miR-202呈正相关,IL-10 的表达水平与miR-202 呈负相关。分析可能是由于TLR4、TLR2、TLR5 通路的激活后,miR-202 高表达能够通过NF-KB 信号通路诱导TNF-α、IL-1β、IL-6 及 IL-8 等细胞因子的表达水平增加。上述结果提示:慢性牙周炎患者唾液上清中 miR-202 表达升高与唾液上清中 TNF-α、IL-1β、IL-6 及 IL-8 高表达有关。
综上所述,慢性牙周炎患者唾液上清中miR-202 表达水平显著升高,同时 miR-202 和TNF-α、IL-1β、IL-6、IL-8 等炎性细胞因子呈正相关性,而miR-202 与IL-10 呈负相关性,提示我们miR-202 在慢性牙周炎发病过程中发挥着重要作用,有作为临床上监测慢性牙周炎活动进展的生物标记的潜力。

