广西北部湾放线菌的分离筛选及活性产物的鉴定
王 聪,王 坤,姜明国,谭学才,雷福厚,杜方凯,邱子言,孙坤来
1广西民族大学化学化工学院,广西林产化学与工程重点实验室,广西高校食品安全与药物分析化学重点实验室;2广西高校微生物与植物资源利用重点实验室,广西民族大学海洋与生物技术学院,南宁 530006;3浙江海洋大学食品与医药学院,浙江省海洋生物医用制品工程技术研究中心,舟山 316022
海洋环境的特殊性造就了海洋放线菌种类及其次生代谢产物的多样性,可能产生很多具有新颖骨架结构、显著生物活性的次生代谢产物,受到研究者的广泛关注[1,2]。在对海洋药物筛选的过程中,极有可能得到抗菌生物活性物质。北部湾(广西海域)是一个半封闭大海湾,具有丰富的海洋资源[3,4]。关于北部湾(广西海域)在海洋沉积物微生物活性天然产物的研究鲜有报道。因此,从海洋放线菌中寻找抑菌剂具有很大的潜力,有望成为抗菌剂药物研究的突破口。本实验用普通稀释法,从采自广西北部湾的黄槿、腐木和桐花树等3种植物样品和6个泥样中分离获得73株放线菌。对这些菌株进行发酵培养,通过TLC显色、HPLC指纹图谱分析和抗菌活性测试,筛选到一株链霉菌Streptomycessp.MDCW-126,鉴定其中一产物为星形孢菌素[5,6],星形孢菌素是一种具有抗菌作用的吲哚咔唑类化合物[6],经对化合物1进行了抑菌活性的测试,结果显示化合物1对香蕉枯萎病菌的MIC值为10.0 μg/mL,对金黄色葡萄球菌的MIC值为125.0 μg/mL。
1 材料与方法
1.1 材料
1.1.1 样品来源
黄槿、腐木、桐花树和6个海泥样品。样品均于2017年11月采自广西北部湾。
1.1.2 分离培养基(培养基中添加的放线菌酮均为0.005%)
1.1.2.1 高氏I号培养基:可溶性淀粉2%,KNO30.1%,K2HPO43H2O 0.05%,MgSO4.7H2O 0.05%,FeSO40.001%, 琼脂2%,氯化钠 3.3%。
1.1.2.2 淀粉干酪素:干酪素0.2%,淀粉 1%,KH2PO43H2O 0.05%,MgSO4.7H2O 0.05%, 琼脂2%,氯化钠 3.3%。
1.1.2.3 葡萄糖-天冬酰胺:天冬酰胺0.05%,葡萄糖 1%,K2HPO43H2O 0.05%,琼脂2%,氯化钠 3.3%。
1.1.2.4 改良Emorson培养基:酵母浸粉0.1%,葡萄糖0.1%,蛋白胨0.4%,NaCl 0.4%,琼脂2%,氯化钠 3.3%。
1.1.2.5 精氨酸甘油:精氨酸0.1%,K2HPO43H2O 0.05%,甘油0.75%,麦芽浸粉1%,淀粉1%,MgSO4.7H2O 0.05%,丙酸钠0.4%,琼脂2%,氯化钠 3.3%。
1.1.2.6 M2:甘油 0.75%,K2HPO43H2O 0.1%,精氨酸 0.1%,MgSO4.7H2O 0.05%,琼脂2%,氯化钠 3.3%。
1.1.2.7 M3:FeSO4.7H2O 0.001%,酪蛋白腺0.2%,天冬氨酸0.01%,丙酸钠0.4%,甘油0.5%,K2HPO43H2O 0.05%,MgSO4.7H2O 0.01%,琼脂2%,氯化钠 3.3%。
1.1.2.8 1/10 ATCC 172:酵母浸汁0.5%,葡萄糖 1%,淀粉 2%,CaCO31.5%,水解干酪素 0.5%,琼脂2%,氯化钠 3.3%。
1.1.2.9 酵母浸膏培养基:0.2% 酵母浸膏,琼脂2%,氯化钠 3.3%。
1.1.2.10 牛肉浸膏培养基:0.2% 牛肉浸膏,琼脂2%,氯化钠 3.3%。
1.1.2.11 海藻糖培养基:0.2%海藻糖,琼脂2%,氯化钠 3.3%。
1.1.2.12 蛋白胨培养基:0.2% 蛋白胨,琼脂2%,氯化钠 3.3%。
1.1.3 发酵培养基
放线菌2号:可溶性淀粉2%,牛肉浸膏0.3%,蛋白胨1%,酵母浸膏1%,葡萄糖2%,MgSO4·7H2O 0.05%,KH2PO40.05%,CaCO30.2%,氯化钠3.3%。
放线菌A1培养基:可溶性淀粉1%,蛋白胨0.2%,酵母浸膏0.4%,KBr 0.01%,Fe2(SO4)3·4H2O 0.004%,CaCO30.1%,氯化钠3.3 %。
高氏I号培养基:可溶性淀粉0.2%,KNO30.1%,MgSO4·7H2O 0.05%,K2HPO4·3H2O 0.05%, FeSO40.001%,氯化钠 3.3%。
1.1.4 实验菌株
抑菌活性实验采用2株致病菌:金黄色葡萄球菌Staphylococcusaureus和香蕉枯萎病菌Fusariumoxysporumf.sp.cubense[3,4]。
1.1.5 试剂和仪器
HCB-1300V洁净工作台(青岛海尔特种电器有限公司)、高压灭菌锅YXQ-LS-75SII型(上海博迅实业有限公司医疗设备厂)、生化培养箱LRH-500A型(广东泰宏君科学仪器股份有限公司)、Agilent 1260 HPLC (美国 Agilent 公司)、质谱仪Mariner API-TOF型(美国应用生物系统公司)、旋光仪POLAX-L型(美国ATAGO公司)、核磁共振仪Agilent-DD2 500型(Agilent公司)。
1.2 样品预处理与菌株分离
植物样品:取植物样品1 g,在75%的酒精中浸泡5 min,采用无菌水冲洗后加入5 mL无菌水研磨,采用无菌水逐级梯度稀释到10-2。泥土样品:将海泥从冰箱拿出解冻,称量海泥样品1 g,加入5 mL无菌水逐级梯度稀释到10-2。
采用普通稀释法对样品进行放线菌的分离,各取0.3 mL均匀涂布于分离培养基的平板上,每个稀释度涂布于3个平板,置于28 ℃培养箱中倒置培养。对分离出的菌株进行纯化,将纯化好的菌株接入斜面培养基,存放于4 ℃冰箱,并保藏于含20%甘油的液体培养基中。每个样品保藏4管,冻存管标记上菌种保藏号及保藏日期,于-80 ℃冰箱保藏。
1.3 活性菌株的筛选
1.3.1 菌株发酵
将菌株接种于灭菌后的放线菌2号、放线菌A1和高氏I号培养基三种培养基中,培养温度为28 ℃、转速为180 rpm摇床培养。
1.3.2 菌株鉴定
对具有抗菌活性的MDCW-126菌株进行鉴定,菌株基因组DNA的提取、扩增以及测序纯化由上海生工生物工程股份有限公司完成。采用通用引物7F(5'-CAGAGTTTGATCCTGGCT-3′)、1540R(5′-AGGAGGTGATCCAGCCGC A-3′),按照常规方法进行PCR扩增。PCR反应条件为94 ℃预变性4 min,94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,共30个循环,最后72 ℃延伸10 min。获得的16S rDNA序列提交EzTaxon-e数据库,用软件CMEGA 6构建系统发育树[4]。
1.3.3 浸膏提取
发酵液采用等体积的乙酸乙酯萃取3次,对乙酸乙酯萃取液进行减压浓缩得到粗浸膏。
1.3.4 抑菌活性测试
抑菌活性测试采用药敏纸片法和二倍稀释法[3,7,8]。将金黄色葡萄球菌均匀涂布到LB培养基(酵母浸膏0.5%,胰蛋白胨1%,氯化钠0.5%,琼脂2%)上,香蕉枯萎病菌涂布到YPD培养基(葡萄糖2%,蛋白胨2%,酵母浸膏1%,琼脂2%)上。吸取10 μL样品加入无菌滤纸片上,纸片干燥后贴于培养基上,倒置于28 ℃培养箱中,培养时间为12~24 h,观察有无抑菌圈产生。致病菌真菌和细菌的阳性药分别是酮康唑和环丙沙星。对有分离得到的化合物采用二倍稀释法测定其最小抑制浓度(MIC)。
2 结果和讨论
2.1 菌株的分离
采用普通稀释法从黄槿、腐木,桐花树以及6个海泥样品中分离了73株放线菌,形态见图1。
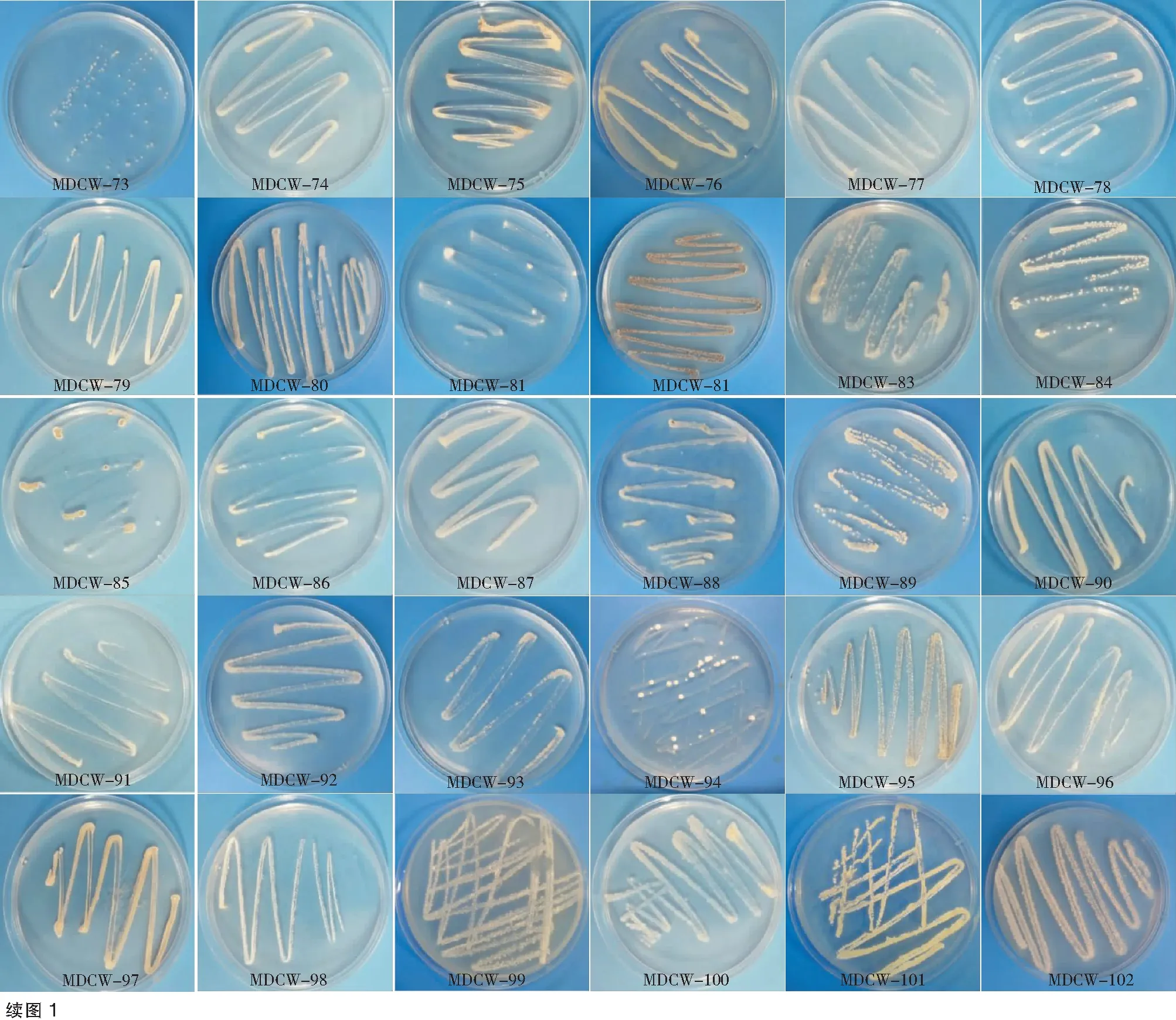

图1 分离获得的菌株菌落培养照片Fig.1 Photograph of colony culture of the isolated strains
2.1.1 泥样1(7株):MDCW-80 、MDCW-95、MDCW-101、MDCW-114、MDCW-124、MDCW-140、MDCW-143。
2.1.2 泥样2(2株):MDCW-125、MDCW-142。
2.1.3 泥样3(4株):MDCW-118、MDCW-139、MDCW-141、MDCW-145。
2.1.4 泥样4 (28株):MDCW-73~75,MDCW-77、MDCW-81、MDCW-83、MDCW-87~93,MDCW-97、MDCW-102、MDCW-104~108、MDCW-110、MDCW-115~117、MDCW-132~134、MDCW-138。
2.1.5 泥样5(4株):MDCW-96、MDCW-99、MDCW-113、MDCW-135。
2.1.6 泥样6(1株):MDCW-112。
2.1.7 黄槿(3株):MDCW-109、MDCW-129、MDCW-130。
2.1.8 腐木9(23株):MDCW-76、MDCW-78~79、MDCW-82、MDCW-84~86、MDCW-94、MDCW-98、MDCW-100、MDCW-103、MDCW-111、MDCW-119~123、MDCW-126~127、MDCW-131、MDCW-136~137、MDCW-144。
2.1.9 桐花树(1株):MDCW-128。
结果表明:①在普通稀释法中,未稀释的样品溶液分离得到的放线菌最多(图2);②从M2和M3培养基中分得的放线菌较多(图3),葡萄糖-天冬酰胺和精氨酸甘油培养基没有放线菌长出;③从不同样品来看,泥样4和腐木分离的放线菌数量较多(图4)。
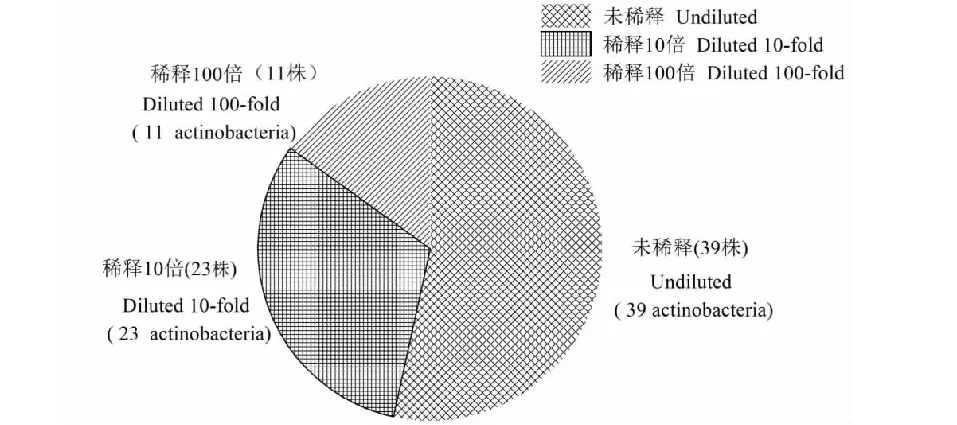
图2 三种浓度分离的放线菌的数量Fig.2 Number of actinobacteria isolated by three concentrations
2.2 活性筛选
采用3种培养基分别对每株放线菌进行发酵培养,测定其乙酸乙酯提取物(浓度为100 μg/mL)的抗菌活性。活性强弱根据抑菌圈的大小来确定:如果抑菌圈的直径<10 mm,表明有活性;抑菌圈的直径在10~15 mm之间,定为中等活性;抑菌圈直径>15 mm表明为强活性。结果表明:菌株MDCW-126在A1培养基中的次级代谢产物具有抗金黄色葡萄球菌和香蕉枯萎病活性,菌株MDCW-78、MDCW-96、MDCW-107和MDCW-125在A1培养基中的次级代谢产物具有中等程度抗金香蕉枯萎病活性(图5)。菌株MDCW-103在A1培养基中的次级代谢产物和菌株MDCW-114在高氏I培养基中的次级代谢产物具有抗金黄色葡萄球菌。对菌株MDCW-126进行初步研究。

图3 不同培养基分离放线菌的数量Fig.3 Number of actinobacteria isolated on the different media
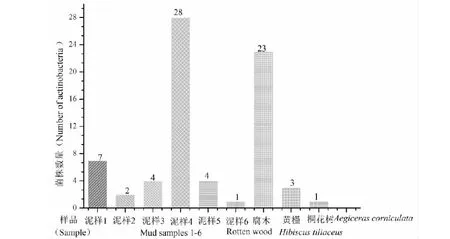
图4 不同样品分离的放线菌的数量Fig.4 Number of actinobacteria isolated from different samples
2.3 菌株鉴定
菌株MDCW-126的16S rDNA基因的PCR扩增序列的长度为1469 bp,与NCBI数据库中的菌株Streptomycesp.(Streptomycessanyensis219820)的16S rDNA基因序列同源性为96%,亲缘关系最近、在系统发育树上处于同一分支。故将菌株MDCW-126(GenBank登录号MK615749)初步鉴定为链霉菌Streptomycesp.(图6)[4,9]。进一步观察其形态特征,菌落干燥,与培养基结合致密,与放线菌的链霉菌属的形态特征相一致[7]。故鉴定菌株MDCW-126为链霉菌Streptomycesp.。

图5 抗香蕉枯萎病的抑菌活性图片Fig.5 Picture of anti-fusarium oxysporum f.sp.cubense activities
2.4 活性化合物的分离鉴定
对Streptomycessp.MDCW-126的放线菌A1培养基中的活性成分进行分离,通过凝胶柱色谱分离,分离得到一个化合物,通过MS、NMR和比旋光度鉴定该化合物为星形孢菌素(图7)[5,6]。
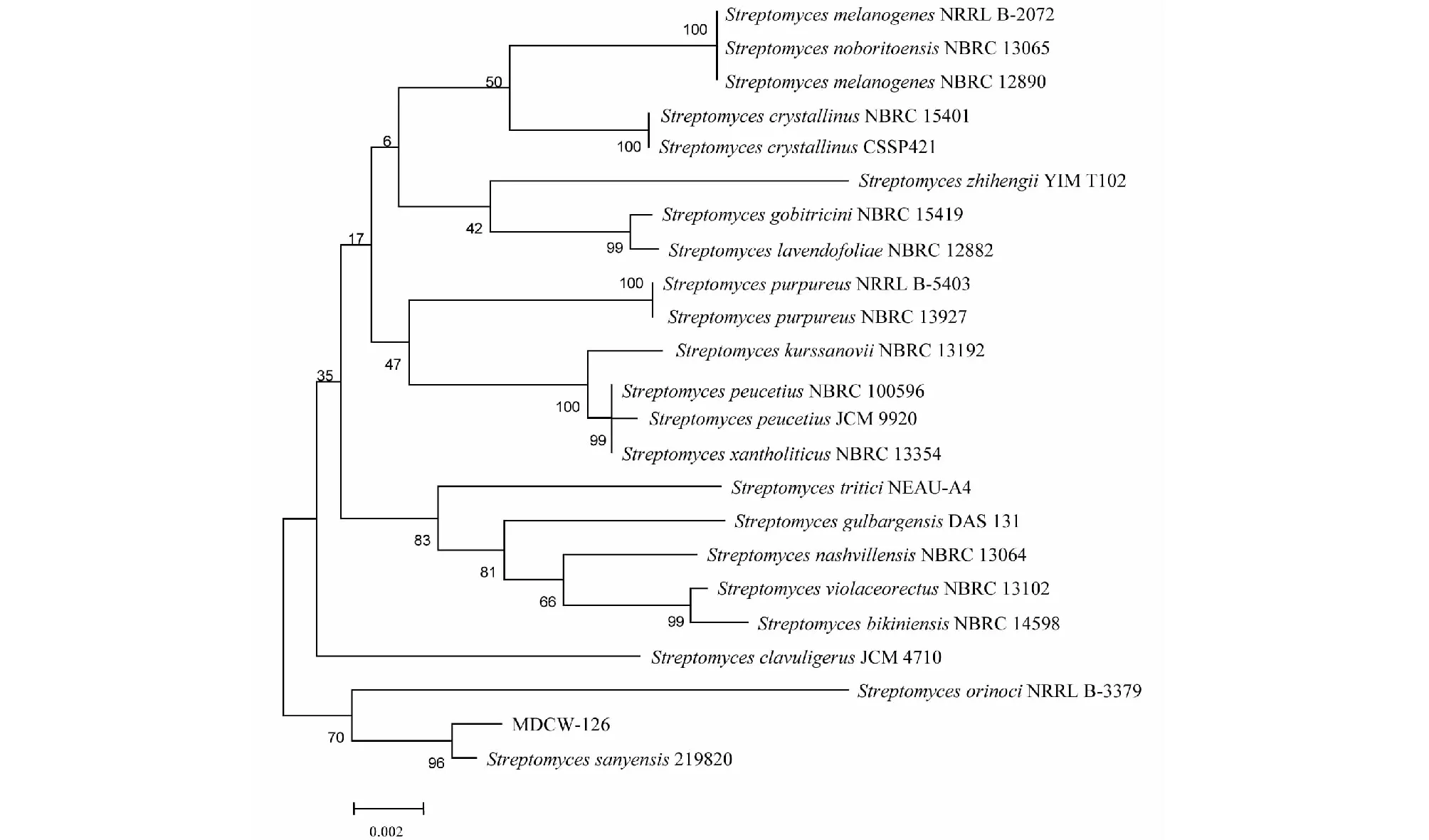
图6 菌株MDCW-126鉴定Fig.6 Identification of strain MDCW-126

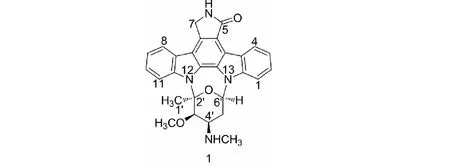
图7 星形孢菌素的结构式Fig.7 The chemical structure of staurosporin
3 结论
本研究采用普通稀释法从广西北部湾来源的海泥和植物样品中分离并获得73株放线菌。筛选出5株对香蕉枯萎病菌具有抑制作用的活性菌株、3株对金黄色葡萄球菌具有抑制作用的活性菌株,并从其中一株放线菌Streptomycessp.MDCW-126的次级代谢产物中分离鉴定了活性化合物——星形孢菌素。
目前,关于广西北部湾海洋来源放线菌的研究主要是菌株的分离和鉴定,并未对菌株的次生代谢产物进行研究[10,11]。本研究从广西北部湾来源一株海洋放线菌Streptomycessp.MDW-06中分离到1个新的聚酮类化合物[4],广西北部湾蕴含着有丰富的海洋生物资源[12],是产生新颖结构、奇特活性药物先导化合物的重要来源。因此,从广西北部湾海洋来源的放线菌中寻找新的生物活性化合物具有非常大的潜力,值得我们进行深入研究。

