盐酸坦洛新和COX-2抑制剂治疗前列腺增生症患者下尿路症状的临床研究
董晓飞 白 强
1.浙江省安吉县人民医院泌尿外科(浙江安吉 313300)2.上海交通大学医学院附属新华医院泌尿外科
前列腺增生 (benign prostatic hyperplasia,BPH)是引起老年男性下尿路症状(lower urinary tract symptoms,LUTS)的主要原因之一。而LUTS的严重程度与生活质量密切相关。药物在前列腺增生症治疗中起到重要作用。目前治疗BPH的基本药物是α受体阻滞剂和5α还原酶抑制剂。其中α受体阻滞剂起效较快,针对的是缓解LUTS症状。
有证据显示慢性炎症对前列腺增发生发展起着关键性作用[1,2]。大多数前列腺增生切除的标本中含有较多的炎性细胞浸润,且LUTS症状的严重程度与炎症的程度具有相关性[3]。一氧化氮合成酶(nitric-oxidesynthase,NOS)和环氧化酶 -2(Cyclooxygenase,COX-2)介导的氧化应激效应会导致前列腺组织中大量炎性细胞浸润,这些细胞和前列腺基质、上皮细胞产生大量炎性因子,参与BPH的病理生理过程[4,5]。由于作为催化花生四烯酸转化为前列腺素的关键酶之一的COX-2参与了BPH的炎症反应。因此,抑制COX-2的活性。有可能会改善BPH患者的症状,提高生活质量。因此,本研究采用联合α受体阻滞剂和COX-2抑制剂来短期治疗有症状的BPH,并与单用α受体阻滞剂作比较,以观察COX-2抑制剂能否增强α受体阻滞剂的效果。
资料与方法
一、一般资料
选取2010年3月至2017年9月新华院泌尿外科门诊伴有LUTS症状的老年男性BPH患者110例为本研究对象。入选标准为:年龄为50至80岁之间;腹部B超显示前列腺体积增大;最大尿流率(maximum urinary flow rate,Qmax)≥5 mL/s 以及≤15 mL/s;IPSS(InternationalProstate Symptom Score)评分≥12,OABSS(overactive bladder symptom Score)>8;TPSA 值<4 ng/mL。排除标准为:有过下尿路手术史;下尿路肿瘤、尿道狭窄、巨大膀胱憩室、膀胱结石、尿潴留发生频率超过两次以及神经源性膀胱病史者;患有影响下尿路功能的神经系统疾患者;残余尿>200mL;有外科干预指征或有严重心、肝、肺、肾功能不全者;在治疗前4周内用过其他治疗前列腺增生药物。
二、治疗方法
入选患者均为自愿参加研究,签署了知情同意书。随机分成治疗组和对照组,每组55例,治疗组服用盐酸坦洛新(生产厂家:浙江海力生制药有限公司,国药准字号:H20020623,规格:0.2mg×14 粒,0.2mg/d)和塞来昔布(生产厂家:辉瑞制药有限公司,国药准字号:J20120063,规格:0.2g×6 粒,200mg/d),对照组只服用盐酸坦洛新(0.2mg/d),共八周时间。治疗前,每四周检测血常规、尿常规、和肝肾功能。每两周门诊随访,并记录不良反应。
三、统计学方法
计量数据用以均数±标准差表示,运用SPSS 10.0统计软件,采用t检验、卡方检验对计量数据和计数资料分别进行统计分析,P<0.05为差异视为统计学意义。
结 果
入选患者平均年龄 (63±5.9)岁,治疗组年龄(65.4±6.2)岁,对照组年龄(61.5±7.6)岁。 两组年龄差异无统计学意义(P>0.05)。治疗组病程为(23.0±22.6)月,对照组病程为(24.8±15.9)月,两组病程差异无统计学意义(P>0.05)。 治疗前两组 IPSS 评分、Qmax、前列腺体积、残余尿、血清前列腺特异性抗原(prostat ic specific antigen,PSA)和OABSS差异也无统计学意义(P>0.05,见表1),具有可比性。
由表1可见,治疗后,两组的前列腺体积、PSA值与治疗前比较,差异无统计学意义(P>0.05),但残余尿、总IPSS评分以及储尿期IPSS评分、排尿期IPSS评分,以及OABSS评分都显著下降,差异均具有统计学意义(P<0.05)。两组的Qmax也都明显增高,差异具有统计学意义(P<0.05)。
治疗后两组相比较显示:治疗组残余尿量从(63.3±51.5)mL 降低为(25.0±26.2)mL,差异具统计学意义(P<0.05)。 此外,总 IPSS、储尿期 IPSS、排尿期IPSS和OABSS评分改善程度也都优于单一药物的对照组(P<0.05),说明联合用药对减轻症状效果更为明显。
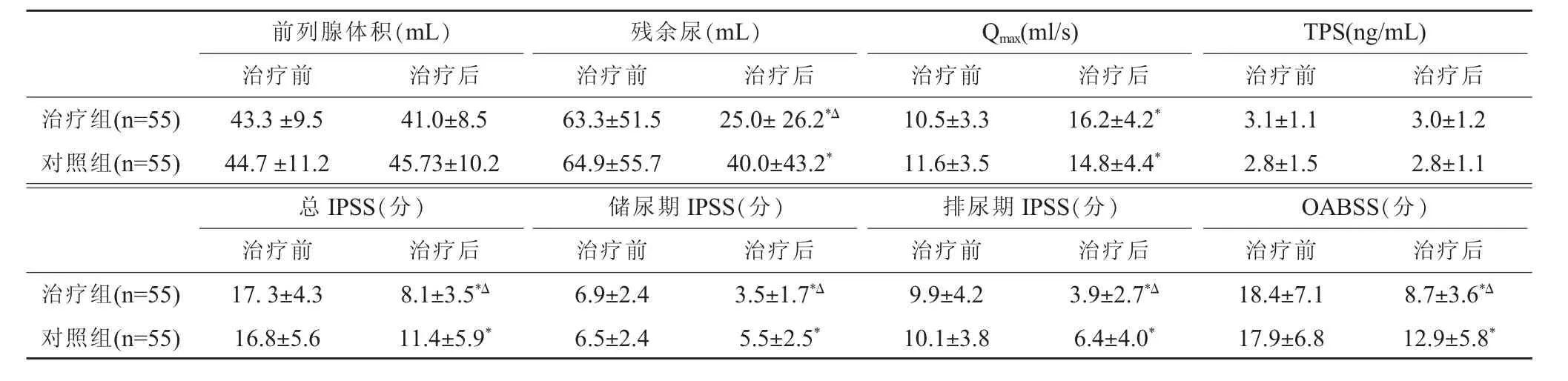
表1 两组治疗前后各项指标比较(x±s)
讨 论
BPH引起LUTS的原因较为复杂,不仅与前列腺对尿道、膀胱出口的机械性和动力性压迫有关,局部的慢性炎症也可能参与LUTS的发生、发展。有研究显示血液中C反应蛋白浓度与BPH患者的储尿期症状存在明显的线性关系[6],尽管C反应蛋白是由肝脏合成并释放到血液中,但血液中C反应蛋白可视为反映其他器官慢性炎症的非特异性指标。Tyagi等也发现膀胱过度活动症(Overactive bladder,OAB)患者尿液中多项炎性因子水平,与无OAB的对照者相比,明显增高[7]。此外,组织学研究中也发现增生的前列腺组织中普遍存在较多炎性细胞浸润[8]。上述的研究提示慢性炎症可能是LUTS,尤其是储尿期症状的病理生理原因之一。
环氧化酶(Cyclooxygenase,COX)是催化花生四烯酸转化为前列腺素的关键酶之一,目前发现有COX-1和COX-2同工酶。COX-2在正常组织细胞内的活性极低,当细胞受到炎症刺激时,其在炎症细胞中的表达水平可升高至正常水平的10~80倍,引起局部的前列腺素含量明显增加,从而导致炎症反应和组织损伤。增生的前列腺中含有较多的平滑肌细胞,前列腺素对平滑肌细胞的生长和功能维持起着中重要作用。因此有专家提出抑制COX-2表达或功能可能有助于治疗BPH[9]。另外,膀胱出口梗阻的动物模型中,膀胱组织内前列腺素和COX-2的表达均明显增加;当使用COX-2选择性抑制剂时,出口梗阻造成的膀胱形态改变能部分逆转[10,11]。因此,使用COX-2选择性抑制剂来抑制前列腺和膀胱组织的炎症反应,有可能减轻LUTS,改善BPH患者的生活质量。
目前治疗BPH的基本药物是α受体阻滞剂和5α还原酶抑制剂。这其中α受体阻滞剂起效较快,针对是缓解LUTS症状。而5α还原酶抑制剂需要服用较长一个时期才能达到减少前列腺体积效果。因此,本课题研究了联合使用α受体阻滞剂和COX-2选择性抑制剂的短期效果,并与α受体阻滞剂单独使用作比较。我们发现,经过8周的治疗后,与治疗前相比,两组患者Qmax、总的IPSS评分、排尿期和储尿期的IPSS评分、OABSS评分都有明显改善,提示患者的排尿通畅、LUST症状得到缓解。但对照组的残余尿量与治疗前无显著差别,联合用药组的残余尿量治疗后明显减少。两组之间相比,Qmax无明显差别。 但残余尿量、IPSS评分、排尿期和储尿期的IPSS评分、OABSS评分,联合用药组改善的更为显著,治疗效果优于单独使用α抑制剂的患者。这说明前列腺和或膀胱的炎症可能参与了BPH患者的LUTS发生和发展。当COX-2抑制剂的加入,抑制炎症后,LUTS得到更为显著控制,膀胱功能也得恢复。LUTS对生活质量影响较大,虽然本研究没有评估生活质量的变化,但有理想相信,治疗组的患者生活质量也应该明显提高。
最新的一项研究发现虽然5α还原酶抑制剂度他雄胺能刺激前列腺上皮细胞会过度表达雌激素受体(estrogen receptor,ERβ)来诱导前列腺上皮细胞凋亡,从而减少增生的前列腺体积,但COX-2的活化会减少ERβ表达,从而减弱5α还原酶的作用[12]。当抑制COX-2活性或减少其表达时,度他雄胺的凋亡作用得到增强。度他雄胺能同时抑制5α还原酶1和2。这项研究还发现另一种5α还原酶非那雄胺则无上述效应。非那雄胺只能抑制5α还原酶2。这可能部分解释了另一项研究结论[13]。Di Silverio等人使用COX-2抑制剂罗非昔布和非那雄胺治疗前列腺增生,短期效果明显,但长期效果与单用非那雄胺无显著差异。因此,长期服用度他雄胺和COX-2抑制剂是否具有更好的治疗效果,值得研究。
本实验亦发现BPH患者服用COX-2抑制剂方便,且安全,并未发生出血、严重的胃肠道反应等严重并发症导致停药事件。但本研究实验对象数量较少,时间不长,相对降低了实验安全可信性。总之,α受体阻滞剂和COX-2抑制剂联合治疗BPH安全、有效,对PSA影响小,值得临床应用。

