阿姆斯特丹散囊菌对六堡茶品质成分的影响研究
欧惠算,张灵枝,王维生
(1.广东省粤东高级技工学校,广东汕头 515041;2.华南农业大学园艺学院,广东广州 510642)
六堡茶属于黑茶类,产自广西省梧州市苍梧县,已有1500多年的历史。康熙时期的《苍梧县志》中就有关于六堡茶品质的记载:“味醇隔宿而不变,茶色香味俱佳”[1]。六堡茶具有独特的槟榔香味和浓郁的地域特色[2]。近年来,黑茶中的微生物成为海内外学者研究的热点,金花菌是黑茶特别是茯砖茶中的优势菌,其使茯砖茶口感香醇,散发出淡淡的菌花香,深受人们喜爱[3]。陈椽[4]提出,金花菌能够分泌淀粉酶催化茶叶中的淀粉转化为单糖,还可分泌氧化酶催化多酚类化合物氧化,从而消除茶叶枝梗的粗老气味,使茶汤呈红棕色,滋味也更加醇厚并带有甜味。研究表明,“金花菌”也是六堡茶的优势菌[5]。欧惠算等[6]在六堡茶中分离纯化得到的金花菌通过分子生物学方法对菌株进行DNA序列分析,并通过构建系统发育进化树分析得出该金花菌为阿姆斯特丹散囊菌。研究表明阿姆斯特丹散囊菌类能产生降低血脂的活性物质[7]。
研究利用从六堡茶中分离得到的阿姆斯特丹散囊菌接种至六堡茶毛茶茶汤中,进行单一菌株液态发酵,对发酵过程中茶多酚类、黄酮类、氨基酸、可溶性糖、茶色素、咖啡碱以及儿茶素类含量的变化规律进行分析,为探究后发酵过程中阿姆斯特丹散囊菌对六堡茶品质成分的影响,从而为改善六堡茶的加工关键技术、提高六堡茶品质提供理论基础。
1 材料与方法
1.1 茶样与菌种
茶样为2015年秋用苍梧县群体种鲜叶原料加工而成的毛茶。供试菌株是从中茶茶厂六堡茶分离纯化得到的阿姆斯特丹散囊菌,实验室保存。
1.2 实验试剂
试剂:三氟乙酸、甲醇、儿茶素标准品(EGCG、ECG、EC、EGC、C、CG、GC、GCG)、GA 标 准 品 、咖啡因标准品:上海源叶生物科技有限公司。茚三酮、氯化亚锡、硫酸亚铁、酒石酸钾钠、Na2HPO4·12H2O、KH2PO4、AlCl3·6H2O、 乙酸乙酯、 正丁醇、95%乙醇、谷氨酸、蒽酮、浓硫酸等(均为分析纯)。
1.3 实验方法
1.3.1 菌种的活化
将保存于4℃的阿姆斯特丹散囊菌菌株取出,于28℃活化培养24 h,用接种环挑取菌丝在20%蔗糖查氏培养基(CZA20S)上培养120 h。
1.3.2 茶汤培养基的制备
将六堡毛茶样品粉碎(过40目筛),称取8.33 g茶叶(精确至0.01)于锥形瓶中,在沸水浴中浸提30 min,每5 min搅拌一次、浸提后用脱脂棉过滤于500 mL容量瓶,用蒸馏水定容。然后分装到100 mL锥形瓶中,每瓶装100 mL,121℃高压灭菌20 min后取出,冷却备用。
1.3.3 孢子悬液的制备
于超净工作台上,用接种铲取2 cm2长势茂盛的阿姆斯特丹散囊菌分成7小块加入茶汤培养基中,于30℃,120 r/min的恒温摇床培养144 h。
1.3.4 液态发酵培养
用移液枪分别吸取1 mL阿姆斯特丹散囊菌孢子悬浮液接种到毛茶茶汤培养基中,于30℃、120 r/min的恒温摇床里发酵192 h,每48 h取一次样[8]。设未加菌株的茶汤为对照CK。
1.3.5 指标测定
茶多酚总量:GB/T 8313—2008茶叶中茶多酚含量的检测方法测定;黄酮类化合物总量:三氯化铝比色法测定;氨基酸:GB/T 8314—2013方法测定;茶色素:分光光度计法测定[9];水溶性糖:蒽比色法;儿茶素组分、没食子酸(GA)、咖啡碱:高效液相色谱法,色谱分析条件为色谱柱:Agilent TCC18(4.6×250 mm);检测波长:278 nm;柱温箱:35℃;流动相:A相0.05%三氟乙酸;B相色谱级甲醇;C 相超纯水;流速:0.8 mL/min;进样量:10 μL,采用外标法测定含量。
1.4 数据统计与作图
使用Excel 2003软件对数据进行计算整理,用GraphPad Prism软件作图,应用其中的Twoway ANOVA方法进行显著性分析,数值呈现使用平均数±SEM 值[10]。
2 结果与分析
在阿姆斯特丹散囊菌菌株液态发酵192 h后,与空白对照相比,发酵茶汤颜色较为清澈。研究表明淀粉、果胶、蛋白质、咖啡碱、茶多酚类等是形成茶汤沉淀的主要物质,其中酯型儿茶素比非酯型儿茶素更容易参与茶乳酪的形成[11]。随着发酵的进行,阿姆斯特丹散囊菌代谢的酶使茶汤中大量的酯型儿茶素降解为非酯型儿茶素,淀粉水解为小分子单糖,果胶裂解,蛋白质水解为氨基酸,从而使沉淀物被分解,茶汤浑浊度降低,亮度提高。
2.1 茶汤发酵过程中茶多酚含量的变化动态
由图1可以看出,阿姆斯特丹散囊菌液态发酵过程中,茶多酚含量不断降低,其中在发酵192 h时,阿姆斯特丹散囊菌发酵液的茶多酚含量与空白对照相比,具有极显著差异(p<0.0001)。茶多酚含量降低了47.14%。其原因除了分泌的氧化酶把茶多酚氧化外,还可能是菌丝生长繁殖过程中消耗吸收了部分茶多酚[12-13]。
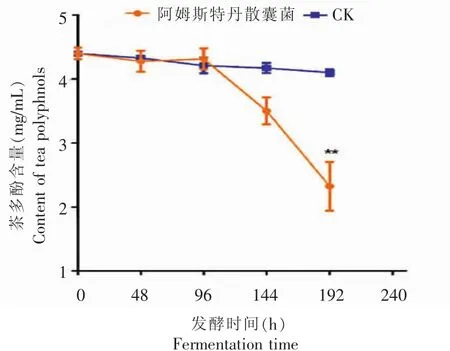
图1发酵过程中茶多酚含量的变化Fig.1 Changes of tea polyphenol content during fermentation
2.2 茶汤发酵过程中黄酮类含量的变化动态
从图2可以看出,在液态发酵过程中,阿姆斯特丹散囊菌发酵液的黄酮含量不断降低,在发酵进行了144 h后,发酵液的黄酮类含量与空白对照相比具有显著性差异(p<0.05);在发酵进行到192 h的时候,发酵液的黄酮含量与空白对照相比,具有极显著性差异(p<0.0001),与发酵前相比,黄酮类含量降低了41.23%。其原因可能是阿姆斯特丹散囊菌在生长繁殖过程中分泌胞外酶以及有机酸促使黄酮类物质发生酶促氧化和酸水解等一系列生化反应[8],同时黄酮类氧化产物还可与咖啡碱形成络合物,反应过程中形成的新物质有助于茶叶醇和滋味的形成[14]。而对照组的黄酮类总量的增加可能是由于大部分黄酮类物质是以糖苷形式存在,在高温灭菌环境下迅速水解,含量较低。茶汤发酵过程中酯型儿茶素分解为简单型儿茶素,有机酸含量增加,淀粉部分水解为葡萄糖,促使黄酮类与糖重新结合,含量增加。
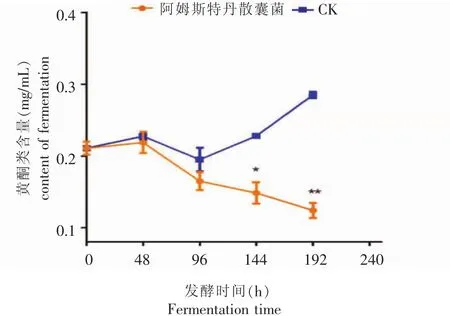
图2发酵过程中黄酮类含量的变化Fig.2 Changes of flavonoids content during fermentation
2.3 茶汤发酵过程中氨基酸含量的变化动态
从图3可以看出,随着发酵时间的不断延长,阿姆斯特丹散囊菌发酵液的氨基酸含量不断降低。在发酵进行了96 h后,发酵液的氨基酸含量与空白对照相比,具有显著性差异 (p<0.05);在144 h之后,发酵液的氨基酸含量与空白对照相比具有极显著差异(p<0.0001),与发酵前相比,氨基酸含量降低了45.60%。究其原因,一方面可能是在发酵中,氨基酸作为氮源被阿姆斯特丹散囊菌吸收利用;此外,氨基酸的氧化降解,如茶氨酸与茶多酚氧化产物结合生成暗色聚合物,也可能使氨基酸含量下降[15-16]。
2.4 茶汤发酵过程中可溶性糖含量的变化动态
从图4可以看出,随着发酵的不断进行,阿姆斯特丹散囊菌发酵液的可溶性糖含量不断下降,且其在96 h时与空白对照相比有显著性差异(p<0.05),在 144 h、192 h 时候,与空白对照相比,发酵液的可溶性糖含量均有极显著性差异 (p<0.0001);与发酵前相比,可溶性糖含量降低了24.83%。其原因是菌丝体的生长繁殖,需要消耗大量的可溶性糖作为碳源和能量来源,这也是阿姆斯特丹散囊菌在分离纯化时候需要在20%蔗糖查氏培养基上才能生长茂盛的原因。另一方面,糖类物质在微生物发酵作用下,与儿茶素生成糖苷化儿茶素[15],所以发酵液中可溶性糖含量不断减少。
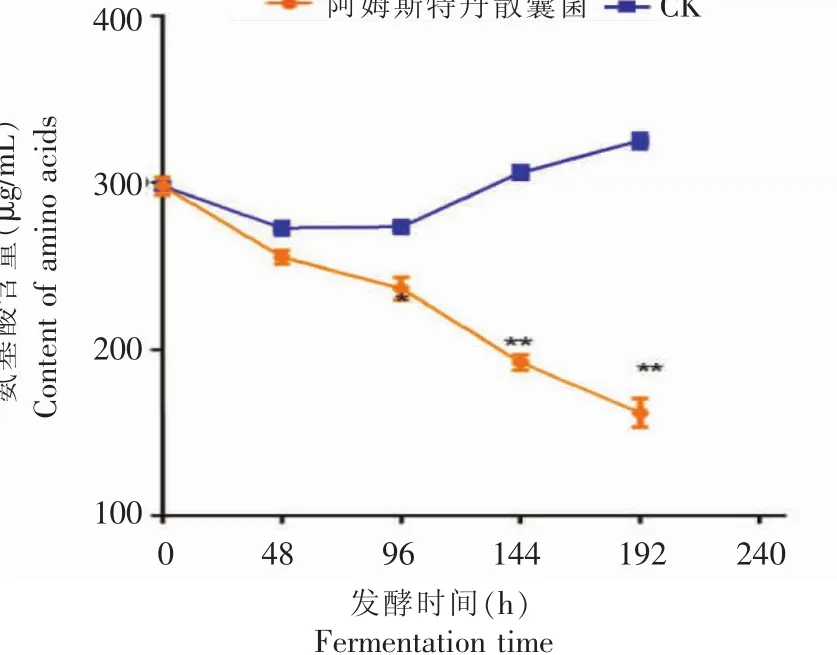
图3发酵过程中氨基酸含量的变化Fig.3 Changes of amino acids content during fermentation
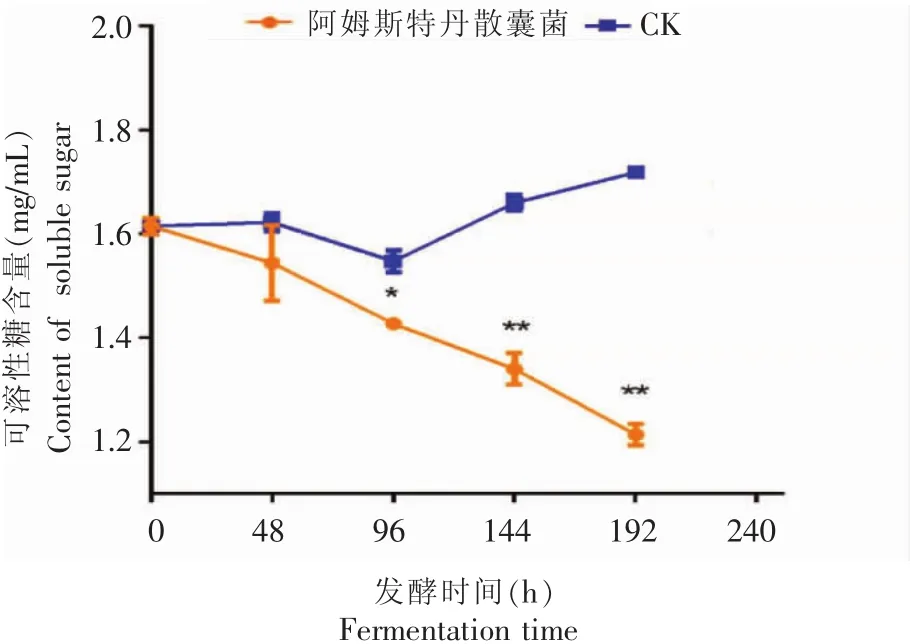
图4发酵过程中可溶性糖含量的变化Fig.4 Changes of soluble sugar content during fermentation
2.5 茶汤发酵过程中茶色素含量的变化动态
茶色素是茶多酚的氧化产物,其保健功效越来越受到大家的关注。研究表明,茶色素可以通过抑制癌细胞增殖周期,从而促进癌细胞凋亡[17];茶黄素可以抑制肿瘤侵染过程中的关键蛋白[18];茶红素则可以抑制DNA复合物的形成[19]。
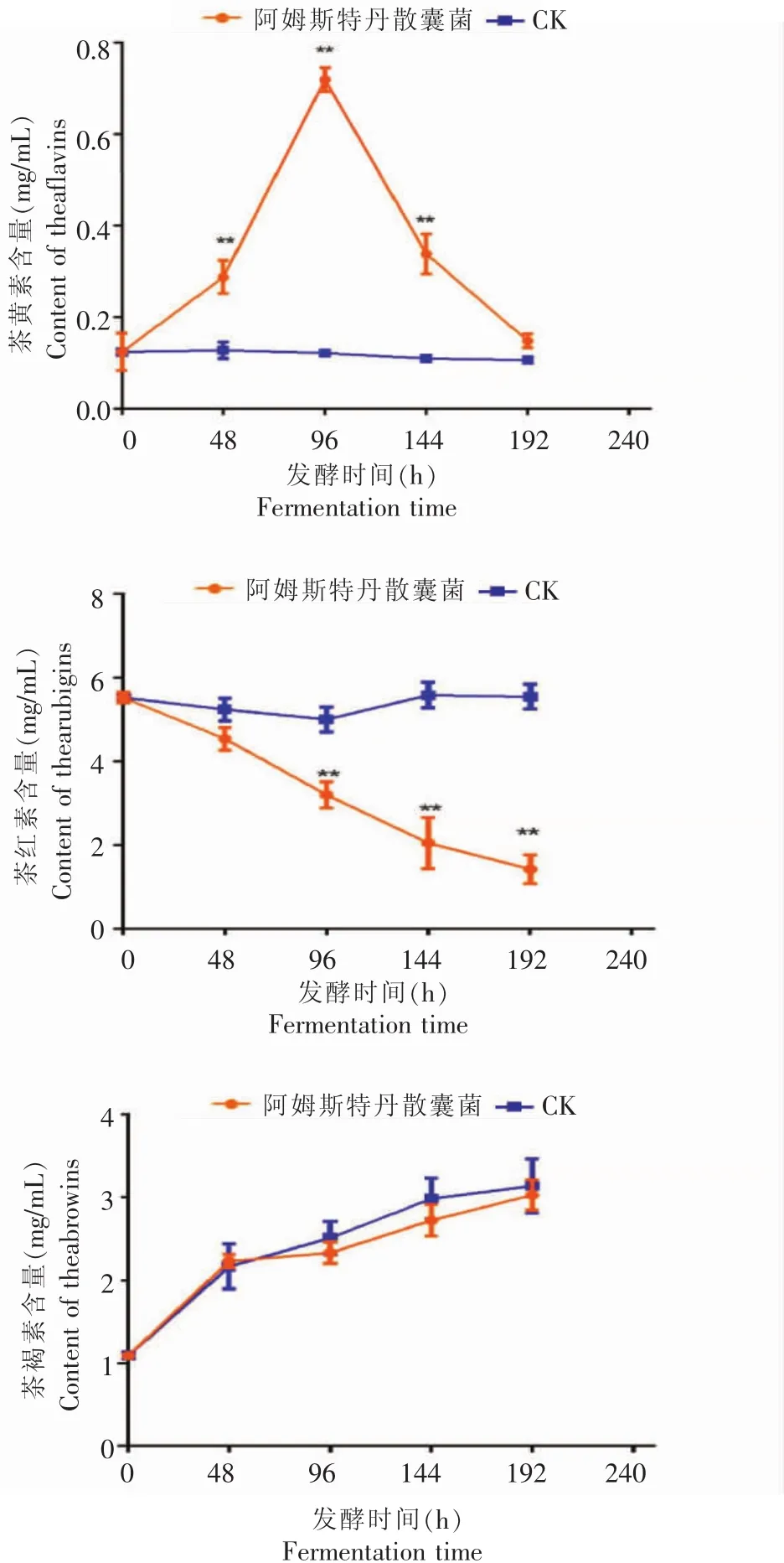
图5发酵过程中茶色素含量的变化Fig.5 Changes of tea pigments content during fermentation
从图5可以看出,在液态发酵过程中,阿姆斯特丹散囊菌发酵液的茶黄素含量是先增加后减少,主要是发酵前期由茶多酚类物质氧化形成,而在发酵后期,茶黄素进一步氧化形成茶红素,在48h、96 h与144 h时,茶黄素含量相对空白对照,都有极显著性差异(p<0.0001);在发酵之前,茶红素的初始含量占茶色素的5.66%,在发酵过程中,茶红素含量总体呈减少的趋势,在96 h、144 h与196 h均有极显著性差异(p<0.0001),一部分茶红素进一步氧化聚合形成茶褐素,另一部分可能是阿姆斯特丹散囊菌在生长过程中消耗了;发酵液茶褐素的含量呈总体增加的趋势,但是与空白对照相比,没有显著性差异(p>0.05)。对照组的茶红素与茶褐素含量比实验组的高,原因是茶汤冷却放久后会自动氧化形成茶色素,汤色变深,同时由于对照组中没有菌株,不会消耗茶色素。
2.6 茶汤发酵过程中咖啡碱含量的变化动态
从图6可以看出,在整个发酵过程中,阿姆斯特丹散囊菌发酵液咖啡碱含量相对于空白对照,具有极显著性差异(p<0.0001),咖啡碱含量呈先上升后下降再上升再下降的动态变化。在192 h发酵结束时,咖啡碱总量增加了28.00%。微生物生长中碳源能提供微生物所需的能量,氮源是组成生物体核酸、蛋白质的重要元素,茶汤中的氮源主要是蛋白质或其降解产生的氨基酸类[20],咖啡碱属于杂环化合物,其结构比较稳定,微生物对其利用率较低[21-22]。但试验中咖啡碱含量总体呈增长趋势,可能是因为发酵过程中,菌株分泌出大量水解酶和氧化酶,把大分子蛋白质、酯型儿茶素等物质降解,从而使咖啡碱与这些大分子物质的结合的沉淀解散,从而咖啡碱的含量增加。
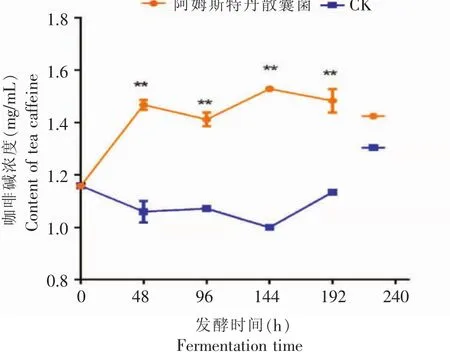
图6发酵过程中咖啡碱含量的变化Fig.6 Changes of caffeine content during fermentation
2.7 茶汤发酵过程中儿茶素类含量的变化动态
由表1可得,在发酵过程中,阿姆斯特丹散囊菌发酵液的儿茶素各组分含量变化较大。酯型儿茶素:表没食子儿茶素没食子酸酯(EGCG)、没食子儿茶素没食子酸酯(GCG)、表儿茶素没食子酸酯(ECG)、儿茶素没食子酸酯(CG)的含量呈不断下降趋势,与空白对照相比,都具有极显著性差异(p<0.0001),随着发酵时间的不断延长,除了儿茶素没食子酸酯(CG)还少量存在外,其他酯型儿茶素已经基本检测不到。说明酯型儿茶素在发酵过程中分解为非酯型儿茶素。非酯型儿茶素,包括儿茶素(C)、表儿茶素(EC)、没食子儿茶素(GC)、表没食子儿茶素(EGC)总体呈增加趋势,与空白对照相比,都达到了显著性差异(p<0.05)。没食子酸含量也呈先增加后减少的趋势,说明随着菌丝体的不断增加,儿茶素组分被消耗利用了。发酵液的儿茶素总量呈不断减少的趋势,在192 h发酵结束时减少了8.63%。在这里值得注意的是,与其他茶类相比,六堡茶的儿茶素含量普遍偏低,可能是由于品种原因,或者是因为毛茶加工时,具有沤堆和高温汽蒸过程,儿茶素损耗了。

表1 发酵过程中儿茶素含量的组分变化(单位:μg/mL)Table 1 Change of catechins content during fermentation (Unit: μg/mL )
3 讨论
试验利用单一菌株液态发酵的形式,探究阿姆斯特丹散囊菌对六堡茶品质成分的影响。结果表明,在整个液态发酵液过程中,其茶多酚、黄酮类、氨基酸、可溶性糖的含量均不断减少,与灭菌的空白对照组相比,均具有极显著性差异 (p<0.0001),茶黄素含量先增加后减少,茶红素含量总体呈减少的趋势,而茶褐素含量呈总体增加的趋势。主要是因为“金花菌”产生的胞外酶能分解茶叶中的蛋白质、多糖,及把茶多酚氧化为茶色素等,使决定茶叶品质的物质之间比例更加协调[23]。发酵液的咖啡碱含量呈总体上升的趋势,儿茶素总含量下降,酯型儿茶素分解为非酯型儿茶素,EGCG、ECG、GCG在发酵后期几乎检测不到,没食子酸与非酯型儿茶素的含量呈先增加后减少的趋势,且与空白对照相比,均有极显著性差异 (p<0.0001)。结果证明在发酵过程中,阿姆斯特丹散囊菌对六堡茶品质成分的转化产生了关键作用。本研究对进一步探明六堡茶品质转化形成的机理、改善六堡茶加工技术具有一定的参考价值。

