ECT脑血流灌注显像、CT和MRI在难治性癫痫中的诊断价值分析
李玉花, 罗 昕*, 于克文, 巩 晓, 刘 伟, 曾祥芹, 何 兵
(1. 淄博市中心医院 影像科, 山东 淄博 255036; 2. 淄博市妇幼保健医院, 山东 淄博 255000)
癫痫以反复发作中枢神经系统功能失常为特征[1],是仅次于脑卒中的第二大神经系统疾病。我国癫痫患病率为3.60‰~7.00‰,约20.00%~30.00%癫痫患者对保守药物治疗不敏感,可发展为难治性癫痫[2]。难治性癫痫以外科手术治疗为主,术前准确定位致痫灶是手术成功的关键,脑电图是癫痫无创诊断的首选,但是由于癫痫发作放电迅速,非病灶区发作间期也可出现异常波峰,因此脑电图诊断癫痫可能出现误诊或漏诊现象。MRI可清晰观察脑结构,为规范手术治疗提供支持[3],但存在致痫灶定位敏感性和特异性低的弊端。核医学正电子发射式计算机断层显像(positron emission tomography,PET)和单光子发射计 算机断层成像术(single-photon emission computed tomography,SPECT)均是脑功能显像技术,能够提供解剖、代谢、血流灌注、生化、功能、氧耗、化学递质及神经受体等改变信息,能准确定位致痫灶。其中PET是癫痫定位和诊断金标准[4],但是PET价格昂贵,操作复杂,限制了在临床中的应用。SPECT廉价、操作方便,更适合临床普及[5]。本文探讨常规CT、SPECT、MRI在难治性癫痫检出和定位中的应用价值。
1 资料与方法
1.1 一般资料
回顾性收集2013年10月~2018年12月于我院收治的53例难治性癫痫患者临床资料,所有患者资料均来自我院数字化病理管理中心,所有患者均经抗癫痫药物治疗后无效,经神经内科或外科诊断为难治性癫痫,符合1989年国际抗癫痫联盟癫痫诊断标准[6]。所有患者CT、SPECT、MRI检查资料完整,均行手术治疗,术后临床症状缓解,病理证实为存在神经元细胞变性,胶质细胞增生以及噬神经现象,并排除精神疾病、其它神经内科或外科疾病。其中,男32例、女21例,年龄32~59岁,平均(41.05±6.17)岁,病程6~21年,平均(12.33±3.20)年;疾病类型:单纯部分性发作13例,全面强直阵挛性发作23例,复杂部分性发作17例。
1.2 方法
1.2.1CT与SPECT
常规CT扫描:GE Optima 64排螺旋CT,参数设置:管电流120 mA、管电压200 kV、矩阵512×512、薄层重建层厚5 mm、球管旋转速度 0.5 s/周、8层/转,标准方法重建CT图像,以枕叶和额叶形成软化灶为阳性判断标准。
SPECT:仪器为Siemens E.Cam双探头CT扫描仪 (德国西门子公司),在发作间期进行脑血流灌注显像。检查前禁饮咖啡、酒,禁止吸烟,禁食4 h以上,控制血糖在正常水平。静脉注射显像剂99mTc-ECD(中国原子能研究院,防化纯度>95.00%),安静休息40 min左右进行SPECT检查。患者佩戴眼罩平躺,保持检查环境安静,扫描整个头部,参数:管电压120 kV、管电流180 mA,层厚3.75 mm,矩阵128×128,轴向视野25 cm,探头旋转180°,每6°采集1帧,每帧35 s,采集60帧横断面图。应用专用软件图像处理采集图像,由我院CT室具有5年以上SPECT审片经验的医师进行定性和定量分析,选择连续两个平面以上肉眼可辨的局限性放射性摄取减低或缺损区为感兴趣区(region of interest,ROI),软件自动计算相对局部脑血流量( regional cerebral blood flow,rCBF),取平均值[7]。
1.2.2MRI
Trio Tim3.0T磁共振扫描仪(德国西门子),12通道相控阵线圈。分别行常规头颅横断面T1WI、T2WI、液体衰减反转恢复(FLAIR)序列、海马像垂直于海马长轴斜冠状位T2WI及T2WI-FLAIR序列扫描,然后行1H-磁共振波谱(magnetic resonance spectroscopy, MRS)扫描,参数设置:FOV160 mm×160 mm,体素10 mm×10 mm×10 mm,TTR 4300 ms,TE 105 ms。选择垂直于海马长轴写冠状面定位,ROI定位于双侧内侧颞叶区,采用点分辨自旋回波序列生成ROI代谢物谱线。图像处理,由我院两位具有5年以上MRI审片经验医师进行双盲图像分析,观察两侧区海马大小、形态、信号,颞叶有无萎缩及是否对称。1H-MRS选择基线稳定,信噪比好的谱线进行分析,记录N-乙酰天门冬氨酸(N-acetylaspartate,NAA)、胆碱( choline,cho) 、肌酸(creatine,Cr)代谢物峰值下面积,计算NAA(cho+Cr)比值,以NAA(cho+Cr)<0.68或双侧差异>7.00%为致痫灶定位标准[8]。
1.3 统计学分析
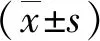
2 结果
2.1 常规CT检查结果
常规CT共检出12例癫痫病灶,表现为左枕叶和左侧额叶形成软化灶(图1a),癫痫病灶检出率22.64%,其中6例定位于术中符合,致痫灶定位准确率11.32%。
2.2 MRI检查结果
常规MRI扫描显示,T2WI可见海马区高信号异常区,T1WI未见异常信号 (图1b、c)。MRS 可见代谢异常,32例均出现不同程度单侧或双侧NAA峰值降低(图1d),cho、Cr升高,NAA(cho+Cr)降低,30例于术后病理结果一致,致痫灶阳性检出率60.38%。其中25例明确定位致痫灶,与术中所见一致,定位准确率47.47%,其中16例单侧 NAA(cho+Cr)降低,9例双侧NAA(cho+Cr)降低。21例患者因NAA(cho+Cr)无明显变化未能准确定位。53例患者患侧NAA(cho+Cr)平均值为(0.47±0.05)、健侧NAA(cho+Cr)平均值为(0.69±0.11),经配对样本t检验显示差异显著(t=13.255,P<0.05)。
2.3 SPECT检查结果
SPECT脑血流灌注显像显示53例患者中43例明确定性判断,表现为单侧或双侧各叶皮质局限或广泛灌注降低(图1e、f),43例患者术后病理 显示海马组织中神经元细胞减少呈条带状分布,可见胶质细胞增生,致痫灶阳性检出率81.13%。其中39例可明确定位,与术中所见一致,定位准确率73.58%,其中25例致痫灶位于单侧颞叶,14例位于双侧颞叶。10例双侧各叶皮质、基底节、丘脑脑灌注对称,未能明确定位,后经术后证实3例左侧颞叶癫痫,7例右侧颞叶癫痫。53例患者患侧rCBF 平均值为(46.05±7.62)、健侧rCBF平均值为(54.51±9.39),经配对样本t检验显示差异显著(t=5.093,P<0.05)。

图1 男,46岁,反复发作性意识丧失20年,加重伴四肢抽搐1次,临床诊断为右侧颞叶癫痫a为常规CT图; b、c为T1WI、T2WI序列显示; d为右侧海马区1H-MRS; e、f为SPECT冠状位、轴位图像,可见右侧颞叶皮质脑灌注降低,左右两侧rCBF值分别为35.36、62.17Male, 46 years old, recurrent episode loss of consciousness for 20 years, aggravated with limb twitching once, clinical diagnosis of right temporal lobe epilepsya: a conventional CT map; b and c :T1WI, T2WI ; d: right 1H-MRS in the lateral hippocampus; e and f: SPECT coronal and axial images, showing that the cerebral perfusion of the right temporal lobe cortex is reduced, and the rCBF values on the left and right sides are 35.36, 62.17, respectively
2.4 常规CT、SPECT、MRI对致痫灶检出率、定位准确率比较
经卡方检验SPECT对致痫灶检出率、定位准确率均明显高于MRI(χ2=5.517、7.729,P<0.05),MRI高于常规CT(χ2=42.053、15.543,P<0.05)。联合诊断以三项检测一项异常为阳性,联合诊断对致痫灶检出率、定位准确率分别达94.34%、92.45%,高于单独诊断(P<0.05)。数据列于表1。

表1 常规CT、SPECT、MRI对致痫灶检出率、定位准确率、灵敏度、特异度差异
注: a.与常规CT比较,P<0.05; b.与MRI比较,P<0.05; c.与PET-CT比较,P<0.05
2.5 ROC分析
分别以rCBF、NAA(cho+Cr)为定位致痫病灶的预测指标,采用ROC分析rCBF预测致痫病灶位置的最佳截断值(cot-off)为43.57,该界值下预测致痫病灶位置的灵敏度、特异度分别为62.41%、85.75%,曲线下面积(area under curve,AUC)为0.789(95%CI:0.650~0.927,P=0.001)。NAA(cho+Cr)致痫病灶位置的最佳cot-off为0.60,该界值下预测致痫病灶位置的灵敏度、特异度分别为35.85%、80.25%,AUC为0.681 (59%CI :0.512~0.851,P=0.046)。联合rCBF+NAA(cho+Cr)预测致痫病灶位置的AUC达0.923(95%CI:0.852~0.994,P=0.001),灵敏度和特异度达82.26%、98.91%。联合诊断AUC面积均高于rCBF、NAA(cho+Cr)(Z=3.657、5.985,P<0.05),rCBF、NAA(cho+Cr)AUC比较无统计学差异(Z=1.685,P>0.05),结果见图2。

图2 rCBF、NAA(cho+Cr)、rCBF +NAA(cho+Cr)预测难治性癫痫致痫病灶位置的ROC图ROC charts of rCBF, NAA (cho+Cr), rCBF+NAA (cho+Cr) in predicting the location of epileptogenic focus in refractory epilepsy
3 讨论
癫痫是以神经元兴奋和抑制失衡导致自发性突发异常放电为病理特征,患者多出现神经系统功能异常,而无器质性病变,因此,神经影像学检查对癫痫的诊断具有重要价值。常规CT在癫痫病灶检出方面价值有限[9],发射型计算机断层扫描(emission computed tomography,ECT)是注入放射性核素观察其在脑组织代谢情况以定位癫痫的影像检查方法,在癫痫术前定位中有较高应用价值,分为SPECT和PET,均是无创癫痫诊断和定位定侧颇具前景的影像检查方法[10,11]。99mTc-ECD 是目前最为常用的SPECT代谢示踪剂,是脂溶性药物,可通过血脑屏障进入脑组织,与脑组织结合后发生改变,洗脱过程缓慢,在脑组织中维持一种恒定分布状态,而99mTc-ECD的摄入量与脑血流量呈正比,因此99mTc-ECD的摄入情况可反应脑血流量[12],癫痫反复发作可导致脑组织缺氧、缺血,并产生大量氧自由基,破坏脑细胞和神经元,且脑组织损伤程度与癫痫发作次数有关。因此SPECT图像可观察到致痫区域血流量灌注明显减少,表现为rCBF降低,可基本确定致痫灶。Shiga等[13]报道同样指出99mTc-ECD SPECT脑血流灌注显像可准确检出癫痫病灶,本组53例癫痫患者99mTc-ECD局部灌注量降低检出率为81.13%,表现为单侧或双侧各叶皮质局限或广泛灌注降低,与术后病理结果一致。致痫灶定位准确率73.58%,与术中所见一致。rCBF指脑组织局部每分钟脑血流量,SPECT检查中测量rCBF值是显像剂99mTc-ECD在脑组织中灌注信息的准确反应,可定量区分脑组织血流灌注情况,定位致痫灶。本研究观察到难治性癫痫患者患侧rCBF明显低于健侧,提示rCBF可作为致痫灶定位的定量检测指标,ROC分析rCBF对致痫灶定位有一定价值,AUC达0.789,说明rCBF可准确检出致痫灶,与多数研究结果一致[14,15]。
MRI是神经影像学检查的主要手段之一,随着MRI技术的不断提高,MRS技术克服常规MRI的局限,从神经电生理、分子层面反映癫痫病理生理改变,提高难治性癫痫致痫病的检出率[16,17]。1H-MRS中点分辨自旋回波序列谱线信噪比高,可定量观察脑组织特定代谢物浓度,反应致痫灶神经元功能、胶质细胞活化等情况[18]。本研究发现难治性癫痫患者的患侧与健侧NAA(cho+Cr)差异显著,表现为患侧NAA(cho+Cr)较健侧明显降低,分析原因为癫痫发作时致癫痫灶异常放电,导致脑组织神经递质代谢异常失衡,神经元变性和死亡,说明NAA(cho+Cr)可作为致痫灶定位的判断指标。本研究MRS对致痫灶的检出率60.38%,定位准确率47.17%,低于SPECT,其中21例未检出致痫灶,表现为双侧NAA(cho+Cr)差异较小,导致无法准确鉴别,分析原因可能是病变程度较轻,NAA(cho+Cr)降低不明显。MRI对难治性癫痫致痫灶定位准确率与采集技术密切相关,高分辨率MRI图像需要较高磁场强度,且MRI主要通过组织结构和形态异常,如脑萎缩、海马硬化来评价病变,对于致痫病灶较小或无明显解剖异常患者来讲,对癫痫病灶的检出存在一定局限性,无法准确定位[19,20]。MRS虽然可通过观察脑组织NAA、cho、Cr代谢来判断致痫病灶,但当一侧病变异常放电经一侧杏仁核、海马,经穹隆联合和前联合影响对侧海马和杏仁核时,可导致双侧NAA(cho+Cr)均降低,为致痫灶定位定侧带来难度。本研究以NAA(cho+Cr)为判断致痫灶定位的指标,ROC分析其预测致痫灶的AUC 0.681,提示NAA(cho+Cr)对致痫灶定位具有一定价值,但其灵敏度有待提高。本研究观察联合 SPECT、CT、MRI可大大提高对致痫病灶的检出率和定位准确率,分别达94.34%、92.45%,均高于单独CT、SPECT、MRI检查,联合rCBF+NAA(cho+Cr)预测致痫灶AUC提高至0.923,提示临床对于癫痫可先利用CT、MRI进行初步判断,无法定位者可行MRS、 SPECT检查,以提高致痫灶定位定侧准确率。
SPECT、MRI对难治性癫痫术前定位均有较高临床应用价值,SPECT在致痫灶检率、定位定侧方面更有优势,联合诊断更有助于提高定位准确率。在难治性癫痫术前定位中应在常规CT、MRI检查基础上应根据患者情况联合SPECT和 MRS检查。

