艾灸对压疮大鼠皮肤组织中eNOS蛋白表达的调控作用*
韩 超,孙忠人
(1.深圳市宝安区中心医院,广东 深圳 518101;2.黑龙江中医药大学附属第二医院,黑龙江 哈尔滨 150001)
压疮(pressure ulcer)又称压力性溃疡,是指人体皮肤组织因活动不便而长期受压,引起局部缺血、缺氧而最终导致的皮肤损伤[1]。压疮给患者带来了严重的疾病痛苦和昂贵的医疗费用,已成为临床护理工作中急需解决的难题。目前对压疮的治疗还是以药物外用为主[2],但存在疗效反复的问题,如何结合传统中医疗法进行疾病的治疗相关研究,正成为当今医学研究的热点。艾灸疗法作为中医学特色疗法,因其具有温通经脉和行气活血的功效,可扶补人体正气,改善气血运行,已有在临床中应用于压疮的治疗报道。压疮干预的本质是创伤修复的血管新生,而这一过程与内皮型一氧化氮合酶(eNOS)蛋白密切相关[3],所以本实验采用HE染色和免疫组化法观察压疮大鼠皮肤组织的变化,通过艾灸对组织形态学和eNOS蛋白的影响,探讨艾灸在促进压疮修复过程中的作用机制。
1 材料与方法
1.1 实验动物及分组
SPF级雌性SD大鼠共50只,体质量220~250 g,购于黑龙江中医药大学实验动物中心(实验动物许可证编号:SYXK 2016004)。实验过程中对动物处置均符合动物实验福利标准和动物实验伦理标准。空白组10只,运用先造模后分组的方法,将余下40只SD大鼠先进行缺血-再灌注压疮造模,造模成功后按照随机数字表法,分为模型组、艾灸组、模型抑制剂组和艾灸抑制剂组,每组各10只大鼠。相同条件下常温单笼饲养。
1.2 造模方法
本造模装置为实验团队自制装置,见图1,所造模型为改进的缺血-再灌注模型[4](Rats Pressure Ulcer Model by Ischemia-Reperfusion,RPUMIR)。通过已知目标压强P值(150 mmHg)和模型创面面积S值(即螺钉下端面积1 cm2),可通过压力计算公式(F=PS)算出压力(通过放置相应重量的钢珠实现)。压力确定后,将大鼠仰卧固定于铁架上,近膝关节骨隆突处进行脱毛处理。将装置垂直放置大鼠身上,使螺钉下端压于近膝关节骨隆突处,使受压处缺血并保持2 h,后移开装置使造模处不受压,进行再灌注0.5 h,再灌注期间将大鼠放回单笼,自由饮水进食,如此为1个循环,每天进行5个循环,共进行3天,即可完成模型制备。

图1 自制压疮造模装置
1.3 主要仪器及试剂
显微图像釆集系统(日本Nikon公司);LDZ4-0.8台式离心机(北京京立公司);CX41奥林巴斯显微镜(日本Olympus公司); Anti-eNOS antibody(武汉博士德生物工程有限公司);wortmannin抑制剂(美国Selleck公司);二甲基亚砜DMSO(武汉博士德生物工程有限公司);免疫组化试剂盒(丹麦DAKO抗体生产商);DAB显色剂(丹麦DAKO抗体生产商);Wortmannin抑制剂(碧云天生物技术研究所);DMSO(碧云天生物技术研究所);无烟艾条(南阳汉医艾绒有限责任公司);艾灸造模及治疗装置(实验团队自制)。
1.4 干预方法
空白组:腹腔注射等量生理盐水(1.4 mg/Kg),相同条件下抓取固定15 min。模型组:每日干预前,给予等量生理盐水腹腔注射(1.4 mg/Kg),仰卧位固定15 min。艾灸组:每日干预前,给予等量生理盐水腹腔注射(1.4 mg/Kg)。仰卧位固定,进行艾灸治疗,应用回旋灸操作,艾条燃烧端距创面中心3 cm,每次治疗15 min,每日治疗1次。模型抑制剂组:每日干预前,腹腔注射wortmannin 1.4 mg/Kg,仰卧位固定15 min。艾灸抑制剂组:每日干预前,腹腔注射wortmannin 1.4 mg/Kg。艾灸操作同艾灸组。
各组大鼠每天干预1次,疗程为10天。艾灸治疗过程中,通过皮温仪实时观测艾灸温度,艾灸温度控制在(42±1)℃范围内。及时测量并记录创面局部温度;处理艾条燃烧产生的艾灰,避免因艾灰跌落创面引起压疮表皮负损伤。
1.5 取材方法及检测流程
在治疗10天后对各组大鼠进行取材,根据大鼠体重配置(350 mg/Kg)10%的水合氯醛并记放入包埋框,后投入甲醛溶液中保存。取完标本的大鼠给予脱颈椎处死。
HE染色观察方法[5]:①二甲苯脱蜡,将切片置于二甲苯中浸泡10 min×2次;梯度酒精脱水,无水乙醇,浸泡1 min×3次;95%乙醇,浸泡1 min;85%乙醇,浸泡1 min;75%乙醇,浸泡1 min。②1×PBS 洗5 min,共3次。③苏木精染色5 min,自来水洗10 min。④1%盐酸酒精分化5 s,蒸馏水洗10 min。⑤伊红染色5 min,自来水洗30 s。⑥无水乙醇5 min×2次。⑦二甲苯5 min×3次。⑧中性树胶封片。⑨每张切片在400倍光镜下采集10个视野的图像,为更鲜明示意各种细胞分布趋势,HE染色图示均以×200倍光镜下采集的视野作为示例。
免疫组化观察方法[5]:①石蜡包埋及切片:将组织放入盛有石蜡的模具中,摆好位置,冷却。切片机切片,切片厚度为3~5 μm黏附在防脱处理的玻片上。②脱蜡和水化:二甲苯脱蜡,将切片依次置于二甲苯、梯度乙醇及去离子水中浸泡。③抗原修复:切片浸入0.01 M枸橼酸缓冲液,加热至沸腾,冷却后反复操作两次,自然冷却至室温。④阻断内源性过氧化物酶:将切片置去离子水中浸泡1 min×3次;圈定玻片上待测组织区域,PBS溶液冲洗2 min×3次;后在圈定区域内加适量内源性过氧化物酶阻断剂,室温孵育10~15 min,PBS溶液冲洗2 min×3次。⑤封闭:滴加5%BSA封闭液,室温封闭1 h,甩去多余液体。⑥孵育I抗,滴加稀释后的I抗,eNOS(1∶100),4℃恒温过夜,PBS溶液冲洗2 min×3次。⑦孵育II抗:滴加经稀释的辣根酶标记II抗,室温孵育30 min,PBS溶液冲洗2 min×3次。⑧显色,滴加适量配置好的DAB显色剂,室温5 min左右。⑨复染,自来水冲洗,苏木精复染10~30 s,1%盐酸分化,自来水冲洗返蓝。脱水、透明、封片。读片及结果判定:采用Image Pro Plus图像分析软件(Version 6.0),每张切片随机采集400×图像6张。选取有效指标积分光密度值(Integrated Optical Density,IOD)进行半定量分析,即IOD =∑(OD×Area)。当细胞内出现黄色或黄棕色颗粒表达时即为阳性。
Western Blot观察法:①蛋白样品制备:液氮中取出脑组织放入预冷研钵充分短时研磨,加入蛋白裂解液至研钵冲洗研磨好的组织,充分混匀后将悬液放入EP管中,使用前加蛋白酶抑制剂。②BCA蛋白法定量:将悬液放在冰上冰浴20 min,确保裂解充分,离心20 min后收集上清。采用BCA蛋白定量试剂盒定量检测各标本总蛋白。③稀释标准品:将测定好浓度的细胞裂解液与4×sample buffer混匀,置于100℃沸水中5 min,低速离心3~5 s,室温冷却,将蛋白marker和样品依次加到凝胶的上样孔中,空余的上样孔用1×sample buffer补齐。④SDSPAGE电泳:预先将PVDF膜在甲醇中浸泡5~10 min,使之激活,采用湿法将凝胶转移至电转夹中,注入 transfer buffer,在冰上以200 mA转膜2 h。⑤封闭及杂交:将转有蛋白的PVDF膜放入杂交袋中,再加入3%的BSATBST封闭液,置于翻转仪上平缓翻转,封闭2 h。后将PVDF膜与抗体稀释液置于杂交袋中孵育过夜。用TBST对PVDF膜进行洗涤。将二抗用3%的BSA-TBST封闭液稀释,并与PVDF膜置于杂交袋中,孵育1.5 h。⑥曝光:按照ECL增强发光液试剂盒的说明书配制曝光液,向PVDF膜上滴加显色曝光。⑦结果采用Quantity One图像分析软件进行定量分析。
1.6 统计学方法

2 结果
2.1 各组HE染色比较
空白组大鼠皮肤结构完整,复层鳞状上皮组织层次清晰,无明显炎症细胞浸润。各造模组大鼠压疮创面组织,复层鳞状上皮结构不清,肌纤维水肿明显,大量炎症细胞浸润。模型组创面组织出现少许肉芽组织;创面可见上皮细胞,肉芽组织中炎性细胞以巨噬细胞为主,创面底部出现成纤维细胞。艾灸组压疮创面被正常上皮细胞覆盖,并被新生毛囊完全填充,毛囊下存在少量修复组织,新生组织中存在大量成纤维细胞,成纤维细胞较模型组排列紧密。艾灸抑制剂组部分被肉芽组织填充,毛细血管较丰富,创面已有上皮覆盖,但较艾灸组生长缓慢。模型抑制剂组创面面积减小,略可见肉芽组织,创面底部可见巨噬细胞,创面但无新生毛囊。见封三彩图2。
2.2 各组eNOS蛋白表达比较
eNOS蛋白在皮肤组织的中性粒细胞﹑内皮细胞、成纤维细胞均有表达,阳性表达为棕黄色或黄色颗粒样。干预10天后,eNOS组别表达量差异如下:空白组表达量较其他4组相对较少;模型组IOD值高于空白组(P<0.05);与模型组相比,艾灸组表达量IOD值较高,差异具有统计学意义(P<0.05),表明艾灸可以提高压疮组织中eNOS蛋白表达。艾灸抑制剂组干预较模型组有缓慢增加趋势,但表达量显著低于艾灸组,差异具有统计学意义(P<0.05),提示特异性抑制剂wortmannin有阻断eNOS表达的影响;模型抑制剂组表达均低于模型组,存在显著性差异。见表1、封三彩图3。
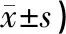
表1 各组eNOS蛋白表达情况 (OD值,
注:与空白组比较,#P<0.05;与模型组比较,*P<0.05;与艾灸组比较,★P<0.05。
2.3 各组p-eNOSs1117蛋白表达比较
Western Blot检测结果发现,p-eNOSs1117/β-actin空白组表达最少。模型组磷酸化eNOS表达均高于空白组,有统计学意义(P<0.01)。与模型组相比,艾灸组p-eNOSs1117/β-actin表达值因有艾灸作用干预而有相对较高表达,差异具有统计学意义(P<0.05),同时表达值在5组中为最高表达。艾灸抑制剂组和模型抑制剂组表达分别低于艾灸组(P<0.05)和模型组(P<0.01),差异具有统计学意义。结果表明,艾灸可以上调eNOS蛋白表达,促进血管新生,而特异性抑制剂wortmannin的应用则会PI3K/Akt信号通路,抑制艾灸作用。见表2、图4。
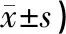
表2 各组大鼠p-eNOSs1177/β-actin表达情况(OD值,
注:与空白组比较,#P<0.01;与模型组比较,*P<0.05,▲P<0.01;与艾灸组比较,★P<0.05。

图4 各组p-eNOSs1177蛋白在大鼠皮肤组织中的表达( Western Blot)
3 讨论
压疮因其昂贵的防治成本与漫长的治疗时间,是长期困扰护理工作中的常见问题,如何通过科学的研究方法,模拟压疮的形成机制,并从中探索干预压疮的有效方法,已成为现今临床科研工作者的研究热点[6]。压疮修复的本质是血管新生,而这一过程与血管内皮细胞作用密切相关。艾灸疗法作为中医疗法,具有改善循环和创伤修复等作用,本研究在前期实验中已有观察,艾灸疗法可以有效促进创面愈合、促进内皮细胞增殖、提高平均血流灌注量[7],但缺乏分子生物学相关研究,所以本研究在PI3K/Akt信号通路层面进行了以上具体研究。
血管内皮细胞生成因子(VEGF)是已得到广泛证实的促血管生长因子,在与血管内皮细胞相应受体结合后可介导 PI3K/Akt信号通路,促进血管网络重建[8]。PI3K/Akt信号通路作为调节细胞存活与凋亡的重要传导通路,在诱导细胞凋亡、存活、增殖和迁移方面具有重要的调节作用。压疮中皮肤损伤的实质是细胞凋亡[9],而PI3K/Akt信号通路在被激活后会与下游信号分子Akt发生激活效应,使其磷酸化,而磷酸化Akt则进一步对eNOS的调控,可以通过促进NO的生成,为微血管新生提供氧气和营养物质。内皮型一氧化氮合酶(eNOS)能够生成NO而发挥广泛的生物调节作用,能够在皮肤损伤中发挥细胞增殖、炎症调节以及血管生成等多种作用[10]。eNOS在激活后,会促进单核细胞、血管内皮细胞和成纤维细胞的生成和增殖,改善伤口局部血液循环[11]。eNOS蛋白检测结果发现:模型组eNOS虽呈低水平表达,但提示与机体已启动皮肤损伤应对机制,生成少量eNOS表达对创面修复进行调节作用;与模型组相比,艾灸组eNOS表达值有相对较高表达,证实艾灸可以上调eNOS表达量,为皮肤损伤愈合提供营养及内环境[12]。艾灸抑制剂组因使用特异性抑制剂wortmannin从而阻断艾灸治疗功效,所以表达低于艾灸组。研究结果发现,艾灸可以通过激活eNOS蛋白,促进大量NO生成,增加血管舒张等作用[13],为损伤皮肤的修复提供营养,加速压疮修复。
艾灸因具有行气活血和温经通络的作用,已在临床中用于损伤组织的治疗[14]。研究发现,艾灸可调节TNF-α和IL-6等细胞因子,改善损伤皮肤的炎症浸润程度,调整自由基代谢失衡,对糖尿病皮肤溃疡大鼠的创面愈合发挥关键作用;同时,艾灸还对巨噬细胞的吞噬能力具有调节作用,增强吞噬能力可促进杀伤病原体,促进巨噬细胞的自噬性更新,利于组织损伤的修复。向丽婷等[15]研究发现,艾灸可通过迷走神经通路修复应激性胃黏膜损伤大鼠;杨娇等[16]指出,艾灸燃烧时产生的挥发油是促进创面愈合的有效成分,因为挥发油可以调节中性粒细胞的数目,减轻炎性组织凋亡和水肿,对创面愈合有促进作用。多数文献证实,艾灸作用不仅局限在改善循环和免疫调节,同时还在损伤修复、抗病毒、镇痛等领域有大量研究空间。
笔者认为,研究压疮的修复机制,一定要从促进血管新生的角度出发。艾灸疗法作为具有温经活血功能的中医疗法,可通过调控PI3K/Akt信号通路下游的eNOS因子发挥作用。而艾灸能否对该通路下其他因子如bad或caspase-9产生影响,或通过VEGF介导的其他下游通路发挥作用,是今后探索艾灸在促进压疮修复中的重要研究方向。

