通用型NF-κB荧光素酶报告基因细胞系的构建
郑海亮 王东方 方雅 刁小伟 文勇,2 袁云霞,2
(1. 江苏奥赛康生物医药有限公司,南京 211112;2. 江苏奥赛康药业股份有限公司,南京 211112)
核因子 -κB(Nuclear factor kappa B,NF-κB)是由Sen和Baltimor首次从B淋巴细胞核提取物中发现的一种蛋白因子,能够与免疫球蛋白κ轻链的κB序列相结合[1]。NF-κB蛋白家族包括5个亚基:NF-κB1(P50)、NF-κB2(P52)、RelA(P65)、Rel(c-REL)和RelB,这些亚基能够形成同源或异源二聚体存在于细胞质中,其中以P50-P60形式最为常见。这些二聚体通常与抑制因子IκB(Inhibitor of NF-κB)结合,形成复合物,处于非激活状态。当受到刺激因素如肿瘤坏死因子(Tumor necrosis factor-α,TNF-α)、 病 毒、 氧 自 由 基、 脂 多 糖(Lipopolysaccharides,LPS)等刺激时,复合物被激活,解离出NF-κB并转移至细胞核中与相应的位点结合启动基因转录[2]。此外,NF-κB参与成纤维细胞生长因子受体(Fibroblast growth factor receptor,FGFR)[3]、表皮生长因子受体(Epidermal growth factor receptor,EGFR)[3]、神经生长因子受体(Nerve growth factor receptor,NGFR)[4]、 白 介 素 -1 受 体(Interleukin-1 receptor,IL-1R)[5-6]、CD40[7]等 受体或受体家族信号转导过程,是众多信号通路的交汇点,能够与多种细胞因子基因的启动子或增强子相结合,参与调控细胞增殖、分化、炎症和凋亡等过程。
报告基因(Reporter gene)是指编码易于被检测的酶或蛋白的基因,通常插入到表达调节序列当中,或与目的基因相连接形成嵌合序列。由于报告基因法作用迅速,往往只需要几个小时即可获取到检测结果,在体外药物筛选中可实现高通量操作,因此备受关注[8]。常用的报告基因包括荧光素酶(Luciferase)、荧光蛋白和β-半乳糖苷酶等。荧光素酶是指来源于自然界能够发光的生物体内,可以催化荧光素氧化发光的一类酶的总称,具有非放射性、灵敏度高、反应迅速、半衰期长等优点。截至目前,应用最为广泛的是来自于萤火虫和发光海肾的荧光素酶。萤火虫荧光素酶是一个单亚基蛋白,稳定性好且不需要进行翻译后修饰,可用于报告基因系统[9]。
在本研究中,构建了NF-κB-RE-Luc2P HEK293单克隆细胞系,由于NF-κB涉及细胞内多条信号转导通路,因此可用于NF-κB激活相关的药物活性检测,可进行改造和应用。本研究中以FGFRⅡ为例,对其扩展应用进行了初步验证。
1 材料与方法
1.1 材料
Plentivirus-NF-κB-RE-Luc2P, 购 买 于 QIAGEN公司;Plentivirus-FGFRⅡ,购买于Cyagen公司;HEK293细胞,购买于中科院细胞库;TNF-α,购自R&D公 司;生 长 培 养 基,DMEM(GIBCO)+10%FBS(GIBCO)+1%青链双抗(GIBCO),工作培养基,DMEM+1%FBS;选择培养基:生长培养基+2 μg/mL Puromycin(GIBCO),生长培养基 +2 μg/mL Puromycin+300μg/ml Hygromycin(GIBCO);SURE-entry,荧光素酶显色剂(One-Glo),购自 Promega公司;RNA提取试剂盒,购自QIAGEN公司;反转录试剂盒,SYBRGREEN I matrix,购自Takara公司;Palifermin®购自Amgen公司。
1.2 方法
1.2.1 HEK293细胞培养 病毒感染前1 d,采用0.25%胰酶消化,将处于对数生长期的细胞制备成单细胞悬液并计数,以1.6×104/mL细胞浓度接种24孔培养板,细胞数目为8×104/孔,在37℃、5%CO2饱和湿度培养箱中过夜培养。
1.2.2 病毒感染HEK293细胞 根据病毒感染使用说明,取一支病毒悬液于4℃ 解冻。移除24孔培养板中培养基,依次缓慢加入相应体积10%FBS+DMEM 培养基,完全解冻的病毒悬液,感染辅助试剂SURE-entry(终浓度=8 μg/mL),轻轻摇匀,37℃、5% CO2细胞培养箱中放置6-8 h,镜下观察细胞生长状态良好,继续培养72-96 h。
1.2.3 加压筛选及单克隆细胞株分离培养 培养72-96 h后,更换为选择培养基继续培养,间隔每2-3 d换液,筛选时间约2-3周,细胞融合度达到约90%时扩大培养至75 cm2细胞瓶,冻存多克隆细胞系。多克隆细胞复苏培养后进行单克隆筛选,以5/mL细胞浓度接种96孔培养板,每孔细胞数目为0.5个,24 h后镜下观察,挑选只含有单个细胞的细胞孔,间隔3-4 d换液,筛选时间约3周,细胞融合度达到约90%时消化细胞并逐渐扩大培养至75 cm2细胞瓶,冻存单克隆细胞系。
1.2.4 RT-QPCR 取 1×106个 FGFR Ⅱ /NF-κB-RELuc2P HEK293细胞提取RNA并测定RNA浓度。RNA反转录形成cDNA,反应体系为 1 μg RNA,4 μL 5× prime script buffer,1 μL Oligo DT primer,1 μL Oligo DT primer Random 6mers,补 H2O 至 20 μL。QPCR 反 应 体 系 为 12.5 μL SYBRGREEN I matrix,1 μL正向引物,1 μL反向引物,5 μL cDNA,补H2O至25 μL。引物序列:目的基因FGFRⅡ-F/R,CTCAAGCACTCGGGGATAAA/ CTGTTTTGGCAGGA-CAGTGA;内参基因Beta-actin-F/R,CATCGAGCACGGCATCGTCA/ TAGCACAGCCTGGATAGCAAC。反应程序为 95℃,15 s,40个循环;60℃,15 s,70℃,10 s。2-ΔΔCt方法计算基因相对表达量。
1.2.5 细胞系荧光素酶活性检测 取对数生长期的 NF-κB-RE-Luc2P HEK293 或 FGFR Ⅱ /NF-κB-RELuc2P HEK293细胞,消化计数,用工作培养基1%FBS+DMEM 稀释至 4×105个 /mL,转移 100 μL到96孔板中,细胞数目4×104个/孔,过夜培养。TNF-α刺激 NF-κB-RE-Luc2P HEK293细胞,生长培养基2倍梯度稀释TNF-α(100 ng/mL,共12个浓度梯度,每孔100 μL加入96孔板中;FGF融合蛋白刺激FGFRⅡ/NF-κB-RE-Luc2P HEK293细胞,工作培养基4倍梯度稀释FGF融合蛋白(50 ng/mL),共10个浓度梯度,每孔100 μL加入96孔板中;37℃、5%CO2孵育6 h后,每孔加入One-Glo 50 μL,室温反应5 min,放入酶标仪读数,实验结果采用四参数拟合。
1.2.6 统计分析 每组实验均重复3次或3次以上,所获得的数据均以平均值±标准差形式进行表示,数据均采用Graph-pad Prism5软件进行分析,不同数据间对比采用t检验法,当P<0.05时差异显著(*),当P<0.01时差异极显著(**表示P<0.01,***表示P<0.001)。
2 结果
2.1 病毒最佳感染效率(MOI)确定
在NF-κB-RE-Luc2P慢病毒感染HEK293实验中,MOI分别设置了0、5、10、15和20等5个梯度,实验结果(图1-A)表明,MOI为10-20时转染效果较好,其中又以MOI=15转染效率最高。当MOI=15时,用NF-κB-RE-Luc2P慢病毒感染细胞,所获得的多克隆细胞接种于96孔板中,进行功能验证。加入20 ng/mL TNF-α刺激6 h后,采用One-Glo化学发光法进行检测,信噪比可达到20.2倍(P=0.007 3)(图 1-B),结果表明 NF-κB-RE-Luc2P慢病毒已成功感染HEK293细胞。
2.2 NF-κB-RE-Luc2P HEK293细胞系单克隆筛选及验证
为了进一步得到稳定传代的细胞系,多克隆细胞NF-κB-RE-Luc2P HEK293采用有限稀释法进行单克隆分离培养,使用Puromycin加压筛选。经过加压与分离培养,成功地获得了NF-κB-RE-Luc2P HEK293单克隆稳定表达细胞系。将获取的单克隆细胞铺到96孔板,进行功能验证。TNF-α(100 ng/mL起始,2倍梯度稀释)刺激6 h,采用One-Glo化学发光法进行检测。数据显示(图2-A),响应值与TNF-α浓度可拟合成剂量依赖的“S”型曲线,当TNF-α浓度为20 ng/mL时与对照组相比,信噪比可达到113.7倍以上(P<0.001)(图2-B)。结果表明,本研究成功获得NF-κB-RE-Luc2P HEK293单克隆细胞系。
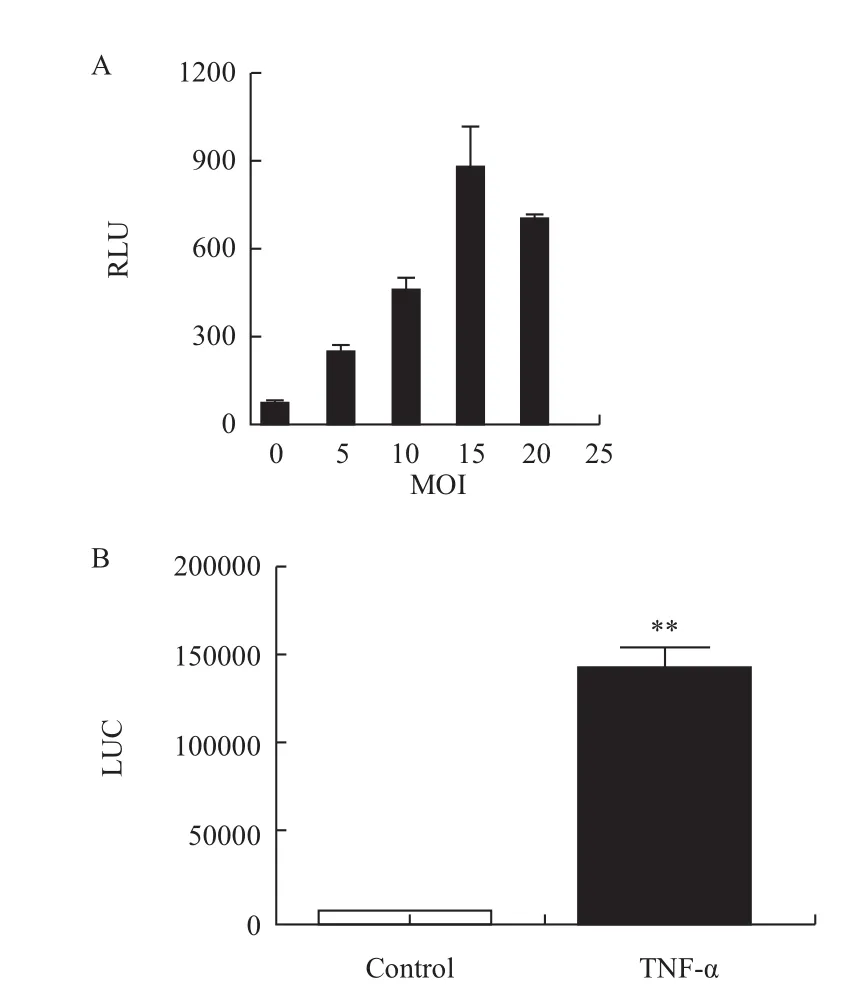
图1 MOI及病毒感染验证
2.3 NF-κB-RE-Luc2P HEK293细胞系应用实例
为了证明NF-κB-RE-Luc2P HEK293单克隆细胞系改造后可用于药物活性检测,将此细胞系感染FGFRⅡ受体,按照同样的单克隆筛选流程,使用Puromycin和Hygromycin加压培养,获得单克隆细胞 FGFR Ⅱ /NF-κB-RE-Luc2P HEK293。RT-QPCR检测FGFRⅡ mRNA表达水平,其表达水平显著高于对照组细胞,比值可达到204倍(204.2∶1)(图3-A),结果表明,FGFRⅡ成功导入到NF-κB-RELuc2P HEK293,并可稳定表达。
为了进步验证此细胞系的药物检测功能,选用FGF7类蛋白药物Palifermin®,梯度稀释后加入到此细胞系中,结果(图3-B)显示,响应值与Palifermin®浓度呈剂量依赖型S曲线,表明该细胞系可用于FGF7蛋白药物活性检测。

图2 NF-κB-RE-luc2P HEK293细胞系TNF-α刺激实验

图3 FGFR II/NF-κB-RE-Luc2P HEK293细胞系鉴定
3 讨论
随着生物技术药物的发展与检测手段的不断革新,荧光素酶报告基因法凭借其灵敏度高、简便可靠等技术优点越来越受业内关注,已逐渐成为药物筛选及体外活性检测的发展趋势。然而,针对不同生物靶点的药物筛选及药物活性检测,往往需要对其适配的工程细胞系进行单独构建或定制,人力、物力及时间成本投入较大。因此,在一定程度上具备通用性的细胞系就显得尤为必要。
NF-κB信号通路与机体免疫、炎症反应和细胞生长及分化紧密相关,以NF-κB及其信号通路为靶标的药物可用于肿瘤和炎症的预防与治疗。如NF-κB特异性抑制剂药物(Dehydroxymethylepoxyquinomicin,DHMEQ),在肺癌[10]、肝癌[11]、乳腺癌[12]和多发性骨髓瘤[13]的体内外研究中均取得了理想的研究结果,又如地塞米松、阿司匹林和舒林酸等抗炎药物,也是通过阻断NF-κB通路发挥其抗炎效果[14]。除此之外,NF-κB还广泛参与TNFR、FGFR、EGFR、NGFR、IL-1R和CD40等受体或受体家族的调节过程,是众多信号通路的交汇点[15-16],因此该细胞系在这类靶点相关药物的筛选及检测中,具备通用性。
细胞系构建及筛选是一个复杂而又繁琐的实验过程。在本研究中,以慢病毒为载体,携带目的基因进行感染HEK293,由于病毒感染的过程对细胞具有一定损伤作用,因此实验时必须保证HEK293维持在较好的细胞状态,如待用培养基必须37℃预热、病毒及SURE-entry的添加必须轻柔避免细胞脱落等。在单克隆筛选实验中,本研究采用的是有限稀释法进行分离培养,因此在克隆挑选时必须在细胞发生分裂前进行,此时细胞孔内仅有单个细胞,从而可以保证所获得的细胞系均为单一克隆。
在本研究中,以NF-κB-RE-Luc2P慢病毒为载体,经感染、抗生素加压与单克隆分离培养成功获得了NF-κB-RE-Luc2P单克隆细胞系,该细胞系可直接用于以TNF-α或其受体家族为靶点的药物筛选及活性检测,如类风湿性关节炎靶向治疗药物Humira®及其生物类似药等[17]。同时本研究还奠定了以NF-κBRE-Luc2P HEK293细胞系为基础,针对不同的研究需求继续进行改造和完善的方案,继续引入EGFR、FGFR、NGFR等受体,可用于后续的相关药物活性检测。如本研究成功导入了受体FGFRⅡ,获得了FGFRⅡ/NF-κB-RE-Luc2P HEK293细胞系,进行了体外FGF类药物验证实验,结果表明该细胞系可用于FGF类药物的活性检测。
4 结论
在本研究中,采用慢病毒感染方法成功构建了NF-κB-RE-Luc2P HEK293细胞系,该细胞系可直接用于以TNF-α或其受体家族为靶点的药物筛选及活性检测。同时,由于NF-κB还涉及EGFR、FGFR、NGFR、IL-1R和CD40等受体或受体家族介导的多条信号转导通路,以此细胞系为基础感染FGFR家族的受体FGFRⅡ,并进行了初步确证,结果表明响应值与药物Palifermin®呈现浓度依赖型“S”型曲线,可用于该类药物活性检测。综上所述,本研究成功获得了稳定表达的NF-κB-RE-Luc2P HEK293细胞系。由于NF-κB是细胞内多个信号转导通路的交汇点,因此该细胞系具备通用性及进一步改造的潜力,具有研究及应用价值。

