低温萘降解菌的筛选、鉴定及降解条件优化
郭亚男 张馨予 胥梦 王继华
(哈尔滨师范大学生命科学与技术学院,哈尔滨 150025)
多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)是一种具有两个或多个苯环的有机污染物,在环境中广泛存在[1]。主要来源于森林火灾、火山喷发或化石燃料的不完全燃烧[2-3]。由于PAHs具有低溶解度,高疏水性,高辛醇-水分配系数(KOW)和降解的顽固性等特性,使其在环境中积累到高水平,在我国东北污灌区、天津地区等部分地区土壤中均有检出[4-6]。迄今已发现200多种PAHs,美国环境保护署列举出16种优先修复的PAHs,萘为其中一种,萘因具有挥发性使它更容易与受体接触,导致患溶血性贫血、皮肤病、视网膜炎及细胞癌变等疾病[7-9]。土壤中的萘可被植物吸收,进入食物链,对人类健康和生态系统构成严重威胁[10]。微生物修复是一种治理环境污染的有效方法,与其他方法相比,经济、高效且无二次污染[11-13]。只要正确的利用微生物群体,它们便利用土壤中的萘作为碳源和能源进行生长,且细菌的运动能够为生物修复提供一种更快速、更均匀地降解萘的手段[14-16]。
根据文献调研,PAHs污染北方较南方严重,冬季PAHs的排放量大约是夏季的1.6倍[17]。国内城市土壤中的PAHs主要来源于高温燃烧源和石油源所构成的混合型污染[18]。我国北方年平均气温低于15℃,在此温度下许多最佳生长温度在20℃及以上的萘降解菌无法发挥其降解能力,而在15℃或以下恰恰是低温微生物的最适生长温度。因此,筛选对萘具有强降解能力的低温微生物是十分必要的。而北方土壤内的土著菌已长期适应了寒冷环境,因此筛选萘的低温降解菌,选择北方地区石油污染较严重的地区作为降解菌株的源土壤。大庆市,别称油城,是一座以石油、石化为支柱产业的著名工业城市。但是在开采过程中无法避免石油泄漏问题,由此产生萘污染的环境问题日益严重。并且该区域的日平均气温低于15℃,持续6-9个月。因此,研究从黑龙江省大庆油田地区污染土壤筛选能以萘为唯一碳源和能源的降解菌,研究降解菌在萘-无机盐培养基中对萘的降解情况;得到高效降解菌对其进行鉴定;对高效降解菌的生长条件进行优化;同时分析降解阶段其主控因素。旨为在低温条件下利用微生物修复技术治理PAHs污染提供优良菌株资源。
1 材料与方法
1.1 材料
1.1.1 样品采集 土样取自黑龙江省大庆市红岗区图强西街油田石油污染土壤表层(0-10 cm),地理坐标为:纬度46.522217,经度124.945595。采用五点采样法取样后带回实验室,过20 mm筛,保存于4℃冰箱。
1.1.2 主要培养基 LB液体培养基:蛋白胨10 g,酵母膏5 g,氯化钠10 g,蒸馏水1 000 mL,pH 7.0,1×105Pa灭菌20 min。LB固体培养基:蛋白胨10 g,酵母膏5 g,氯化钠10 g,琼脂15-20 g,蒸馏水1 000 mL,pH 7.0,1×105Pa灭菌20 min。牛肉膏蛋白胨培养基:牛肉膏3 g,蛋白胨10 g,氯化钠5 g,琼脂15-20 g,蒸馏水1 000 mL,pH 7.0-7.2,1×105Pa灭菌20 min。柠檬酸盐实验培养基:NH4H2PO41 g,K2HPO41 g,NaCl 5 g,MgSO40.2 g,柠檬酸钠 2 g,琼脂15-20 g,蒸馏水1 000 mL,1%溴香酚蓝乙醇溶液,10 mL,1×105Pa灭菌20 min。无机盐培养基:(NH4)2SO40.5 g,Na2HPO4·2H2O 3.5 g,MgCl2·6H2O 0.1 g,Ca(NO3)2·4H2O 0.05 g,KH2PO41 g,蒸馏水1 000 mL,1×105Pa灭菌20 min。萘-无机盐培养基:将萘溶解于正己烷溶液,待正己烷完全挥发,萘晶体析出后,加入预先灭菌的无机盐培养基均匀混合。
1.2 方法
1.2.1 低温降解菌驯化、分离及筛选方法 微生物的驯化过程是通过人为措施使得微生物逐步适应某种环境,最后获得具有较高耐受力和活力的菌株。萘对菌体有一定的毒害作用,最大污染物浓度驯化法使得能够适应该污染物浓度的菌株存活下来,并随着驯化的进行渐渐适应该环境而进行生长繁殖。取5 g土样装入含有200 mL萘-无机盐培养基(萘浓度200 mg/L)的锥形瓶中,10℃,120 r/min振荡培养,7 d后观察培养液变化。按体积10%的接种量转接到新鲜萘-无机盐培养基中,萘浓度增加至400 mg/L,此后,萘的质量浓度按600、800、1 000 mg/L逐步提升。吸取5代培养液采用稀释涂布法分离纯化,选择菌落生长较好的菌株在萘-无机盐固体培养基上划线复筛,-80℃甘油保存。
1.2.2 萘降解率的测定
1.2.2.1 菌悬液的制备 将所得菌株接入LB液体培养基中,10℃、120 r/min振荡培养,选择对数期菌株离心收集细菌(10 000 r/min,6 min),用无菌水重复冲洗3次,用无机盐培养基将菌悬液调节至所需菌浓度。
1.2.2.2 菌株对萘的降解 将所得菌株接入200 mL的萘-无机盐液体培养基(萘浓度为300 mg/L)中,在10℃、120 r/min下振荡培养,3个重复,设立不接菌液为对照组。24 h取样一次。取样吸取5 mL样品加入装有2 g氯化钠和5 mL正己烷溶液的离心管中,用旋涡混合器混匀2 min,离心(5 000 r/min,5 min),转移上清液正己烷层至玻璃小瓶中。再用5 mL正己烷重复上述萃取过程后,合并上清液用无水Na2SO4脱水,30℃旋转蒸发,氮吹1 mL以下,正己烷定容至1 mL,待测。
Agilent 7890/5975C-GC/MSD检测程序设定:进样口温度280℃,分流进样,载气:氦气(高纯),流量 1 μL/min(恒流),进样量 :1.0 μL,色谱柱DB5-MS(15 m×0.25 mm,0.1 μm),升温程序:80℃,保持2 min;以20℃/min升至180℃,保持5 min;再以10℃/min速率升至240℃,保持5 min。质谱条件:离子源温度、离子化能量、接口温度、四极杆温度分别为230℃、70 eV、280℃和150℃,溶剂延迟5 min,离子检测(SIM)模式。
1.2.2.3 萘的标准曲线 萘储备液按照梯度稀释,分别稀释配制成浓度为20 mg/L、40 mg/L、60 mg/L、80 mg/L和100 mg/L的溶液。用气相色谱-质谱法测定萘各浓度时对应的峰面积,以萘各梯度标准液浓度为X,对应的峰面积为Y,制作萘标准线Y=2613.9X-7146.4,标准曲线R2=0.999。
1.2.3 低温降解菌的鉴定
1.2.3.1 形态学观察及生理生化特征 所得菌株接种于牛肉膏蛋白胨培养基中,10℃培养7 d,在光学显微镜下观察细胞形态、菌体大小。生理生化实验结果参照鉴定手册[19]。
1.2.3.2 16S rDNA基因序列测定与系统进化关系的分析 利用细菌基因组提取试剂盒(HaiGene,B0135)提取细菌DNA,并利用引物8F(5′-AGAGTTTGATCCTGGCTCAG-3′) 和 1492R(5′-GGTTACCTTGTTACGACTT-3′)对细菌 16S rDNA基因进行PCR扩增。50 μL扩增体系为:DNA模板 2 μL,Super Taq DNA Polymerase 0.5 μL,10×Hi PCR Buffer 5.0 μL dNTP Mixture 4.0 μL,PCR Forward Primer(10 μmol/L) 和 PCR Reverse Primer(10 μmol/L)各 PCR Reverse Primer(10 μmol/L),ddH2O Up to 50 μL。PCR 扩增程序为:94℃ 5 min;94℃30 s;51℃ 1 min 30 s,72℃ 2 min 30 s,30 个循环 ;72℃ 10 min。经筛选后的菌株送至哈尔滨瑞博兴科生物技术有限公司完成16S rDNA测序工作。通过MEGA 7.0软件Alignment中的CLUSTAL W对目的序列和参考序列进行比对,根据比对结果选择Bootstrap test of phylogeny并用Neighbor-joining构建系统发育树。
1.2.4 降解菌生长曲线的测定 将所得菌株接入200 mL的LB液体培养基中,10℃、120 r/min振荡培养,4 h取样1次,3个重复,设立不接菌液为对照组(CK)。用UV759CRT紫外分光光度计测吸光值(OD600)表示菌株的生长量。
1.2.5 降解菌培养条件的优化 萘-无机盐液体培养基作为基础培养基,对萘浓度、培养温度、初始pH、培养转数进行单因素试验,测量菌液OD600。在单因素试验基础上,添加时间因素,按正交试验L18(35)五因素三水平共18组试验对菌株摇瓶培养条件进行优化,每组3个重复。
1.2.6 数据处理 利用 IBM SPSS Statistics 20.0 统计软件对实验结果进行统计学分析。
2 结果
2.1 低温萘降解菌的筛选
从黑龙江省大庆油田附近污染土壤中,采用污染物浓度驯化法进行菌株的驯化。在驯化后期以萘为唯一碳源(1 000 mg/L)富集体系中初筛,富集过程初始溶液为无色,从2 d开始有显色变化,变为橙色,颜色逐渐加深。富集体系结束后将富集液采用稀释涂布法涂LB培养基平板,选择菌落生长较好的菌株在萘-无机盐固体培养基中复筛,最终得到5株以萘为唯一碳源生长的低温菌株。
2.2 低温萘降解菌降解能力的结果与分析
对5株低温萘降解菌在萘-无机盐液体培养基(萘浓度300 mg/L)中培养10 d,萘的降解情况测定如图1所示。1号菌对萘污染物的毒性适应能力较强,呈匀速上升趋势,具有较好的降解能力。2号菌初期能较快降解萘,72 h之后降解速率下降,降解率增长缓慢。3号和4号菌各阶段降解趋势基本保持一致,相对于其他菌株具有更强的降解能力,降解速度从培养初期即开始上升,第1天至3天上升得最快,3 d后上升的速度减缓。与培养初期相比,4 d内在添加3号菌和4号菌的处理中,在对照组非生物因素影响基础上,萘的降解率达94.43%和95.47%,在耐受能力和降解速度方面具明显优势。5号菌相比较于其他菌株适应能力较慢,但经过一定时间后,降解率持续增加。根据不同菌株在低温条件下对萘的适应能力以及自身生长状况,最终选择3号和4号菌作为下一步研究对象进行研究。并将3号、4号菌命名为GN1和GN2。

图1 不同低温萘降解菌降解能力测定
2.3 低温萘降解菌的鉴定
采用形态观察及生理特性对GN1和GN2菌株初步鉴定,结果见表1。
菌株GN1和GN2系统发育树结果如图2所示。根据16S rDNA序列同源性比对,GN1和GN2皆与假单胞菌属(Pseudomonassp.)同源性最近,序列相似性均高达99%。综合菌株的形态观察、生理生化特性及16S rDNA序列比对分析,可确定GN1和GN2均属于假单胞菌属。GN1和GN2所测序列提交到GenBank数据库,获得序列登录号分别为MK208705和 MK208706。
2.4 低温萘降解菌的生长曲线
菌株GN1和GN2的生长曲线见图3,2株菌均适宜在LB液体培养基中生长,GN1、GN2从接种到第8小时细菌生长缓慢,延滞期较短;从8 h到60 h,细胞数量急剧增加,处于对数生长期;60 h后,随着培养基中各种物质的消耗,细菌细胞密度变化不大,细菌进入稳定期。其中GN1生物量略高于GN2。
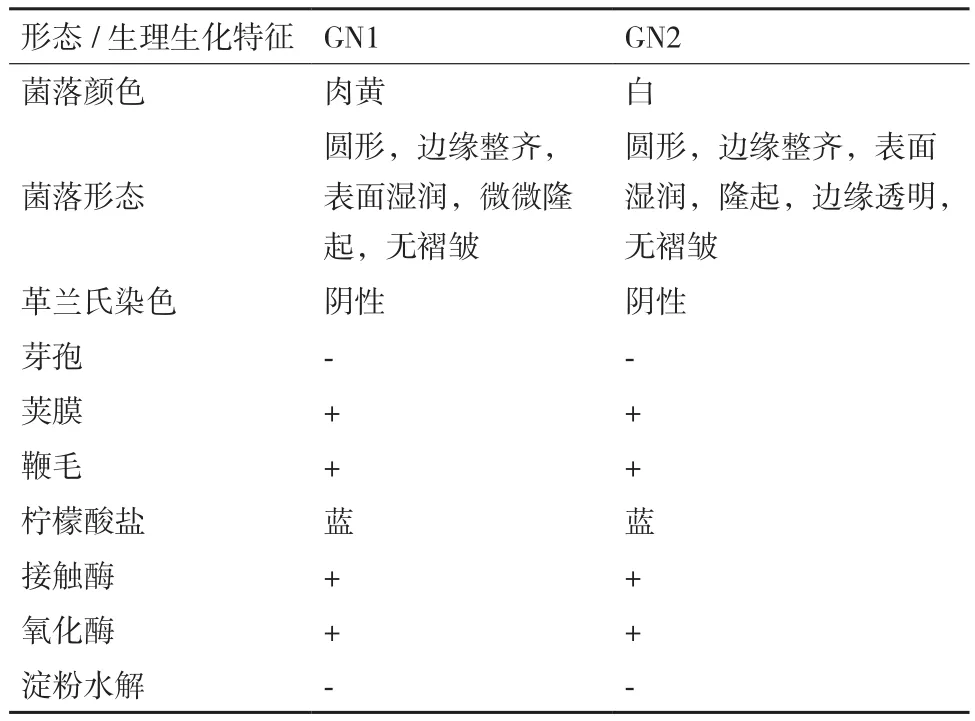
表1 GN1和GN2降解菌的形态及生理生化特征
2.5 菌株GN1和GN2培养条件优化
菌株GN1和GN2培养条件单因素优化,结果见图4。GN1和GN2最优单因素培养条件均为:萘-无机盐培养基(萘浓度300 mg/L),pH 7.0,培养温度10℃,培养转数120 r/min。
根据单因素试验结果,选择合适的因素和水平(表2),按正交试验L18(35)对菌株GN1、GN2摇瓶培养条件进行优化,所得数据应用SPSS 20.0进行方差分析,菌株GN1结果见表3。各因素各水平之间差异显著,说明各个因素之间具有交互作用,5个因素对菌株GN1生长影响的强弱顺序为:培养时间>培养转数>培养温度>初始pH>萘浓度。水平之间差异显著,进行多重比较,结合单因素统计量表(未给出)可得,GN1的最佳摇瓶培养条件组合为A3B3C1D3E3,即萘浓度300 mg/L,培养温度15℃,初始pH 6.0,培养转数180 r/min,培养时间7 d,在此条件下萘的去除率达到99.1%。菌株GN2结果见表4,同理,5个因素对菌株GN2生长影响的强弱顺序为:培养转数>培养温度>培养时间>初始pH>萘浓度,GN2的最佳摇瓶培养条件组合为A3B3C1D3E3,即萘浓度300 mg/L,培养温度15℃,初始pH 6.0,培养转数180 r/min,在此条件下,萘的去除率达到99.8%。

图2 基于16S rDNA基因序列同源性的GN1和GN2系统发育树
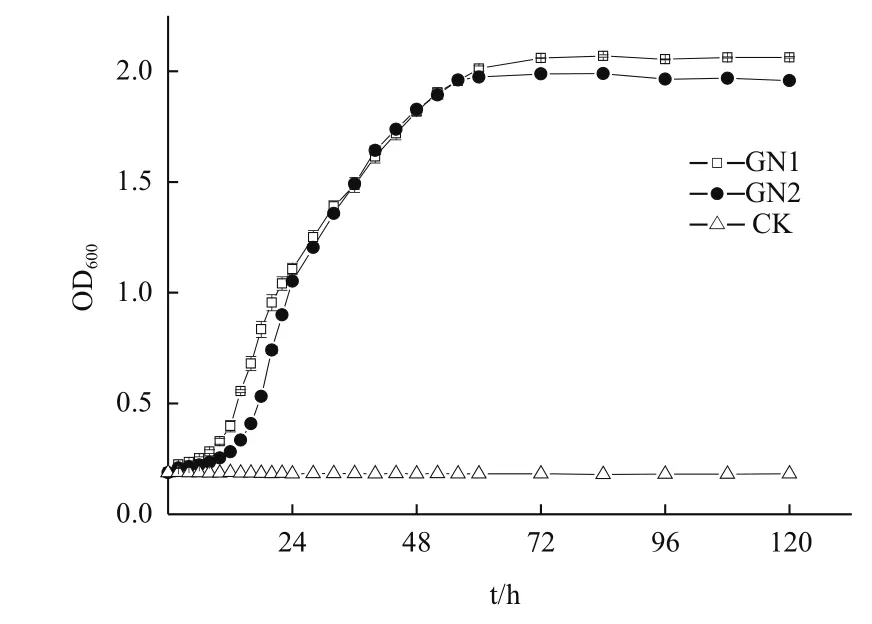
图3 降解菌株生长曲线

表2 正交试验环境因素和水平的设计

表3 GN1正交试验的方差分析

表4 GN2正交试验的方差分析
3 讨论
微生物修复技术已成为人们选择去除环境中萘的首要办法和手段,筛选出能够降解萘的菌株是该技术的关键环节[20]。大量研究表明多个菌属的细菌可对多数有机物进行降解,尤其是假单胞菌属,如孟建宇等[21]从乌梁素海水中筛选出一株假单胞菌,在10 d内可降解质量浓度为3.5 g/L的萘。但是目前研究多数萘的降解菌最适生长温度通常为25-37℃,低温萘降解菌的研究却鲜见报道。本研究对筛选出的低温萘降解菌测定其降解效率时发现,在未加菌液的对照组中,萘的浓度也有所降低,在控制其他环境因素(萘浓度、温度、pH和转数)一致的情况下,可能是由于在降解过程中体系不是完全的密闭以及在取样过程中的挥发所造成的;同时在降解过程中可能存在光化学降解,Bertilsson[22]对淡水中多环芳烃的光化学降解及其对细菌生长的影响-水化学的影响进行研究,结果发现:在实验期间,观察到存在光化学诱导所致的萘消耗,因此萘可能会发生光降解,此实验萘的光降解速率实验结果与本实验对照组中可能由于光降解产生的降解结果类似。综合这两方面,可能是本实验对照组降解率略高的原因。有关多环芳烃降解菌降解效率的研究,多数在实验中没有加入空白组对照,这可能也是日后研究需要关注的地方。在低温条件下GN1和GN2可以快速降解萘,在对照组非生物因素影响基础上,萘(300 mg/L)的降解率在4 d内达到94.43%和95.47%,在耐受能力和降解速度方面具明显优势。为低温条件下利用微生物修复技术治理PAHs污染提供了优良菌株资源,同时降解动态研究曲线也为菌株投入实际应用提供了时间参比。
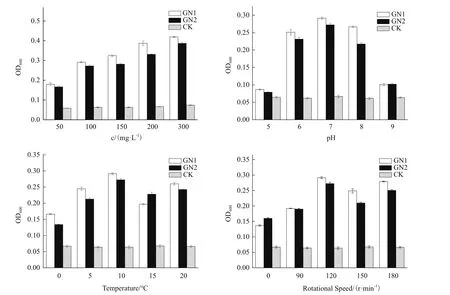
图4 不同培养条件对菌株GN1、GN2生长的影响
东北地区是我国重要的老工业基地之一,能源消耗较大,各类燃料的燃烧效率较低,且气候寒冷,取暖期漫长,常温菌无法发挥降解作用,由此产生的萘污染以及自然过程和人为过程导致土壤酸化问题日益严重[23-25]。在过去的20年中国土壤pH平均下降0.5个单位[26]。污染和酸化已成为土壤生态系统的两大威胁。本研究富集筛选出的菌株GN1、GN2能在低温(0-15℃)、偏酸(pH 6.0)和萘质量浓度为50-300 mg/L的条件中正常生长。因此,GN1、GN2菌具有较好的研究价值和应用前景。
正交试验设计(Orthogonal experimental design)是研究多因素多水平的一种设计方法。正交试验设计多用于培养条件的优化,如Qingmiao等[27]采用正交试验对E2降解菌降解条件进行优化,针对低温萘降解菌培养条件的优化,目前尚未见相关研究报道。本研究在低温萘降解菌单因素试验结果的基础上,利用正交试验设计对萘-无机盐培养基中萘浓度、培养温度、初始pH、培养转数、培养时间5个因素进行优化,所得数据应用SPSS 20.0进行方差分析。正交试验结果与单因素试验结果存在差异,因各因素之间存在着交互作用,正交试验结果更具有说服力,利用正交设计筛选组合结果可靠,方法可行。同时降解菌株的生长与五因素均有显著关系,利用正交试验分析影响萘降解的主控因素,在实际土壤萘污染治理过程中,依据环境因素,合理选择菌株并优化调控手段实现土壤萘污染高效修复。
4 结论
(1)从黑龙江省大庆油田地区污染土壤筛选出2株在低温条件下高效降解萘的菌株,编号为GN1和GN2。在对照组非生物因素影响基础上,萘(300 mg/L)的降解率在4 d内达到94.43%和95.47%,显示出在低温条件下较强降解萘的能力。(2)菌株GN1和GN2经形态观察、生理生化特性和16S rDNA基因序列鉴定皆属于假单胞菌属(Pseudomonas)。(3)菌株GN1和GN2的最佳培养条件均为:萘-无机盐培养基(萘浓度300 mg/L),培养温度15℃,初始pH 6.0,培养转数180 r/min,培养时间7 d,去除率分别达到99.1%和99.8%。(4)菌株的生长与五因素均有显著关系。在实际土壤萘污染治理过程中,依据菌株降解最适条件,优化调控手段实现土壤萘污染高效修复。

