海洋高产尿酸氧化酶菌株筛选鉴定及酶学性质研究
张庆芳 逄飞 于爽 肖景惠 窦少华 迟乃玉
(1. 大连大学生命科学与技术学院,大连 116622;2. 辽宁省海洋微生物生物工程技术研究中心,大连 116622)
尿酸(Uric acid)是鸟类、高等灵长类、蛇类、蜥蜴类等生物体嘌呤代谢的最终产物[1]。科学研究表明:当高等灵长类动物体内嘌呤代谢异常时,尿酸积累过多,将引发痛风、高血压[2]、心血管疾病[3]、糖尿病[4-5]、肾脏病[6]等多种疾病。因此尿酸水平可作为这些疾病发生的重要指标。检测血液中尿酸含量对高尿酸血症引起的相关疾病的治疗和诊断具有重要意义。常用检测尿酸的方法有酶法[7]、伏安法[8]、钨磷酸还原法[9]、高效液相色谱法。其中,酶法具有高灵敏度,操作相对简单快速的特点[7]。因此,开发一种来源广泛、成本低廉、酶学性质稳定的尿酸氧化酶试剂盒十分必要。
尿酸氧化酶(Uricase,Uric acid oxidase,EC.1.7.3.3),又称为尿酸酶,其是一种参与嘌呤降解途径的氧化酶[7,10],可快速将尿酸氧化成尿囊素近而排出体外[11]。尽管尿酸氧化酶在生物中广泛分布[12],但由于基因突变,使高等灵长类(人和猿类)生物中缺失尿酸氧化酶编码基因,导致其体内无法合成此酶[13-14]。当尿酸在体内积累,相关疾病接踵而来,尿酸氧化酶便是检测该类相关疾病的有效药物[15]。因此,尿酸诊断试剂盒的开发成为近年来的新兴热点。尿酸快速诊断试剂盒可对人体血清尿酸进行实时监测,及时控制尿酸水平,更加方便快捷准确的预防高尿酸血症的发生[16]。
尿酸氧化酶最早被Schittenhelm发现,来源于牛的肾脏[17]。随后,研究人员从微生物中发现了尿酸氧化酶,极大地丰富了尿酸氧化酶的来源[18]。现阶段,大多数的尿酸氧化酶菌株都是从土壤样品中筛选得到的[19-21],如黄曲霉(Aspergillus flavus)[22]、克劳氏芽孢杆菌(Bacillus clausii)[23]、产朊假丝酵母(Candida utilis)[24]、枯草芽孢杆菌 ZX(Bacillus subtilis)[25]、 微 杆 菌 属 ZZJ4-1(Microbacteriumsp.)[26]等。其中来源为曲霉的尿酸氧化酶已上市,但其产量及酶活较低,且价格昂贵。因此,开发新来源的尿酸氧化酶极为迫切。海洋是一个独特的生境,来源于海洋的尿酸氧化酶具有低温、高效性等应用优势。因此,本实验以黄海海泥海水为研究对象,筛选出稳定高酶活的低温尿酸氧化酶菌株,进行尿酸氧化酶的分离纯化以及其酶学性质初探,以期为尿酸氧化酶药剂、新型尿酸检测试剂盒的开发及其产业化提供菌种来源并奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 样品 大连黄海海域海泥、海水样品,取样深度5-20 m。
1.1.2 试剂 酵母膏提取物、牛肉膏提取物、蛋白胨、琼脂粉、葡萄糖、尿酸、牛血清白蛋白 生物工程(上海)股份有限公司;其他试剂均为国产分析纯。
1.1.3 培养基 富集培养基(g/L):尿酸5,酵母膏 0.5,NaCl 0.5,MgSO40.5,K2HPO42.0,KH2PO40.5,pH 7.5,121℃高压灭菌;初筛培养基(g/L):尿酸5,酵母膏0.5,NaCl 0.5,MgSO40.5,K2HPO42.0,KH2PO40.5,琼脂 15,pH 7.5,121℃高压灭菌;复筛培养基(g/L):尿酸5,酵母膏3,NaCl 0.1,MgSO40.5,K2HPO42.0,KH2PO40.5,pH 7.5,121℃高压灭菌;平板培养基(g/L):尿酸5,酵母膏3,NaCl 0.1,MgSO40.5,K2HPO42.0,KH2PO40.5,琼脂15,pH 7.5,121℃高压灭菌;发酵培养基:同复筛培养。
1.1.4 设备与仪器 CRY-2112 立式恒温摇床:上海茸研仪器有限公司;LTI-700 低温恒温培养箱:上海爱朗仪器有限公司;YXQ-75SII立式压力蒸汽灭菌器:上海博讯实业有限公司医疗设备厂;DK-600S 三用恒温水箱:上海精宏实验设备有限公司;SCIENTZ-650E超声波细胞粉碎机:宁波新芝生物科技股份有限公司;CR21N 高速冷冻离心机:株式会社日立制作所;Multiskan GO 全波长酶标仪:美国赛默飞世尔科技有限公司;Bio Log MicroStation III全自动微生物鉴定仪:美国Bio Log有限公司;FP-1100-C Bio screen全自动生长曲线分析仪芬兰Growth curves Ab Ltd公司;DHG-9070电热恒温鼓干燥箱:上海一恒科技有限公司。
1.2 方法
1.2.1 菌株筛选
1.2.1.1 初筛 准备若干个无菌100 mL三角瓶,并向其加入50 mL无菌生理盐水。将收集的海水、海泥(海泥2.0 g、海水2 mL各15份)样品加入三角瓶中,振荡混匀10 min,静置30 min。将2 mL样品溶液的上清液接种到富集培养基中,25℃、160 r/min恒温振荡培养3 d。同样的方法定向富集3次。将富集的菌液进行梯度稀释,分别涂布于初筛固体培养基上,25℃恒温培养3 d。随时观察菌落形态,及透明圈大小(菌落周围是否出现透明圈作为初筛标准)。选取出现透明圈的菌落用于进一步纯化,并保藏菌株用于后续实验。
1.2.1.2 复筛 将初筛菌株接种于200 mL/500 mL发酵培养基中,25℃、160 r/min恒温震荡培养36 h,测定尿酸氧化酶活性,并从初筛菌株中筛选出具有最高尿酸氧化酶活性的菌株。
1.2.2 菌株鉴定
1.2.2.1 形态学特征 平板点样法获得单菌落,观察单菌落形态。通过革兰氏染色法对菌体染色,并在光学显微镜(10×100)下观察。根据《伯杰氏系统细菌学手册》进行鉴定[27]。
1.2.2.2 生理生化特征通过 Biology微生物鉴定系统进行生长实验与化学敏感实验[28];部分生理生化鉴定参见《伯杰氏系统细菌学手册》[27]。
1.2.2.3 菌株分子生物学鉴定 将复筛得到的尿酸氧化酶高产菌株送交生工生物(上海)有限公司,对其16S rDNA进行测序,测序结果经BLAST比对,利用MEGA5软件构建系统发育树[29]。
1.2.3 粗酶液制备方法 将发酵液8000 r/min离心15 min,通过离心获得的湿菌经pH 8.5的硼酸缓冲溶液洗涤3次以上,直至发酵液洗净为止。将洗后的菌体悬浮在pH 8.5的硼酸缓冲溶液中,并在冰浴条件下超声波破碎,能量30%,每次破碎3 s,间隙3 s,破碎30 min。将菌体破碎液12 000 r/min离心15 min,上清液为粗酶液。
1.2.4 酶活测定方法 将粗酶溶液(0.1 mL)与含有2 mmol/L尿酸的0.6 mL硼酸钠缓冲液(pH 8.5,0.1 mol/L),0.15 mL 4-氨基安替比林(30 mmol/L),0.1 mL苯酚 1.5%,0.05 mL过氧化物酶(15 U/mL)加入到25 mL比色管中,25℃孵育10 min。然后通过加入1.0 mL乙醇终止反应,并用去离子水补足至20 mL。空白对照:将粗酶液替换为硼酸钠缓冲溶液。通过分光光度计读取540 nm处的吸光度[17]。酶单位定义为:在标准测定条件下每分钟可产生1.0μmol H2O2所需的酶量。
1.2.5 酶的分离纯化
1.2.5.1 盐析[30-31]取10 mL经破碎离心处理后的粗酶液分别加入到50 mL离心管中,根据硫酸铵饱和度表,将相应质量的硫酸铵加入离心管中,使硫酸铵饱和度达到30%-90%,将经处理过的粗酶溶液置于冰箱,4℃过夜,然后以12 000 r/min离心15 min,1 mL缓冲液进行溶解蛋白沉淀。
1.2.5.2 透析和超滤 将通过盐析获得的粗制酶液置于预处理好的透析袋中,并置于冰箱,4℃进行透析。将透析后的粗制酶液转移到10 kD超滤管中进行离心超滤。
1.2.5.3 Sephadex G-100凝胶过滤层析纯化尿酸氧化酶 Sephadex G-100凝胶柱(1.6 cm×60 cm)用10 mmol/L PBS(pH=7.4)平衡,2 mL超滤后酶溶液上样,以0.3 mL/min的流度加载;收集洗脱液每管1 mL直至无洗脱峰为止。记录每个管样品的A280并测定尿酸氧化酶活性。收集在280 nm处具有酶活的流分,冷冻干燥后在-20℃储存。
在上述各步骤中,均需测定尿酸氧化酶活性及蛋白质浓度,计算酶比活、回收率及纯化倍数。
1.2.5.4 SDS-PAGE电泳检测纯度 经上述纯化步骤得到的初步提纯的酶液,进行SDS-PAGE电泳,其中12%的分离凝胶,5%的浓缩凝胶,30 mA恒流电泳2.5 h,电泳凝胶经考马斯亮蓝R-250染色和脱色溶液脱色,分析实验结果。
1.2.6 酶学性质
1.2.6.1 酶最适作用温度 将初步提纯的酶液分别置于10-70℃(每隔5℃设定一个梯度),根据尿酸氧化酶的酶活力测定方法测定酶活性,并计算相对酶活性。
1.2.6.2 酶的热稳定性 将初步提纯的酶液置于20-50℃水浴(每10℃设定一个梯度),保温60 min。根据尿酸氧化酶活力测定方法,25℃下,每10 min测定尿酸氧化酶残留酶活性,并计算相对酶活性。
1.2.6.3 酶最适作用pH 在酶最适作用温度条件下,将初步提纯的酶液置于不同pH(4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0)的缓冲液中,测定尿酸氧化酶活性,并计算相对酶活性。
1.2.6.4 酶的pH稳定性 配制pH 5.0、6.0、7.0、8.0、9.0、10.0的缓冲液,分别将初步提纯的酶液置于其中,25℃孵育60 min,测定尿酸氧化酶酶活性,并计算相对酶活性。
1.2.6.5 化学试剂对酶活影响 在酶作用最佳条件下,酶液中加入 Fe3+、Ca2+、Na+、Mg2+、Ba2+、Cu2+、Zn2+、Mn2+、Ag+、Hg2+等金属盐离子,十二烷基硫酸钠(SDS)及乙二胺四乙酸(EDTA)等化学试剂,各反应体系中金属离子的最终浓度为10 mmol/L,测定尿酸氧化酶酶活性,并计算相对酶活性。
2 结果
2.1 菌株筛选
复筛过程中,得到一株高产尿酸氧化酶菌株,命名为 Z7,25℃下,其酶活约为12.1 U/mg,用甘油保藏法保藏于-20℃冰箱中,用于后续实验。
2.2 菌株鉴定
2.2.1 形态学特征 图1是菌株Z7菌落及细胞形态特征图。可见,菌落呈白色、圆形、不生孢子、不透明、边缘整齐,表面光滑湿润。另一方面,其微观形态呈杆状,为革兰氏阳性菌。
2.2.2 生理生化特征 本研究共测定了菌株 Z7 的103 项生理生化特性(表1),其中过氧化氢酶试验为阳性。可利用D-麦芽糖、蜜二糖、D-松二糖等44种碳源。易被抑制的化学物质有利福霉素SV、盐酸胍、硫酸四癸钠等15种。与模式株Bacillus fastidiosus的生理生化结果一致。
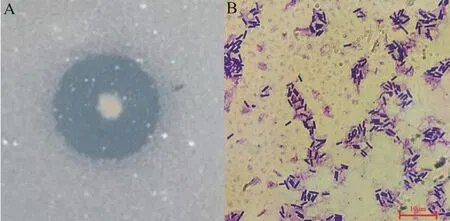
图1 菌株Z7菌落形态(A)及显微形态(B)(10×100)

表1 菌株Z7生理生化特征
2.2.3 16S rDNA基因序列分析与系统发育树构建 通过琼脂糖凝胶电泳分析菌株Z7 16S rDNA扩增产物。由图2可见,2泳道获得一条清晰条带,显示与Z7 16S rDNA基因序列大小相一致,序列长度为1 392 bp。将菌株Z7的16S rDNA序列输入美国国家生物技术信息中心(NCBI)数据库中,通过Nucleotide BLAST 与GenBank数据库中同源性最高的已知菌株序列进行比较。由MEGA 5以邻接法(Neighbor-Joining,NJ)构建的系统发育树(图3)。由图3可知,菌株Z7与苛求芽孢杆菌Bacillus fastidiosus(NR 113989.1)同源性最高为99%,因此可以鉴定菌株Z7为苛求芽孢杆菌(Bacillus fastidiosus)。
2.3 尿酸氧化酶分离纯化
2.3.1 Sephadex G-100凝胶过滤层析纯化尿酸氧化酶 海洋低温尿酸氧化酶粗酶溶液经饱和硫酸铵盐析,确定最佳硫酸铵盐析浓度为75%;将其通过Sephadex G-100凝胶过滤层析进一步纯化。随着洗脱过程的进行,洗脱液在 280 nm处吸收值和尿酸氧化酶活力的变化见图4。酶活力曲线(箭头)显示尿酸氧化酶组分主要在第17管被洗脱下来,约在33管时被完全洗脱,表明在出现该吸收峰的时间段内收集的样品为尿酸氧化酶产品。
2.3.2 尿酸氧化酶分离纯化结果 结果表明:硫酸铵沉淀、透析超滤和Sephadex G-100凝胶过滤层析纯化后,大部分蛋白质被除去,获得从苛求芽孢杆菌中初步提纯的酶液尿酸氧化酶产品,酶活力为35.3 U,酶比活达 673.7 U/mg,纯化倍数达15.6倍,酶活回收率达4.5%(表2)。SDS-PAGE电泳显示,纯化后尿酸氧化酶为单一蛋白条带,表明其为单一尿酸氧化酶纯品,分子量约为 33.1 kD(图 5)。
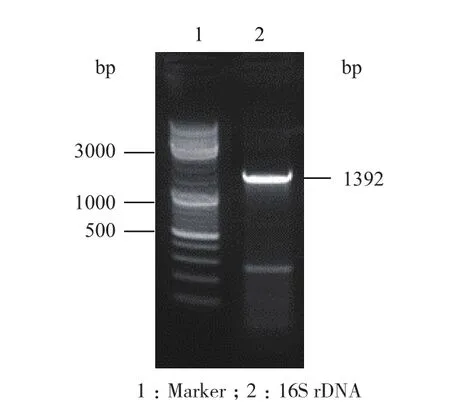
图2 菌株Z7 16S rDNA序列及图谱
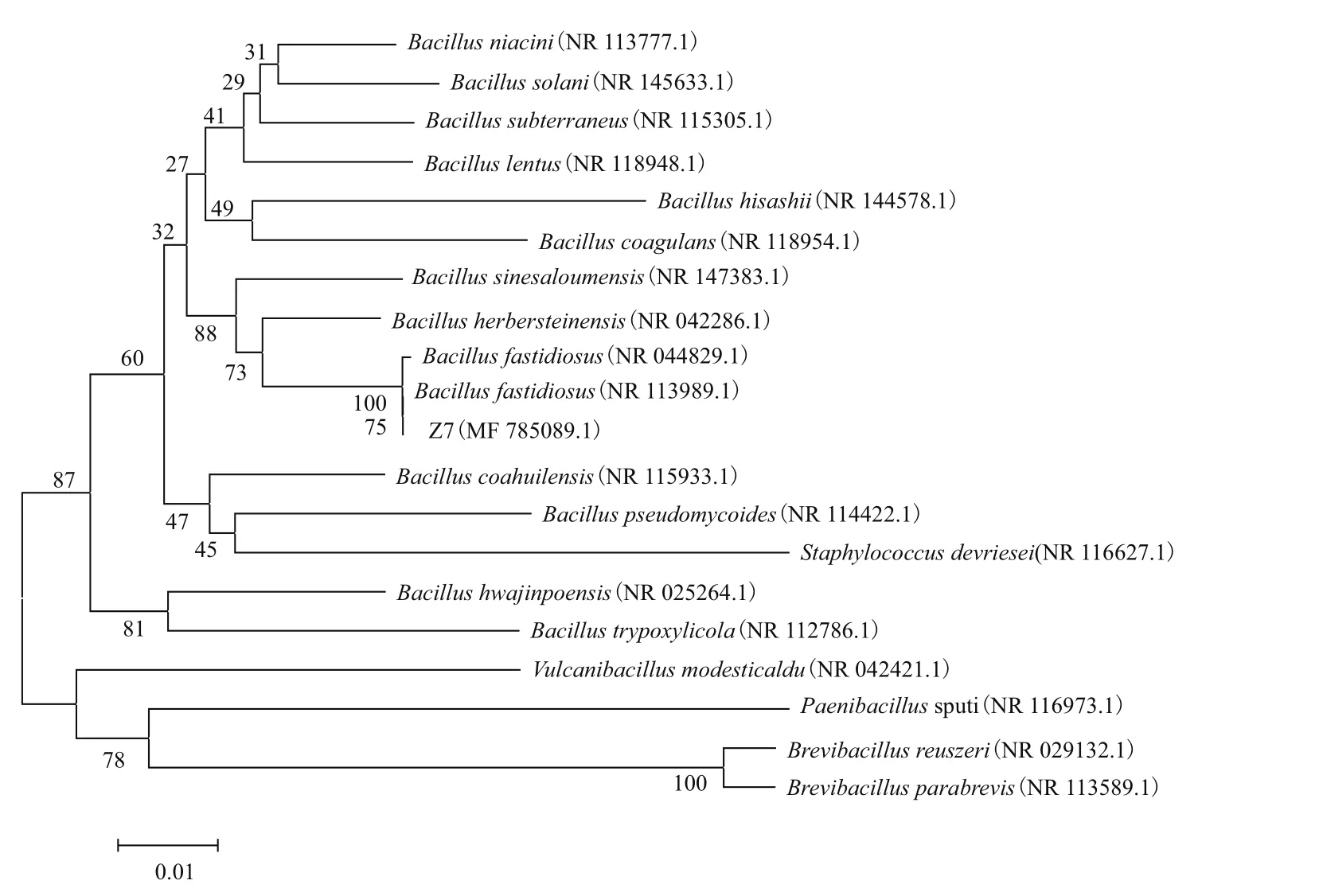
图3 菌株Z7 16S rDNA基因序列系统发育树
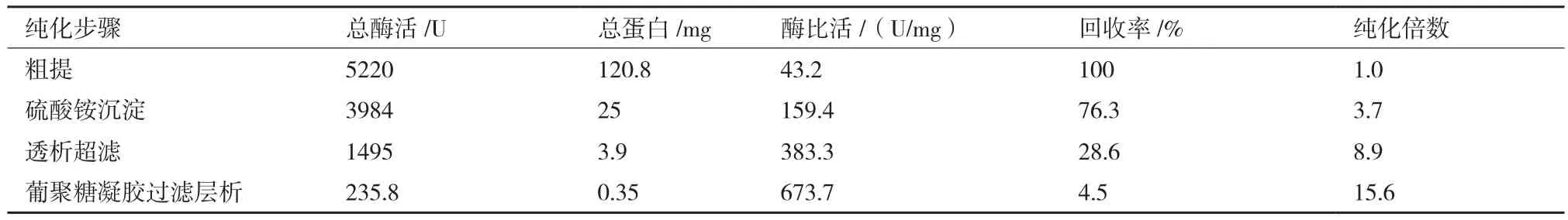
表2 尿酸氧化酶分离纯化结果
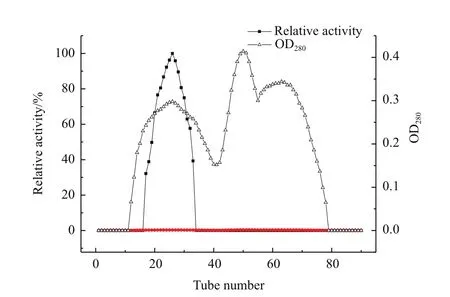
图4 Sephadex G-100凝胶过滤层析
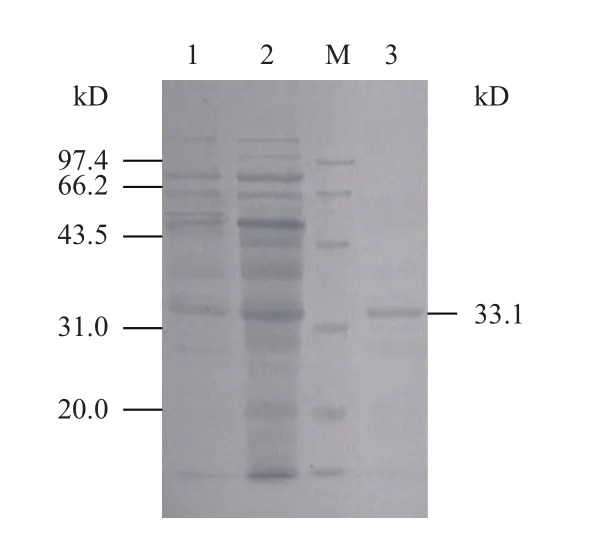
图5 SDS-PAGE电泳结果
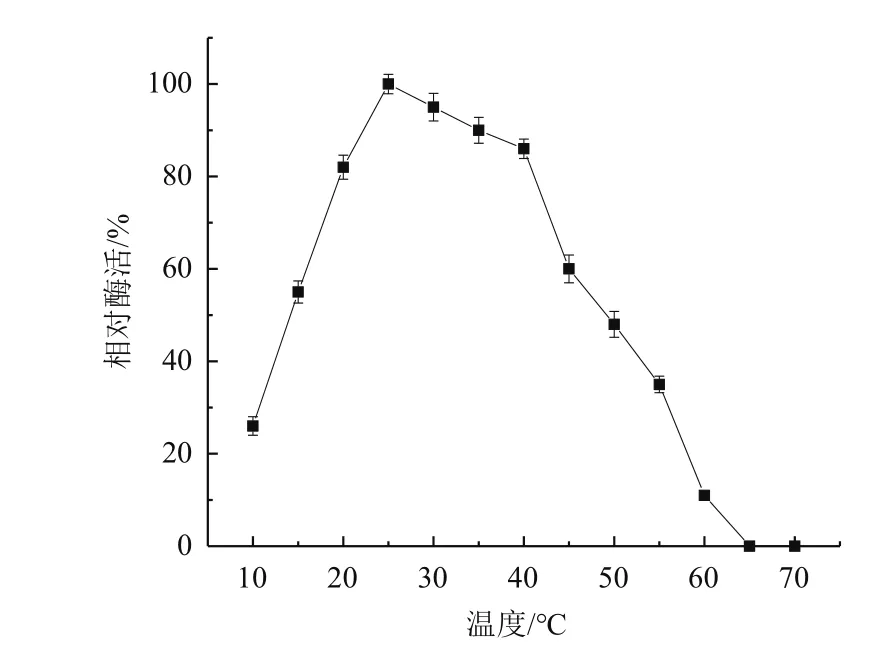
图6 尿酸氧化酶的最适作用温度曲线
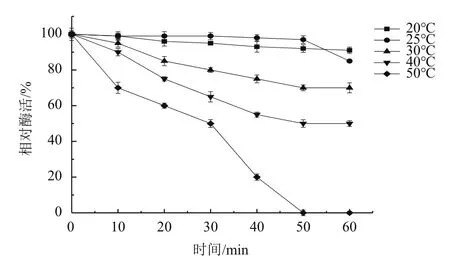
图7 酶的热稳定性
2.4 酶学性质
2.4.1 酶最适作用温度 如图6所示,25℃ 为尿酸氧化酶的最适反应温度,当温度上升至45℃ 时,尿酸氧化酶的酶活性急剧下降,但是尿酸氧化酶在10℃ 仍保留20%以上的酶活性,说明尿酸氧化酶带有低温酶特征。
2.4.2 酶的热稳定性 由图7可知,该尿酸氧化酶在20-30℃作用60 min后能保持较高酶活,说明其活性相对稳定;虽然20℃酶活性略低于25℃,但其稳定性优于后者,说明该酶在低温环境活性更加稳定,符合低温酶特征。从50℃开始,酶活急剧下降;50℃处理1 h,酶活基本为0。该尿酸氧化酶在高温环境下稳定性差。
2.4.3 酶最适作用pH 由图8可知,该酶在pH 7.0-4.0时酶活迅速下降,在pH 8.0时酶活性最高,酶活性在pH 8.0-10.0时略有下降,说明尿酸氧化酶的最适酶促反应pH为8.0,该酶属于碱性酶。
2.4.4 酶的pH稳定性 图9可以看出,在pH 8.0缓冲溶液中作用60 min后的尿酸氧化酶活性基本没有损失。当缓冲液pH高于8.0时,酶活性开始下降。该酶在pH 8.0、9.0的缓冲液作用60 min还能保留80% 的相对活性,并且在pH 10.0时也保持50% 的相对活性。然而,该酶在pH 5.0和6.0时活性迅速降低,表明该酶是碱性酶。
2.4.5 化学试剂对酶活影响 由表3可知,Ag+、Hg2+对该酶抑制性较强,使尿酸氧化酶几乎丧失活性。SDS对该酶抑制有一定的作用。Fe3+、Ca2+对该酶具有激活作用。Na+、Mg2+、Ba2+、Cu2+、Zn2+、Mn2+、EDTA对该酶几乎没有影响。
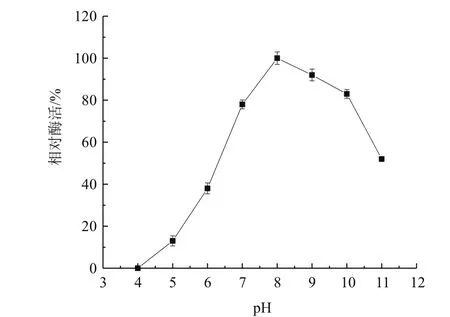
图8 pH对尿酸氧化酶的影响
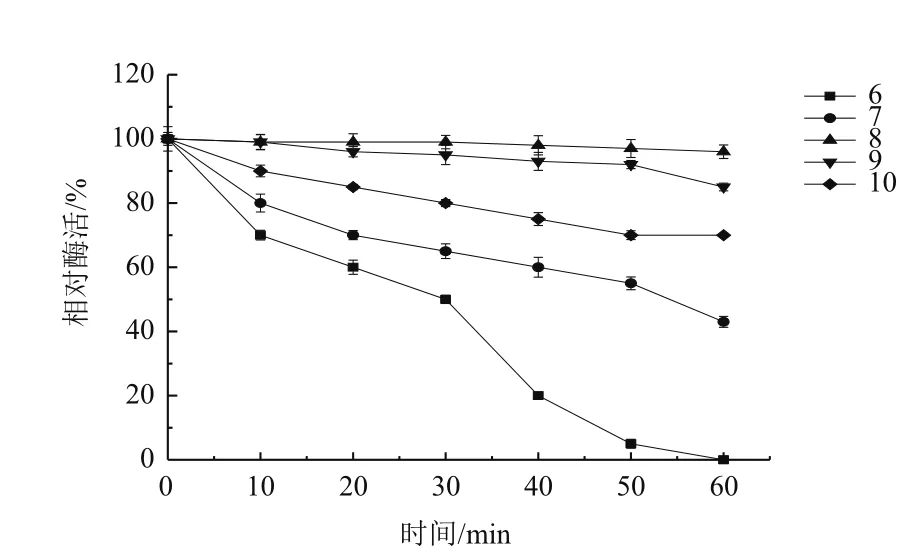
图9 pH对尿酸氧化酶稳定性的影响
3 讨论
国内外已报道了诸多微生物来源的尿酸氧化酶的分离和纯化,其中大部分是胞内酶[32]。在国外,Wang等[33]在1980年研究报道了链霉菌属产生的尿酸氧化酶的分离纯化,尿酸氧化酶纯度提高1 000倍。Lucas等[34]在1983年分离纯化了由根瘤菌产生的尿酸氧化酶,其最适pH为9.5,属于嗜碱酶。Shaaban等[12]在2015年对127株铜绿假单胞菌株进行尿酸氧化酶酶活测定,筛选出酶活最高菌株,命名为PS43。将PS43菌株的尿酸氧化酶基因克隆表达,发现工程菌酶比活比野生菌提高了51倍。在国内,孟尧等[35]于2006年对朊圆酵母产尿酸氧化酶进行纯化,研究发现该酶具有较高的热稳定性和酸碱稳定性。姚明明等[36]于2007年报道了利用双水相萃取的技术分离尿酸氧化酶,酶回收率大幅度提高。2008年,武文明等[37]研究了假丝酵母中尿酸氧化酶的纯化及其部分酶学性质。综上所述,研究人员已经对很多来源的尿酸氧化酶进行了分离纯化,其中一些尿酸氧化酶已经形成了蛋白结晶。目前,这些酶的分离和纯化均在实验室中小规模制备,生产成本非常昂贵,不适合用于大规模生产。
因为尿酸氧化酶商品相对昂贵,且目前商业酶的稳定性和活性均不理想,因此,国内临床使用尿酸氧化酶试剂盒主要依赖进口,国产尿酸氧化酶试剂盒应用较少。本研究为丰富我国的医药市场、摆脱我国对尿酸氧化酶依赖于进口这一现状提供了有力的技术支持,也为尿酸氧化酶试剂盒的进一步开发奠定了理论基础。
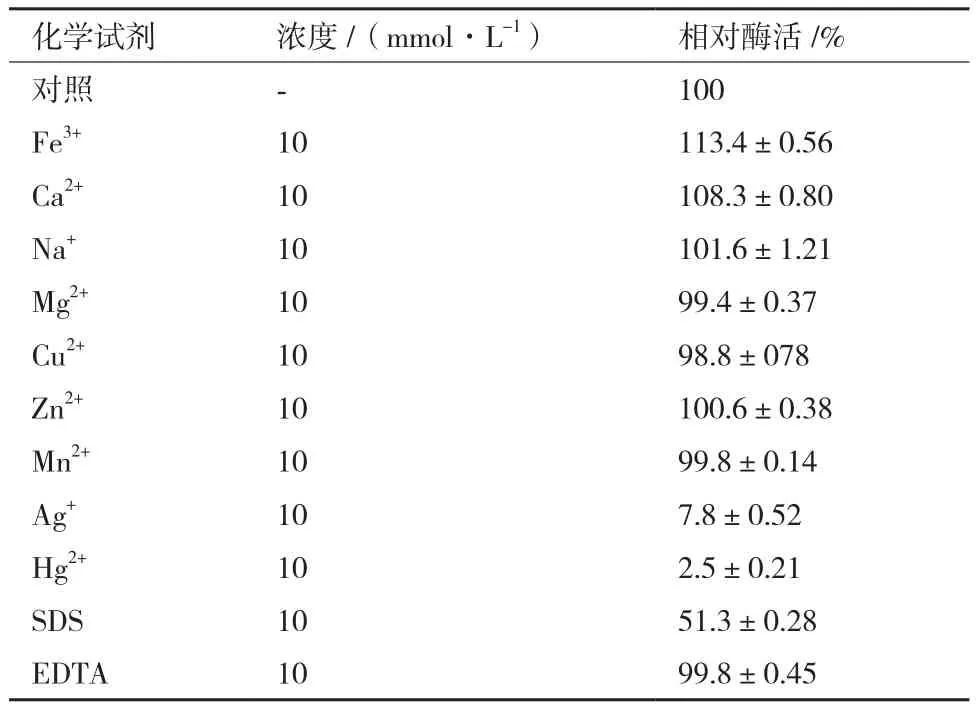
表3 金属离子与化学试剂对尿酸氧化酶酶活的影响
4 结论
本实验从大连黄海海泥、海水中筛选1株高产尿酸氧化酶菌株Z7。分别通过形态学、生理生化和16S rDNA序列鉴定与分析,确定该菌株为苛求芽孢杆菌(Bacillus fastidiosus)。依次采用硫酸铵盐析、透析、超滤和Sephadex G-100凝胶过滤层析对菌株Z7所产尿酸氧化酶进行分离纯化,并对其部分性质进行初步研究。结论可知,菌株Z7产生的尿酸氧化酶分子量约为33.1 kD,酶比活为673.7 U/mg,纯化倍数为15.6,酶活回收率达4.5%。进一步研究发现,其最适作用温度为30℃,最适pH为8.0。另外,Fe3+、Ca2+对尿酸氧化酶具有激活作用,Ag+、Hg2+对该酶具有抑制作用,该菌株产酶活性及稳定性良好,可为尿酸氧化酶的工业化生产奠定理论基础。

