绵羊miRNA-411a与其靶基因FLT3的相互作用
张梦丹,刘 莉,徐越仁,李慧向,倪 伟,李 刚
(石河子大学 生命科学学院,新疆石河子 832000)
miRNAs是一类长约22nt的非编码单链小RNA分子,广泛存在于人类及其他各种真核生物中,它们可以直接通过与靶mRNA特异性的碱基互补配对引起靶mRNA降解或抑制其翻译,或者间接影响转录因子的甲基化,从而调节基因的转录后表达水平。自1993年miRNAs被发现后,迅速成为当前人们研究的热点。研究表明,miRNA在生物体内发挥着重要作用[1],它主要是与靶基因3′UTR结合[2-3],调节靶基因的表达,从而调节基因的转录后表达水平,影响相应的蛋白合成,对生物体的正常功能产生影响。
最近,通过对miRNAs的研究,大量试验证实miRNAs的表达与否及表达量的变化与哮喘[4]、慢性阻塞性肺炎、囊性纤维化[5]、特发性肺纤维化[6]等几种肺部疾病相关,绵羊支原体肺炎的病理特征与这些疾病类似,但在绵羊支原体肺炎方面的相关研究甚少。
支原体肺炎引起的绵羊慢性呼吸道疾病给养殖业带来巨大的损失,感染其病可降低绵羊的免疫力,造成较高的患病率及死亡率[7-8]。目前的防治措施主要是注射疫苗和抗生素。虽然疫苗可以降低发病率,但不能降低支原体的定植,且不能阻止支原体的感染;而长期使用抗生素会产生耐药性,并且会有药物残留。因此,初步探讨miR-411a与FLT3基因的相互作用,为进一步研究相关miRNAs及其靶基因在绵羊支原体肺炎中的调控作用奠定基础。
1 材料与方法
1.1 样品、细胞系和载体
动物样品采自沙湾县屠宰场;293T细胞系由上海丰寿生物科技有限公司提供;表达载体pcDNA 3.1(+)由优宝生物科技有限公司提供;表达载体pMIR-Report Luciferase由Thermo Fisher Scientific公司提供。
1.2 主要试剂
琼脂糖、胰蛋白胨、酵母提取物、NaCl、氨苄西林、青链霉素、DMEM、opti-MEM、胰蛋白酶、胎牛血清、Trizol,均由生工生物工程(上海)有限公司提供。无内毒素质粒提取试剂盒由北京康为世纪生物科技有限公司提供。PCR引物由北京睿博兴科生物技术有限公司合成。
1.3 方法
1.3.1 miR-411a和靶基因的预测与分析 用TargetScan、miRDB和二级结构预测软件(http://rna.urmc.rochester.edu/RNAstructureWeb/index.html)等生物信息学软件预测miRNA的靶基因,分析miR-411a与FLT33′UTR的碱基配对情况、二者结合形成的双链二级结构和靶序列在不同物种间的保守性等。
1.3.2 绵羊基因组DNA的获取 剪取绵羊肌肉组织,使用基因组DNA提取试剂盒提取肌肉组织的基因组DNA。通过Nanodrop1000对提取的基因组DNA进行OD值(260/280)检测。
1.3.3 miR-411a引物合成和基因的克隆 查找绵羊miR-411a基因的成熟序列(oar-mir-411a MI0016918),截取前体序列及其左右侧翼各200 bp的序列,设计特异性引物,并在引物5′端添加HindⅢ和EcoRⅠ酶切位点。引物序列见表1(划线部分为酶切位点)。
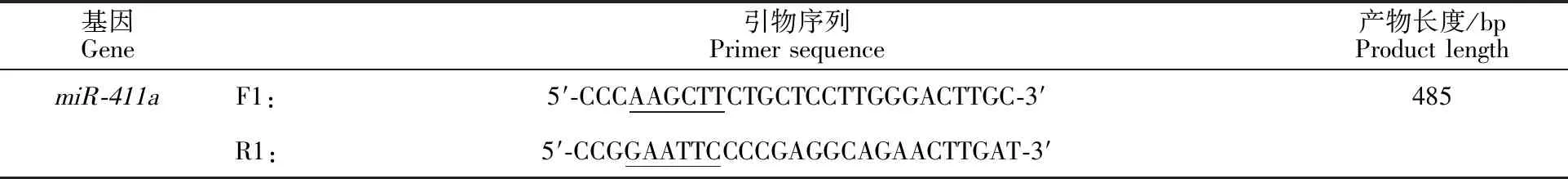
表1 绵羊 miR-411a基因PCR引物序列Table 1 PCR primer sequence of sheep miR-411a gene
PCR反应体系(20 μL):2×TaqPCR MasterMix 10 μL,上游和下游引物(10 pmol/μL)各0.5 μL,DNA模板(20 ng/μL) 2 μL,加ddH2O至20 μL。PCR反应条件: 94 ℃预变性3 min;94 ℃ 30 s,65 ℃ 20 s,72 ℃ 30 s,共30个循环; 72 ℃ 延伸2 min,4 ℃保存。PCR产物采用20 g/L脂糖凝胶电泳检测。
1.3.4FLT3基因的引物合成及克隆 根据NCBI数据库中发布的绵羊FLT3基因序列(登录号为NC_019467),利用Primer 5.0设计引物,并在引物的5′端添加SacⅠ和HindⅢ酶切位点。引物序列见表2,划线部分为酶切位点。
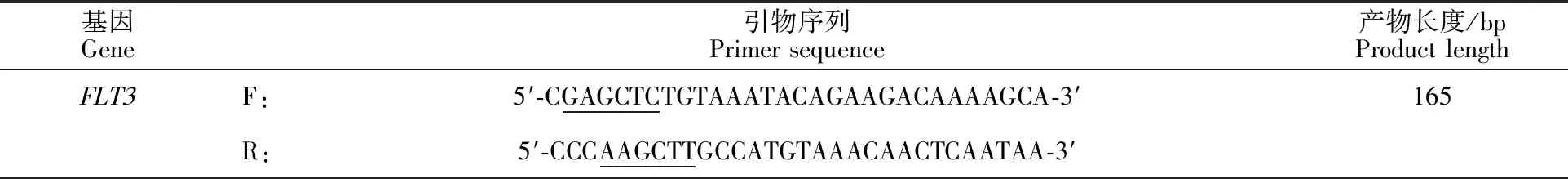
表2 绵羊 FLT3基因PCR引物序列Table 2 PCR primer sequences for sheep FLT3 gene
PCR反应体系(20 μL):2×TaqPCR MasterMix 10 μL,上游和下游引物(10 pmol/μL)各0.5 μL,DNA模板(20 ng/μL) 2 μL,加ddH2O至20 μL。PCR反应条件:94 ℃预变性3 min; 94 ℃ 15 s,60 ℃ 15 s,72 ℃ 8 s,共35个循环; 72 ℃ 延伸2 min,4 ℃保存。PCR产物采用20 g/L琼脂糖凝胶电泳检测。
利用TANGEN琼脂糖凝胶回收试剂盒对miR-411a和FLT3的PCR产物进行纯化回收。
1.3.5 pcDNA3.1-411a重组载体的构建 分别对提取的miR-411a基因和pcDNA3.1(+)质粒用HindⅢ和EcoRⅠ进行双酶切,放于37 ℃水浴锅中,酶切体系(总体积为20 μL):2 μL 10×Q Buffer,1 μLHind Ⅲ,1 μLEcoRⅠ,6 μL miR-411a(pcDNA3.1(+)),用ddH2O补足至20 μL。用DNA纯化试剂盒纯化miR-411a基因酶切产物,用琼脂糖凝胶DNA回收试剂盒回收pcDNA3.1(+)酶切产物。加入SolutionⅠ,16 ℃过夜连接miR-411a和pcDNA3.1(+),连接体系(总体积为10 μL):5 μL Solution I,2.5 μL miR-411a,2.5 μL pcDNA3.1(+)。将连接产物转化至大肠杆菌DH5α感受态细胞中,菌液PCR和测序验证重组质粒。
1.3.6 pMIR-RL-FLT3重组质粒的构建 用SacⅠ和Hind Ⅲ 于37 ℃水浴中分别对提取的FLT3基因和pMIR-RL进行双酶切,其余方法同“1.3.5”。重组质粒pMIR-RL-FLT3构建成功后,按照说明书使用无内毒素质粒大提试剂盒进行重组质粒提取。
1.3.7 细胞培养及细胞转染 将在液氮中冻存的293T细胞接种到含有生长培养液(DMEM+10%FBS+1%双抗)的3.5 cm细胞培养板中,放置于37 ℃、体积分数为5% 的 CO2培养箱中培养,待细胞长至80%时,进行转染。转染前2 h,弃去培养液,用PBS清洗3遍,并将培养液换成Opti-MEM无血清培养基,放置37 ℃、体积分数为5% 的CO2培养箱中继续培养。将4 μL表达载体pcDNA 3.1-411a+GFP(绿色荧光蛋白基因质粒)和Lipofectamine 2000分别与50 μL的Opti-MEM混匀,室温条件下孵育5 min;之后将pcDNA 3.1-411a+GFP混合液与Lipofectamine 2000混合液混匀,室温条件下孵育20 min;将混合液分别滴加至细胞板的每个孔中,并以“∞“型混匀混合液与培养液,在37 ℃、体积分数为5% 的 CO2培养箱中培养;其中转染pcDNA 3.1(+)空载体质粒的为对照组。6 h后将培养液更换成生长培养液,继续培养。24 h后观察荧光。
1.3.8 RT-PCR检测miR-411a和FLT3基因的表达量 使用293T-β-actin作为内参基因,查阅文献设计β-actin引物。使用茎环法设计miR-411a的反转录引物及上下游引物。引物信息见表3。
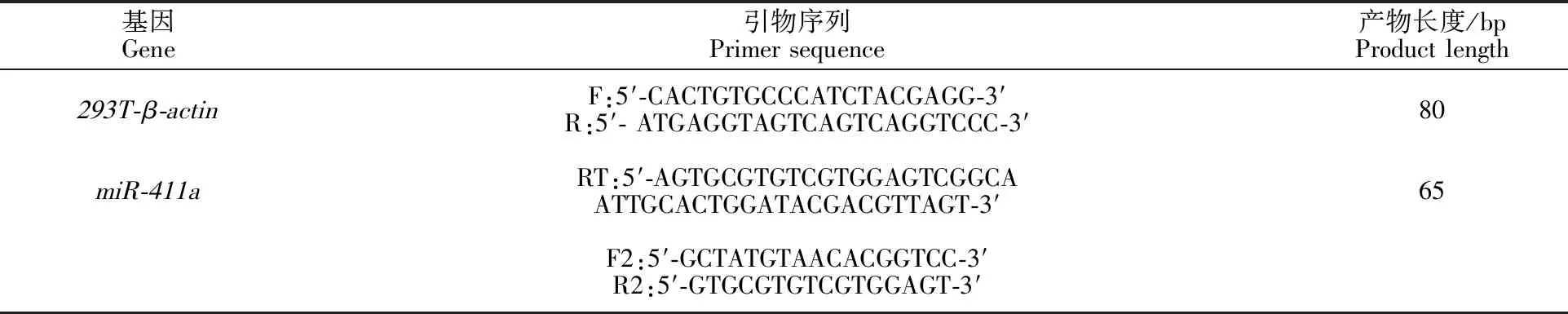
表3 293T-β-actin和miR-411a的RT-PCR引物序列Table 3 RT-PCR primer sequences for 293T-β-actin and miR-411a
收集转染24 h后的细胞,利用超纯RNA提取试剂盒提取细胞总RNA,并用TAKARA PrimeScript RT Reagent反转录试剂盒反转录合成cDNA, cDNA合成体系(总体积为10 μL):2 μL 5×PrimerScript Buffer,0.5 μL PrimeScript RT Enzyme Mix×1,0.5 μL Random 6 mers,0.5 μL RT Primer,6.5 μL总RNA,通过PCR检测基因的表达,采用RT-PCR检测miR-411a和FLT3基因的表达量。
1.3.9 双荧光素酶报告基因的检测 转染方法同“1.3.7”,将转染的GFP基因质粒换为pRL-TK(pMIR-REPORTTM Luciferase,海肾荧光素酶报告基因质粒),转染36 h后,用PBS清洗3遍细胞,加入细胞裂解液,在摇床上震荡10 min后,收集至离心管中,12 000 r/min离心10 min后,吸取上清,得到细胞裂解物。用TransDetect Double-Luciferase Reporter Assay Kit进行双荧光素酶活性检测。提前30 min开启化学发光仪,将100 μL Luciferase Reaction Reagent加入白色的96孔板中,吸取20 μL细胞裂解物,检测萤火虫荧光素酶报告基因的活性。再加入100 μL Luciferase Reaction Reagent Ⅱ,充分混匀,检测海肾荧光素酶报告基因的活性。计算方法:相对荧光素酶活性=萤火虫荧光素酶报告基因的活性/海肾荧光素酶报告基因的活性。
2 结果与分析
2.1 miR-411a和靶基因的预测与分析
预测得知靶序列FLT33′UTR与miR-411a序列互补配对(图1-A),二者形成的RNA双链自由能为-4.89 kJ/mol(图1-B),靶序列FLT3在不同物种间高度保守(图1-C),以上结果表明FLT33′UTR与miR-411a具有相互作用。
2.2 miR-411a与FLT3基因的克隆
分别对miR-411a和FLT3基因进行PCR扩增,产物经20 g/L琼脂糖凝胶电泳检测,可观察到约485 bp和165 bp处有清晰的条带(图2)。
2.3 pcDNA3.1-411a和pMIR-RL- FLT3表达载体的酶切验证及测序验证
提取pcDNA3.1-411a质粒,对重组质粒用Hind Ⅲ和EcoRⅠ进行双酶切,并经10 g/L琼脂糖凝胶电泳检测,观察到在5 428 bp和485 bp处都有单一清晰条带,说明411a基因片段成功连接到真核表达载体pcDNA3.1(+)上,结果见图3-A。同时提取pMIR-RL-FLT3质粒,酶切方法同上,观察到在6 479 bp和165 bp处都有单一清晰条带,说明FLT3基因片段也成功连接到表达载体上,结果见图3-B。利用DNAMAN软件将测序结果与已知基因序列进行比对,结果显示,测序所得的序列与参考序列完全一致,说明无碱基突变。

A.FLT33′UTR与miR-411a序列碱基互补配对FLT33′UTR is complementary to the miR-411a sequence; B.FLT33′UTR与miR-411a形成双链RNA的二级结构(自由能:-4.89 kJ/mol)FLT33′UTR and miR-411a form the secondary structure of double-stranded RNA (free energy: -4.89 kJ/mol); C.FLT3靶序列在常见物种间的保守性FLT3target sequence conservative between common species
图1 miR-411a和靶基因的生物信息学分析
Fig.1 Bioinformatics analysis of miR-411a and target genes

A:M.DL1000 DNA marker; D.阴性对照 Negative control;1.miR-411a
B:M.DL500 DNA marker; D.阴性对照 Negative control;1.FLT3
图2 miR-411a和FLT3基因的克隆结果
Fig.2 Cloning results of miR-411a andFLT3genes

A:M.DL10000 DNA marker; 1.重组质粒对照 Recombinant plasmid control;2.pcDNA3.1+411a
B:M.DL500 DNA marker;1.重组质粒对照 Recombinant plasmid control;2.pMIR-RL+FLT3
图3 重组质粒酶切验证结果
Fig.3 Recombinant plasmid digestion results
2.4 过量表达载体pcDNA3.1-411a的真核表达
将过量表达载体pcDNA3.1-411a+GFP转染至293T细胞24 h后,在荧光显微镜下可以观察到绿色荧光,表明过量表达载体在293T细胞中成功表达,结果见图4。
2.5 miR-411a和 FLT3基因的RT-PCR分析
提取转染24 h后细胞总RNA,并进行RT-PCR,结果显示所需基因都正常表达且大小正确,内参基因使用β-actin,结果见图5。
2.6 qPCR验证miR-411a过量表达以及miR-411a与 FLT3的相互作用
与对照组相比,试验组pcDN A3.1-miR-411a的表达量极显著上调(P<0.01),说明miR-411a过量表达载体的表达效果较好,如图6-A;过量表达miR-411a后,其靶基因FLT3mRNA的表达量极显著下调(P<0.01),说明过量表达miR-411a能显著抑制FLT3mRNA的表达量,如图6-B,表明FLT3是miR-411a的靶基因,且miR-411a对靶基因FLT3的表达存在抑制作用。

图4 质粒转染293T细胞荧光观察(4×)Fig.4 Fluorescence observation of plasmid transfected 293T cells (4×)
2.7 双荧光素酶报告基因检测miR-411a与 FLT3的相互作用
由图7可以看出,与对照组相比,过量表达miR-411a的试验组显著抑制FLT3双荧光素酶报告基因的表达(P<0.01),结果验证FLT3是miR-411a的靶基因。

M.50 bp DNA Ladder;1.阴性对照 Negative control; 2.β-actin;3.miR-411a; 4.FLT3
图5 RT-PCR电泳结果
Fig.5 RT-PCR results
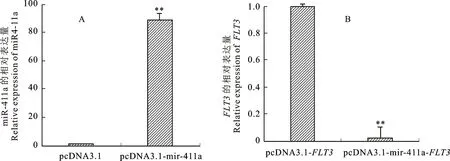
A.miR-411a过量表达载体效率 miR-411a overexpression vector efficiency; B.miR-411a过量表达后FLT3mRNA的相对表达量 Relative expression ofFLT3mRNA after overexpression of B miR-411a;**表示差异极显著(P<0.01) ** indicates a significant difference (P<0.01)。下同 The same below
图6 qPCR检测结果
Fig.6 qPCR test results
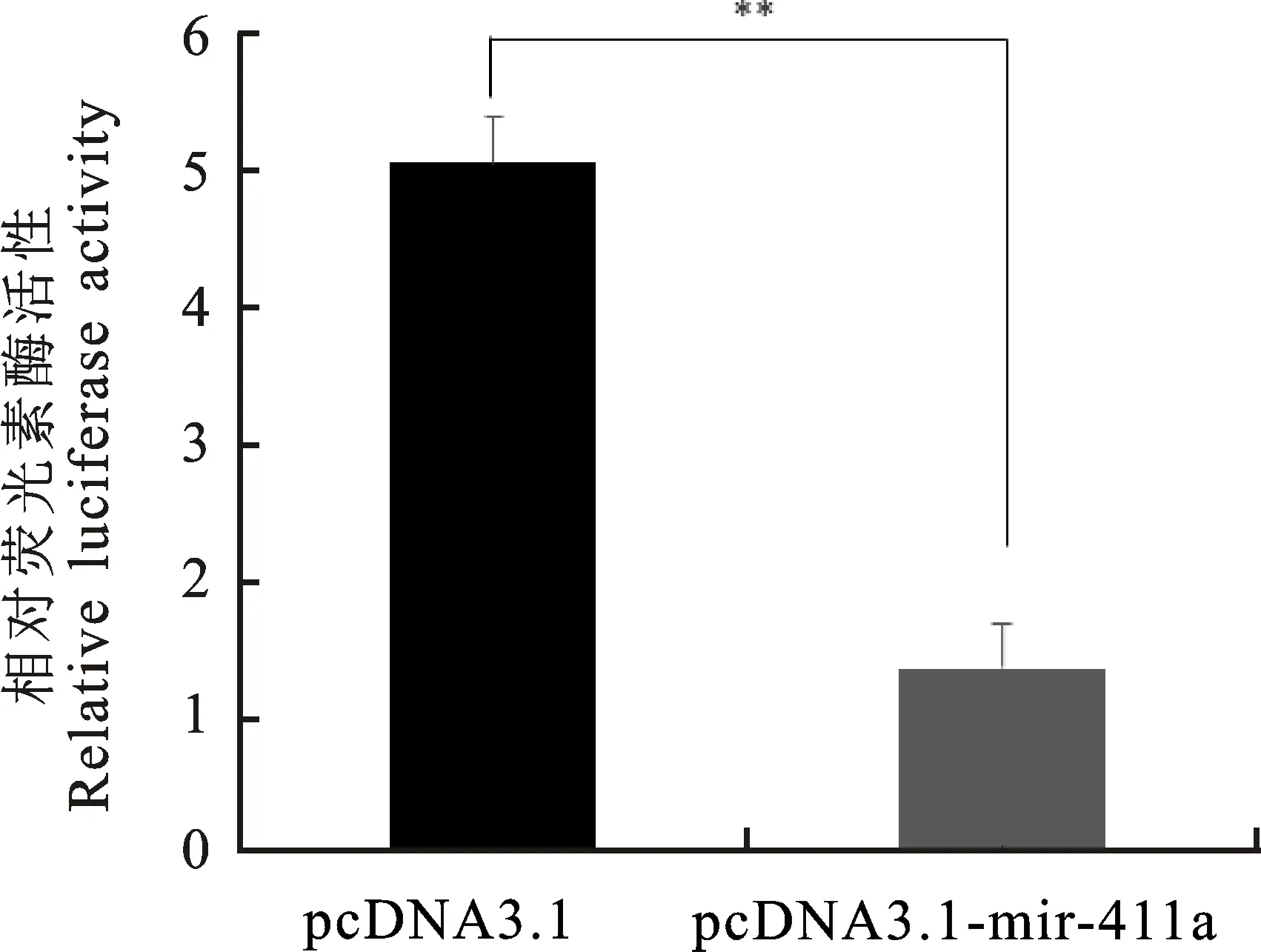
图7 双荧光素酶报告基因的检测结果Fig.7 Detection results of dual luciferase reporter gene
3 讨 论
大量研究表明miRNA参与肺部疾病的调控过程。国内彭秀丽团队以鸡胚成纤维细胞为研究对象,对miRNA靶向靶基因在宿主防御鸡毒支原体(HS株)感染进行研究,分别研究了gga-miR-101-3p和gga-miR-19a等通过结合靶基因3′非翻译区(3′UTR)来调节靶基因宿主增强子的表达[9-10]。
相关研究报道miR-411可能在癌症中起上调或下调作用。例如,Guo等[11]报道miR-411在乳腺癌中显著下调,miR-411的过表达通过靶向特异性蛋白显著抑制乳腺癌细胞的生长、迁移和侵袭。Xia等[12]发现miR-411的表达通过靶向ITCH表达促进人肝细胞癌细胞的增殖。最近,Nadal等[13]报道miR-411在肺癌中的表达显著上调;也有人将血清中miR-411作为非小细胞肺癌诊断和预后生物标志物[14]。
FLT3(Fms-like tyrosine kinase, FMS样的酪氨酸激酶3)属于Ⅲ 型受体酪氨酸激酶(receptor tyrosine kinase Ⅲ , RTK Ⅲ )家族成员,近年来,许多大样本研究已经证实FLT3的激活突变在白血病的发生及疾病的进展中起到十分重要的病理作用[15]。前人研究表明FLT3可以增强慢性阻塞性肺疾病的抗病力,在炎症方面的研究为本试验提供了新方向[16]。
miRNA与靶基因的关系可以通过软件进行预测,随着生物信息学的发展,靶基因预测软件预测到的数量与日俱增,本研究利用常用的双荧光素酶报告基因法,构建FLT33′UTR的双荧光素酶报告载体,结果在细胞水平证明了FLT3是oar-miR-411a的靶基因,这种方法简单快速证实预测软件预测的结果。
通过对miRNA高通量测序结果进行分析,发现miR-411a在支原体肺炎感染的肺组织中高表达。通过利用一些生物信息学分析软件预测分析显示,FLT3是miR-411a的靶基因,miRNA一般作用于靶基因mRNA的非编码区,miR-411a通过与FLT33′UTR互补配对,形成双链RNA的二级结构(自由能:-11.7 kcal/mol),沉默FLT3。靶序列FLT3在常见物种中高度保守。本试验进行miRNA-411a及其靶基因FLT3的研究分析,验证两者的相互作用。结果表明:成功构建pcDNA3.1-411a和pMIR-RL-FLT3真核表达载体,转染293T细胞,通过qPCR检测靶基因的相对表达量,双荧光素酶报告基因检测相对活性,发现miRNA-411a显著抑制FLT3的表达。表明FLT3是miRNA-411a的靶基因。
绵羊支原体肺炎作为一种传染性疾病严重的威胁着家畜和牧民的健康。本研究从本地感染支原体肺炎的绵羊入手,利用生物信息学方法分析和细胞水平试验相结合,对绵羊支原体感染相关的miRNAs进行鉴定,初步阐明其调控和响应机制,为进一步研究相关miRNAs及其靶基因在绵羊支原体肺炎疾病中的调控作用奠定基础,也为支原体引起的绵羊慢性呼吸道疾病的诊断和治疗提供新的分子靶标及理论基础。
4 结 论
本研究通过构建、转染2种真核表达载体,成功验证oar-miRNA-411a及其靶基因FLT3相互作用,揭示miRNA通过调控靶基因表达对支原体感染起重要作用,为支原体发病机制提供了新的视角。

