氮添加对退化高寒草地土壤微生物量碳氮的影响
王丽娜,罗久富,杨梅香,张利,刘学敏,邓东周,周金星
(1.北京林业大学,水土保持国家林业局重点实验室,北京100083;2.北京林业大学,水土保持学院,云南建水荒漠生态系统国家定位观测研究站,北京100083;3.阿坝州林业科学技术研究所,四川 汶川623000;4.四川省林业科学研究院,四川 成都610066)
大多陆地生态系统中,氮素是植被生长和土壤养分循环的主要限制因子。在干旱和半干旱地区,当土壤水分较为充足时,氮素的限制作用尤为突出[1]。由于人类工业和农业生产活动中大量使用化石燃料以及化肥,导致全球性大气氮沉降增加,我国是氮沉降第三大集中区,在未来几十年,氮排放量将持续增加[2]。外源氮输入(自然氮沉降和人为氮添加)缓解或消除了氮素对生态系统的限制,从而转化成其他养分的限制(如磷限制),对生态系统的植被、土壤和土壤微生物产生不同程度的影响[3-4]。土壤微生物是土壤生态系统的重要组成部分,也是土壤有机质矿化和养分循环等过程的主要参与者[5]。土壤微生物对环境的变化十分敏感,能够较早地预警土壤生态系统中发生的极小变化,是评价土壤环境质量的重要指标[6]。土壤微生物量(soil microbial biomass)是指土壤除植物外,体积小于5×103μm3且有生命的生物的总量,体积极其微小却最易发生变化[7]。尽管土壤微生物量含量只占土壤有机碳(soil total organic carbon)的1%~3%[8],却是土壤养分的储存库和植物生长可利用养分的重要来源,对推动土壤物质转换和能量流动起着重要作用[9]。土壤微生物量碳(soil microbial biomass carbon,SMBC)、土壤微生物量氮(soil microbial biomass nitrogen,SMBN) 是土壤微生物活性资源库,能灵敏地反映土壤微生物活动,同时也是土壤质量评价的有效指标[9-11]。
若尔盖草原位于青藏高原东部边缘地带,是长江、黄河两大水系的发源地,享有“高原之肾”之称,其生物多样性对气候调节、水土保持、水源涵养等极其重要[12]。由于特殊的地理位置、地质构造以及严酷的自然条件,若尔盖高寒草地生态环境较为脆弱,内部物质循环和能量流动过程缓慢,抗干扰和自我恢复能力较差,生态平衡极易被打破[13]。近几十年来,由于气候变化和人类活动等因素的影响,若尔盖高寒草地水土流失严重,出现草地退化、沙化现象[14]。高寒环境中土壤有机质分解速率缓慢,可利用养分缺乏[15],草地退化使得土壤有效氮素供给严重不足,高寒草地生态系统对外源氮输入更加敏感[16]。目前常通过人为添加氮肥的方法探讨氮沉降增加对生态系统的影响,已有的研究表明,微生物量出现增加[17]、降低[18]和不变[19]3种现象,由于土壤本身的差异性,土壤微生物量对氮素输入速率的承载力不同[20],因此需要结合具体环境进行研究。氮添加对高寒草地生态系统的研究大多集中在植被群落结构[21]、初级生产力[22]和土壤养分[23]及土壤理化性质[24]方面,同一时间段内研究氮添加对不同退化高寒草地土壤微生物量的影响的研究较少。因此本试验结合青藏高原氮沉降背景,在若尔盖高寒草地4个不同退化程度样地内采用不同水平施氮处理,探究不同退化程度高寒草地土壤微生物量对外源氮输入响应的差异性。为深入了解外源氮输入对高寒草地生态系统的影响机制提供参考依据。
1 材料与方法
1.1 研究区概况
四川省若尔盖县位于青藏高原的东部边缘地带,地理坐标102°08′-103°39′ E,32°56′-34°19′ N,若尔盖境内地形复杂,县内平均海拔3500 m[25],属高山大陆季风气候区,为高原寒温带湿润气候,年平均气温0.7~1.1 ℃,最冷月(1月)气温-7.9~-0.5 ℃,最热月(7月)气温10.9~11.4 ℃[12],最冷月均温与最热月均温相差约21.4 ℃;年均降水量为656.8 mm,年蒸发量达1064.6 mm,相对湿度64%;年均日照 2417 h;年平均风速2.3 m·s-1,最大风速为36 m·s-1,年大风日数50 d[25]。土壤类型主要为沼泽土、山地草甸土两大类。主要植被类型为高寒草甸类、高寒沼泽化草甸和高寒沼泽,其中高寒草甸分布最广、面积最大。由于特殊的高寒气候条件和地理环境,高寒草地以多年生草本植物为主,植被优势种主要有线叶嵩草(Kobresiacapillifolia)、矮生嵩草(Kobresiahumilis)、高山嵩草(Kobresiapygmaea)、老芒麦(Elymussibiricus)、紫羊茅(Festucarubra)、垂穗披碱草(Elymusnutans)、察瓦龙紫菀(Astertsarungensis)等多年生莎草科、禾本科、豆科植物,伴生植物主要有鹅绒委陵菜(Potentillaanserina)、细叶亚菊(Ajaniatenuifolia)、珠芽蓼(Polygonumviviparum)、乳白香青(Anaphalislactea)等毛茛科、菊科、蓼科植物,还有不可食杂类草和毒草:甘肃棘豆(Oxytropiskansuensis)、甘肃马先蒿(Pediculariskansuensis)、黄帚橐吾(Ligulariavirgaurea)、狼毒(Euphorbiafischeriana)、圆萼刺参(Morinachinensis)等。
1.2 试验设计
试验采用完全随机区组设计,依据《天然草地退化、沙化、盐渍化的分级标准》(GB19377-2003)[26]在地势较为平坦、远离人为干扰的区域,选取植被相对均匀且具有代表性的地段设置4个不同退化程度的试验样地,分别为未退化草地(non degradation grassland,NDG)、轻度退化草地(light degradation grassland,LDG)、中度退化草地(moderate degradation grassland,MDG)和重度退化草地(serious degradation grassland,SDG),其中重度退化样地是人工播种的牧草,各退化草地基本性状见表1。在每个退化梯度植被区内随机选取3块样地(19 m×7 m),在样地中布设4块4 m×7 m的小区,每个小区间隔1 m作为缓冲带,缓冲带内不施肥,并用木桩标记。小区内沿中线布设3个样方(2 m×1 m),将其划分为2个1 m×1 m小样方,并标记为A、B样方,样方A为植物群落调查样方,样方B为生物量采样样方。每个样地内氮素添加浓度为: 0、5、10、20 g·m-2(分别标记为CK,N5,N10,N20),其中 5、10、20 氮素浓度折合施尿素量分别为10.78、21.55、43.10 g·m-2。2015-2016年,于每年返青期(5月)施肥,将尿素均匀撒至相应样地内。

表1 样地基本概况Table 1 General condition of sample plot
1.3 样品采集
于2016年生长旺盛期(8月上旬)进行采样,植物地上生物量采用收获法,在生物量取样样方B中随机选取0.5 m×0.5 m,齐地面剪取所有物种的地上部分,剔除枯落物并除去表面污物,带回实验室在105 ℃下杀青15 min,然后在65 ℃烘干至恒重称取生物量(精确至0.01 g)。在群落调查后的样方内用内径3.8 cm的土钻按S型取9钻0~10 cm深度的土壤,并组成一个混合土样,每个小区3个重复,共取土48份,剔除杂物将样品装入已编号的布袋内,低温保存带回实验室。将土样分为两部分,一部分新鲜土样过2 mm筛后置于冰箱中(4 ℃冷藏),用于土壤微生物量碳氮的测定;其余土样自然风干后过筛保存,用于土壤理化性质测定。
1.4 室内测试
土壤pH,电位法(水土比2.5∶1.0),用PHS-3E型pH计进行测量[27]。含水率采用烘干法。土壤有机碳采用重铬酸钾稀释热法,校正系数1.33[28],土壤速效磷采用碳酸氢钠浸提-钼锑抗比色法,土壤硝态氮采用硫酸肼还原法,土壤全氮用凯氏定氮法,全磷采用氢氧化钠碱融-钼锑抗比色法,利用全自动化学分析仪Smartchem 200测定。土壤微生物生物量碳、氮采用氯仿熏蒸-K2SO4浸提法,利用multi N/C 3100 TOC分析仪进行测定,土壤微生物量碳(soil microbial biomass carbon, SMBC)转换系数0.45[28];土壤微生物量氮(soil microbial biomass nitrogen, SMBN)转换系数0.54[28]。
1.5 数据分析
用Origin 2018作图,SPSS 22.0进行统计分析。同一样地不同水平氮处理间的数据用One-way ANOVA方差分析,用Duncan检验法进行多重比较。对土壤微生物量碳氮与土壤理化性质用Pearson相关系数法进行相关性分析,统计分析的显著水平设为P=0.05,数据均为平均值(mean)± 标准偏差(SD)。
2 结果与分析
2.1 氮添加对不同退化程度高寒草地土壤养分的影响
对不同退化草地进行氮添加处理,退化草地土壤养分变化状况见表2。无氮添加时,土壤硝态氮、全磷及有机碳均表现为NDG>LDG>MDG>SDG,土壤全氮在NDG为3.00±0.10 g·kg-1,远高于其他退化草地,分别是LDG、MDG与SDG的8.8、37.5和37.3倍,而速效磷只在SDG显著降低。N处理下,不同退化草地土壤养分表现出不同的变化趋势:土壤硝态氮在LDG随氮浓度梯度增加呈直线上升型,在NDG、MDG和SDG表现为“U”型,但均在N20处理下达到最大值,NDG、SDG与CK对比分别增加了69.24%、81.83%、31.05%、26.71%;速效磷含量在不同退化草地均表现为各施氮处理显著低于CK,但NDG与SDG最小值出现在N10而LDG与MDG最小值出现在N20;土壤全氮在NDG表现为各氮处理显著低于与CK,LDG、MDG施氮处理显著高于对照,而在SDG各处理之间差异不显著(P<0.05);全磷在NDG与LDG各氮处理显著低于CK,而MDG表现为上升趋势,在SDG各处理无显著差异;有机碳除在SDG外表现为施氮处理低于对照,但不同氮水平处理间土壤有机碳含量变化不显著(P>0.05)。
2.2 氮添加对不同退化程度高寒草地土壤微生物量碳的影响
NDG土壤微生物量碳在各氮处理下显著低于对照CK(P<0.05),且随氮浓度增加呈下降趋势,对比N5与CK、N10与N5、N10与N20下降幅度分别为40.03%、7.44%、72.60%;LDG土壤微生物量碳在氮素添加下,随氮浓度增加呈先升高后降低的趋势,氮浓度为N5、N20时显著低于对照CK,而N10与CK无显著差异(P>0.05),N5比CK降低12.02%、N20比N10降低23.81%;MDG土壤微生物量碳在N5处理下达最大值,N5比CK升高24.52%,N10与N20处理显著低于CK,降幅度分别为30.02%和19.80%;SDG除N5处理比CK显著下降了36.23%,其他处理间土壤微生物量碳未达到显著水平(图1)。以上表明,氮添加对土壤微生物量碳的影响与退化程度有关,不同退化样地内的土壤微生物量碳对输入氮浓度的其敏感性存在差异性,其敏感性随退化程度加剧而逐渐降低,NDG土壤微生物量碳的敏感性高于其他退化草地。
CK条件下不同退化草地土壤微生物量碳显著差异(P<0.05),土壤微生物量碳从NDG到SDG下降幅度分别为47.76%、84.64%、56.30%;N5处理下4个不退化样地间土壤微生物量碳仍存在显著差异,由NDG到SDG下降幅度为23.36%、78.26%、77.62%;N10处理下LDG比NDG显著下降9.67%,MDG比LDG下降88.80%,而MDG与SDG样地的土壤微生物量碳无显著差异(P>0.05);N20时LDG土壤微生物量碳显著高于NDG,提高了151.13%。说明,氮添加对不同退化样地土壤微生物量碳的影响与氮输入的浓度有关,氮浓度达到20 g·m-2·a-1时LDG土壤微生物量碳远大于NDG土壤微生物量碳。

表2 氮添加对不同退化程度高寒草地土壤养分特征的影响Table 2 Effect of N addition on soil nutrients characteristics of different steppes (mean±SD,n=3) (g·kg-1)
注:CK,N5,N10,N20指施氮水平为0、5、10、20 g·m-2·a-1;相同字母代表处理间差异不显著(P>0.05),不同字母代表处理间差异显著(P<0.05);小写字母代表同一退化草地不同氮浓度处理的比较,大写字母代表等量氮浓度处理下不同退化草地间的比较,下同。
Note: CK,N5,N10,N20refers to nitrogen levels 0,5,10,20 g·m-2·a-1; Between the same letters represent no significant difference (P>0.05), the different letters represent significant difference among treatments (P<0.05); Lowercase letters represent the comparison of different nitrogen treatment in the same degraded grassland, and uppercase letters represent comparison between different degraded grassland with same N treatment, the same below.
2.3 氮添加对不同退化程度高寒草地土壤微生物量氮的影响
若尔盖不同退化程度高寒草地土壤微生物量氮对氮添加的响应见图2,氮添加均显著降低了NDG土壤微生物量氮含量,随氮浓度增加呈下降趋势,比较N5与CK、N10与N5,N20与N10,其下降幅度分别为28.22%、14.86%、80.94%;氮添加降低了LDG土壤微生物量氮含量,不同氮水平间土壤微生物量氮含量变化幅度较小,N5与CK、N10与N5,N20与N10的变化幅度分别为12.41%、7.38%、9.16%;MDG土壤微生物量氮在N5处理下显著高出CK 47.89%,而CK、N10、N20之间差异不显著;SDG土壤微生物量氮在氮素添加下呈上升趋势,N20显著高于CK。氮添加对土壤微生物量氮具有显著影响,但不同退化样地对氮添加以及氮浓度变化的敏感程度存在差异,4个退化样地中NDG土壤微生物量氮含量在氮添加下变化幅度较大,说明氮添加对NDG影响更大。
未添加氮时(CK)不同退化样地的土壤微生物量氮差异显著,随退化程度加剧而显著下降,由NDG到SDG下降幅度依次为:28.22%、14.86%、80.94%;N5处理下降幅度为:21.18%、78.88%、82.14%;N10处理下NDG与LDG、 MDG与SDG之间差异不显著;N20时LDG土壤微生物量氮显著高于NDG。表明,氮添加对高寒草地土壤微生物量氮的影响随输入的氮浓度变化会发生显著变化,氮浓度较低时由NDG到SDG土壤微生物量氮与CK条件下的变化趋势相似呈直线下降型,但输入氮浓度较高时其变化趋势由直线下降变单峰“Λ”型,LDG草地微生物量氮显著高于其他退化草地。

图1 氮添加对不同退化草地土壤微生物量碳的影响Fig.1 Effects of N addition on soil microbial biomass carbon in different degraded grasslands(mean±SD,n=3)
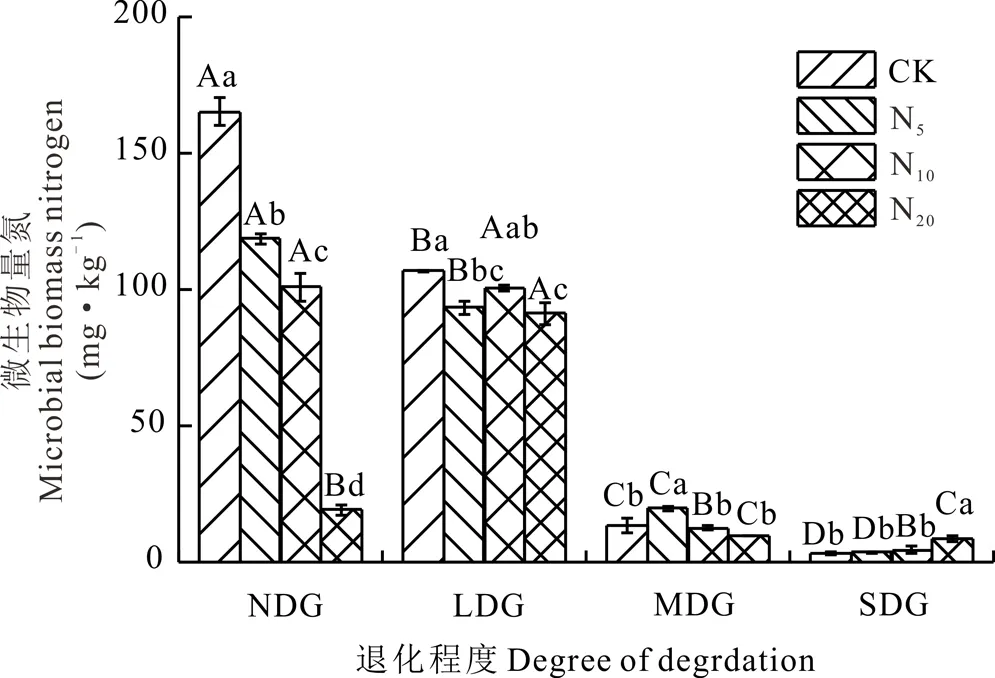
图2 氮添加对不同退化草地土壤微生物量氮的影响Fig.2 Effects of N addition on soil microbial biomass nitrogen in different degraded grasslands(mean±SD,n=3)
不同大写字母表示相同氮浓度处理下不同退化草地间差异显著(P<0.05);不同小写字母代表同一退化草地不同氮浓度处理间差异显著(P<0.05),下同。The different uppercase letters represent significant difference between different degraded grassland for same nitrogen concentration treatment (P<0.05), the different lowercase letters represent significant difference with difference treatments in the same degraded grassland (P<0.05), the same below.
2.4 氮添加对不同退化程度高寒草地土壤微生物量碳氮比的影响
总体上,随着施氮浓度的增加对土壤微生物量C/N的影响更显著(图3)。CK条件下,SDG土壤微生物量C/N为16.83,显著高于其他退化草地,而NDG、LDG、MDG间未达到显著水平;N5和N10处理,同一退化草地内土壤微生物量C/N无显著性差异,且同一施氮浓度不同退化草地间土壤微生物量C/N无显著差异;而N20处理下NDG土壤微生物量C/N显著高于其他处理,相反SDG土壤微生物量C/N下降,与CK比下降了62.5%。
2.5 土壤微生物量碳、氮与土壤理化性质之间的相关性
对土壤微生物量碳、氮与土壤理化因子进行相关性分析(表3),同时不同浓度氮输入改变了土壤微生物量碳、氮与土壤环境因子(土壤速效磷、硝态氮、全氮、全磷、有机碳、含水率、pH)之间的关系。CK条件下,土壤微生物量碳、氮与速效磷、硝态氮、全氮、全磷、有机碳、含水率呈显著或极显著正相关关系,与pH极显著负相关。土壤微生物量碳、氮与速效磷在各施氮处理下由显著正相关变为无显著相关性。在N20处理下土壤微生物量碳、氮与pH由负相关变为正相关关系。随着施氮浓的增加,各因子与土壤微生物量碳、氮的相关系数逐渐减小,N20处理土壤微生物量碳、氮与各因子间无显著相关性。
2.6 不同退化程度植被盖度、土壤微生物量及土壤理化性质相关分析
自然状态下,群落的植被盖度和生物量不仅能表征群落的演替状况,同时还可以反映群落演替中土壤特征和土壤养分持续供给能力。因此,分析植被盖度、地上生物量、土壤微生物量与土壤理化性质(速效磷、硝态氮、全氮、全磷、有机碳、含水率、pH)之间的相关关系, 来解释草地退化的内在原因。 研究表明(表4),高寒草甸植被盖度与土壤微生物量碳、土壤微生物量氮、有机碳之间存在明显的正相关关系,相关系数r分别为0.916、0.909、0.901,与土壤pH呈极显著负相关(r=-0.951,P<0.01);高寒草甸群落地上生物量与土壤微生物量碳呈极显著正相关,地上生物量与土壤微生物量氮的相关系数仅为0.672,与土壤有机碳的相关系数达0.747,与土壤pH呈极显著负相关关系(r=-0.762,P<0.01)。
注:“*”表示显著相关(P<0.05), “**”表示极显著相关(P<0.01),下同。
Note: “*”indicate significant correlation (P<0.05), “**”indicate very significant correlation (P<0.01), the same below.

表4 不同退化程度草地植被盖度、土壤微生物量、土壤理化指标的相关性Table 4 The correlation among plant coverage, microbes biomass and environment indexes in different degraded grasslands
3 讨论
3.1 氮添加对退化草地土壤微生物量碳、氮的影响
土壤微生物量碳、氮在一定程度上能够反映土壤微生物的数量,体现土壤微生物的活性[10],并能灵敏地表征土壤养分的有效状况,对环境因子的变化较为敏感,常作为土壤对环境响应的指标[29]。本研究通过比较和分析4个退化草地不同氮浓度处理下土壤微生物量碳、氮的变化发现,不同退化程度高寒草地土壤微生物量碳、氮对外界氮输入的敏感性随草地退化加剧而逐渐降低。这可能是因为随着草地退化加剧,土壤微生物可利用的碳源和氮源减少,使得土壤微生物活性受到抑制[30],因此对外界环境变化的敏感性降低。氮添加降低了未退化、轻度退化、中度退化草地土壤微生物量碳、氮,这与Bradley等[31]在美国明尼苏达州(Minnesota)高寒草地进行氮添加实验结果一致,却与赵莉[32]的研究结果相反。重度退化草地土壤微生物量碳、氮在不同氮处理下无显著变化,与Liu等[19]在内蒙古温带草地施氮研究结果相似。不同退化高寒草地土壤微生物量碳、氮对氮添加的响应存在差异,其原因主要是:1)氮素不是土壤微生物量碳、氮的唯一影响因子,还与土壤pH、水分、有机碳等其他因子有关[33-34], 不同退化草地土壤环境因子存在较大差异,限制微生物活动的主要因子并不完全一致。2)在不同的退化草地中植被群落物种组成存在差异,植被与土壤微生物对养分的竞争能力存在差异[35],相关分析表明,不退化草地群落植被盖度、地上生物量与土壤微生物量、有机碳以及pH之间关系密切,但其中植被-土壤-微生物3个层面上的相互因果关系,本研究尚不能得到明确答案。
刘金山等[36]研究表明,不同施氮水平对土壤微生物量碳无显著影响,而显著提高了土壤微生物量氮的含量。而本研究发现,不同氮浓度梯度处理对土壤微生物量碳、土壤微生物量氮均具有显著影响。此外,本研究还发现随着施氮浓度的改变,土壤微生物量碳、氮与土壤各理化因子的相关关系发生改变,较高氮浓度处理下土壤微生物量碳、氮与土壤理化性质无显著相关性。刘蔚秋等[37]的研究也表明氮添加下土壤养分会发生变化,从而影响到土壤微生物的生长代谢。这说明一定范围的氮输入会有效减缓土壤微生物的营养压力,氮输入量过高时会使土壤微生物对土壤养分的吸收利用发生变化[38]。依据目前的研究结果,试验区内氮添加对土壤微生物量的影响需要进行长期的进一步监测。
3.2 氮添加对退化草地土壤微生物量碳、氮比的影响
土壤微生物C/N可以反映土壤氮素的供应能力,其比值较小时土壤氮素有较高的生物有效性,表明土壤氮素利用率高[39]。另外,土壤微生物C/N可以在一定程度上反映土壤微生物组成和群落结构,一般情况下,微生物C/N大小为真菌>放线菌>细菌[40]。本研究发现,无氮添加时重度退化草地的土壤微生物C/N显著高于其他3个退化样地,说明在退化较为严重的高寒草地土壤微生物的丰度及活性较低,这与蔡晓布等[30]的研究结果一致。李飞等[41]对退化草甸的土壤微生物功能多样性研究也表明,随着退化程度的加剧,土壤肥力下降,植被类型减少,毒杂草逐渐成为优势种,微生物多样性呈下降趋势。因此,在一定程度上可用微生物量碳氮比作为微生物丰度指标。朱瑞芬等[42]研究表明,土壤微生物C/N在各施氮处理下差异不显著。而本研究发现施氮浓度在一定范围内土壤微生物量碳、氮比无显著变化,但高浓度氮输入显著改变了土壤微生物量碳、氮比,可能是因为氮添加后土壤微生物对养分的利用类型发生改变从而改变了土壤微生物的组成结构和多样性的变化[43]。
4 结论
本研究通过测定不同氮浓度添加对若尔盖4个不同退化高寒草地的土壤微生物量碳、氮的影响,以及土壤微生物量碳、氮与硝态氮、速效磷、全氮、全磷、有机碳、pH、含水率的相关分析,探讨不同退化草地对氮添加的响应机制。研究发现,不同退化程度的草地对氮输入的响应存在显著差异,随着土地退化的加剧,土壤微生物量碳、氮对外界环境变化的敏感性降低。氮添加下,土壤微生物量碳、氮与土壤理化性质的相关关系发生变化,需要进一步从土壤微生物对土壤养分的吸收利用方面解释其原因。氮浓度梯度的改变对不同退化草地土壤微生物量碳、氮比的变化趋势产生显著影响,说明氮添加对不同退化草地的土壤微生物的组成和群落结构都产生影响,后期的研究中可利用高通量测序技术手段从微生物功能群落及基因方面入手,进一步认识高寒草地生态系统对氮输入的生态功能过程及响应机制。

