超声辅助酶解法提取杠板归中总黄酮*
张道英,孙湘婷,钟 亮,朱浩文,黄 浩
(赣南医学院药学院,江西 赣州 341000)
杠板归别名众多,又称贯叶蓼、河白草、犁头藤等,为蓼科植物杠板归的茎叶部分,夏季开花时采收,晒干而成,拉丁学名为PolygonumperfoliatumL.[1-2]。药材表面呈紫红色或紫棕色,茎细长呈方柱形,直径约0.1~0.2 cm;茎有棱,棱及叶柄有倒生钩刺;叶互生,有长柄,叶片多皱缩,展平后呈三角形状,为蓼科蓼属一年生攀缘草本植物[2],在全国各地均有分布。根据古代本草医书上记载,杠板归味酸苦,入肺、小肠经,具有清热解毒、利湿消肿、治蛇咬伤、活血散瘀等功效。在民间杠板归的单方用药常用于治疗湿疹、痈肿疔疮、带状疱疹、瘰疬、水肿胀、肾炎水肿、蛇虫咬伤等,疗效显著[3]。药理研究表明,杠板归的提取液具有保肝、抗菌、抗炎、抗病毒、抗癌等活性作用[3-4]。
研究表明杠板归中含有多种黄酮类成分,黄酮类化合物泛指两个具有酚羟基的苯环中间通过中央三碳原子相互连接而成的一系列化合物[5]。这些成分具有明显的药理活性[6-9]。目前,杠板归中总黄酮的提取工艺研究只限于纤维素酶解法[10]、回流提取法、超声提取法和微波萃取法[11],还没有纤维素酶辅助提取工艺与多种提取法联合提取工艺的相关研究。超声波能够通过空化效应、机械效应破坏植物细胞的细胞壁、细胞膜,并通过热效应加速药材有效成分溶出,从而使提取溶剂溶解更多药材细胞内的有效化学成分[12],而纤维素酶能够使植物细胞壁中的纤维素分解,进而增加细胞壁的通透性,同样能增加药材细胞内化学成分的溶出[13]。本文联用纤维素酶解法和超声提取法提取杠板归中总黄酮,经单因素实验和正交试验对超声辅助酶解法的提取工艺进行优化后与传统提取方法进行对比,为杠板归中总黄酮的提取工艺研究及联用多种提取法提取植物中有效成分提供良好的实验数据。
1 材料与方法
1.1材料与试剂芦丁(购自中国食品药品检定研究院,批号:100080-201408,纯度90.2%),95%乙醇(分析纯,天津市福晨化学试剂厂),亚硝酸钠(分析纯),硝酸铝(分析纯),氢氧化钠(分析纯),纤维素酶(≥15 U·mg-1,天津市光复精细化工研究所),杠板归(2015、2016年分别采自四川省乐山县,经药学院生药学教研室李加林副教授鉴定为杠板归正品)。
1.2仪器XL-600B小宝多功能粉碎机(永康市小宝电器有限公司),药典三号筛(孔径0.355 mm,浙江上虞市道墟张兴纱筛厂),FA1104万分之一电子天平(上海舜宇恒平科学仪器有限公司),AB135-S十万分之一电子天平(瑞士梅特勒—托利多集团),紫外-可见分光光度计(美国珀金埃尔默公司),JP-100超声波清洗机(深圳市洁盟清洗设备有限公司),HH-S24四显双列四孔恒温水浴锅(金坛市大地自动化仪器厂),Satorious PB-10酸度计(德国赛多利斯贸易有限公司)。
1.3方法
1.3.1样品前处理取适量杠板归药材,晒干、粉碎,过药典三号筛,干燥后放入干燥密封袋中备用。2015年、2016年四川产杠板归均粉碎,单因素实验和正交实验选用2015年四川产杠板归粉末。
1.3.2芦丁标准曲线的绘制
1.3.2.1芦丁标准溶液的制备精密称取芦丁对照品约0.02 g至小烧杯中,加入60%乙醇使对照品充分溶解后,转移至100 mL容量瓶中,并用10 mL同浓度的乙醇润洗两次烧杯,洗涤液并入容量瓶中,定容,制得0.2 mg·mL-1的芦丁标准溶液。
1.3.2.2标准曲线的绘制精密量取0.2 mg·mL-1的芦丁标准液0.00 mL、2.00 mL、4.00 mL、6.00 mL、8.00 mL、10.00 mL、12.00 mL,分别置于25 mL容量瓶中,各加入60%乙醇使其容量瓶内液体均为12 mL,再分别加入1.0 mL浓度为5%的NaNO2溶液,摇匀后静置6 min;再加入1.0 mL浓度为10%的Al(NO3)3溶液,摇匀后静置6 min;再加入10.0 mL浓度为4%的NaOH溶液,用60%乙醇溶液定容至刻度线,摇匀后静置10 min[14-15]。以试剂空白作参比,在510 nm处测定上述系列标准溶液的吸光度。以芦丁标准液的浓度为横坐标,相应的吸光度值为纵坐标,绘制芦丁标准曲线。
1.3.3超声提取法与回流提取法的比较采用朱良荣等[11]探索的超声提取法提取杠板归总黄酮的最佳提取条件:精密称取干燥杠板归粗粉约1.0 g,置于100 mL圆底烧瓶中,加入40 mL 60%乙醇溶液,在40 ℃环境下超声提取40 min。提取后趁热抽滤,用60%乙醇溶液10 mL洗涤滤渣2次,将滤液与洗涤液合并转移到50 mL容量瓶中,定容,混匀。精密移取提取液1 mL至25 mL容量瓶中,按“1.3.2.2标准曲线的绘制”项下自“加入60%乙醇使其容量瓶内液体均为12 mL”起,依法进行吸光度测定。
另外精密称取干燥杠板归粗粉约1.0 g,置于100 mL蒸馏烧瓶中,以上述超声提取法的料液比及乙醇浓度为提取条件,在恒温85 ℃水浴中醇提2 h,静置冷却,过滤。滤渣同样按上述方法用10 mL 60%乙醇溶液洗涤2次,合并提取液并转移到50 mL容量瓶中。移取提取液1 mL至25 mL容量瓶中,测定吸光度。
1.3.4酶法辅助提取的单因素实验考察根据“1.3.3超声提取法与回流提取法的比较”的结果确定使用超声提取法或回流提取法提取杠板归中的总黄酮,并辅助酶法进行提取,对酶法提取的酶浓度、酶解时间、酶解温度和酶解pH值等条件进行单因素实验考察,确定杠板归中总黄酮的最佳提取条件。
1.3.4.1酶浓度分别精密称取约1.0 g杠板归粗粉,置于5个100 mL的圆底烧瓶中,取40 mL 60%乙醇溶液,用纤维素酶调溶液酶浓度分别为0.10 mg·mL-1、0.20 mg·mL-1、0.30 mg·mL-1、0.40 mg·mL-1、0.50 mg·mL-1后加入到烧瓶中,再用酸度计调节溶液pH值均为5.0。放入恒温水浴锅中,设定温度为45 ℃,酶解90 min。酶解完成后,将圆底烧瓶取出,并用沸水水浴5 min做酶灭活处理。之后将蒸馏烧瓶放入超声仪中超声40 min,取出,按“1.3.3”中操作进行抽滤、定容、吸光度测量等处理。
1.3.4.2酶解时间分别精密称取约1.0 g干燥杠板归粗粉,置于5个100 mL的圆底烧瓶中,取40 mL 60%乙醇溶液,调节溶液酶浓度为“1.3.4.1酶浓度”优选出的最佳浓度后加入到烧瓶中,调节pH为5.0,放入温度设定为45 ℃的恒温水浴锅中,设置酶解时间分别为30 min、60 min、90 min、120 min、150 min。进行酶灭活处理后超声40 min,取出,按“1.3.3”中操作进行抽滤、定容、吸光度测量等处理。
1.3.4.3酶解温度分别精密称取约1.0 g干燥杠板归粗粉,置于5个100 mL的圆底烧瓶中,取40 mL 60%乙醇溶液,调节溶液酶浓度为“1.3.4.1酶浓度”优选出的最佳浓度后加入到烧瓶中,调节pH为5.0,分别在温度设置为35 ℃、40 ℃、45 ℃、50 ℃、55 ℃的恒温水浴锅内酶解,酶解时间为“1.3.4.2酶解时间”优选出的最佳酶解时间。进行酶灭活处理后超声40 min,取出,按“1.3.3”中操作进行抽滤、定容、吸光度测量等处理。
1.3.4.4酶解pH值分别精密称取约1.0 g干燥杠板归粗粉末,置于5个100 mL的圆底烧瓶中,取40 mL 60%乙醇溶液,调节溶液酶浓度为“1.3.4.1酶浓度”优选出的最佳浓度后加入到烧瓶中,分别调节pH为4.0、4.5、5.0、5.5、6.0,放入温度设置为“1.3.4.3酶解温度”优选出的最佳温度的恒温水浴锅内酶解,酶解时间为“1.3.4.2 酶解时间”优选出的最佳提取时间。进行酶灭活处理后超声40 min,取出,按“1.3.3”中操作进行抽滤、定容、吸光度测量等处理。
1.3.5酶法辅助提取的正交试验考察根据“1.3.4 酶法辅助提取的单因素实验考察”的结果对酶法提取的条件进行正交试验考察,确定杠板归中总黄酮的最佳提取工艺。
1.3.6验证实验分别精密称取约1.0 g的2015年四川产干燥杠板归粗粉3份和2016年四川产干燥杠板归粗粉3份,置于6个100 mL的圆底烧瓶中,用上一步优选出的最佳提取工艺进行超声辅助酶解法提取杠板归中的总黄酮,并对其结果进行比较。
2 结 果
2.1芦丁标准曲线芦丁标准曲线的回收方程为Y=10.27X+0.007 2(Y为吸光度A,X为浓度,单位为mg·mL-1),R2=0.999。结果表明芦丁在浓度为0~0.096 mg·mL-1范围内有良好的线性关系。
2.2超声提取法与回流提取法的结果比较用超声提取法提取得到杠板归中总黄酮的提取率为2.17%,用回流提取法提取得到杠板归中总黄酮的提取率为1.97%。超声提取法提取杠板归中总黄酮提取率比回流提取法提高了10.2%,故本实验采取超声辅助酶解法提取杠板归中总黄酮。
2.3超声辅助酶解法单因素试验的结果
2.3.1酶浓度不同纤维素酶浓度相对应的杠板归中总黄酮的提取率如图1所示:在酶浓度为0.1~0.3 mg·mL-1时,杠板归中总黄酮的提取率随酶解反应中纤维素酶浓度的增加而明显提高。在酶浓度为0.3 mg·mL-1时,该法提取率达到最大值3.80%,但继续增加纤维素酶浓度,提取率开始降低并趋于平衡。分析原因可能是由于纤维素酶与底物浓度已经达到饱和,进一步增加酶浓度反而导致酶量过多,造成酶的蓄积,增加了传质阻力[16]。因此,本实验选择反应物酶浓度为0.3 mg·mL-1。
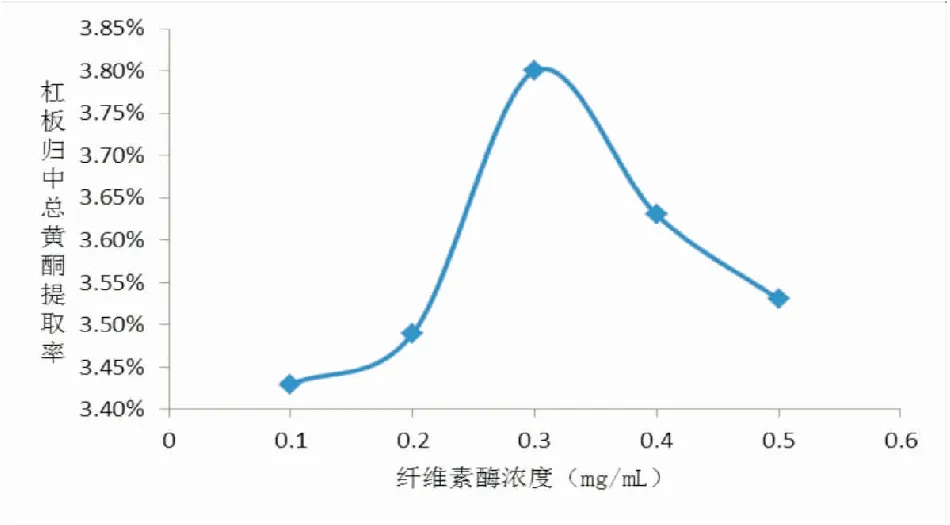
图1 超声辅助酶解法中纤维素酶浓度对提取率的影响趋势图
2.3.2酶解时间不同酶解时间相对应的杠板归中总黄酮的提取率如图2所示:杠板归总黄酮提取率随酶解时间的增加而提高,在酶解时间为90 min时,再延长酶解时间总黄酮提取率几乎不变。该结果表明酶解90 min时,蒸馏烧瓶中杠板归中总黄酮已经提取完全,杠板归中总黄酮提取的最佳酶解时间为90 min。

图2 超声辅助酶解法中酶解时间对提取率的影响趋势图
2.3.3酶解温度不同酶解温度相对应的杠板归中总黄酮的提取率如图3所示:在酶解温度为35 ℃~45 ℃,杠板归总黄酮提取率明显随温度的增高而提高。当酶解温度到达45 ℃时,总黄酮提取率达到最高值3.80%,之后再升高酶解温度总黄酮提取率反而降低。分析原因可能是因为温度过高导致纤维素酶构型发生改变,酶活性降低;也可能是因为温度超过50 ℃时杠板归中溶出的黄酮类化合物易发生氧化反应,其结构发生变化而无法与显色剂反应,因而提取率下降。实验结果表明杠板归中总黄酮提取的最佳酶解温度为45 ℃。

图3 超声辅助酶解法中酶解温度对提取率的影响趋势图
2.3.4酶解pH值不同酶解pH相对应的杠板归中总黄酮的提取率如图4所示:在pH为5.0时,超声辅助纤维素酶法提取杠板归中总黄酮的得率达到最大值3.80%,表明在此pH下,纤维素酶的活性达到最大,酸度过大或者碱性过强都会使其纤维素酶的活性降低。实验结果表明杠板归中总黄酮提取的最佳酶解pH值为5.0。

图4 超声辅助酶解法中酶解pH值对提取率的影响趋势图
2.3.5单因素实验小结通过单因素实验考察,得出超声辅助酶法提取杠板归中总黄酮时酶解法的最佳条件为:纤维素酶浓度0.3 mg·mL-1、酶解时间90 min、酶解温度45 ℃、酶解pH 5.0,在该条件下进行提取杠板归中总黄酮的提取率为3.80%。
为了进一步优化超声辅助酶解法的提取工艺,本实验继续采用正交试验的方法对其最佳提取工艺进行探究。
2.4正交试验及结果分析
2.4.1正交试验设计结合单因素实验探究结果,以杠板归中总黄酮提取率为考察对象,选定超声辅助酶解法中纤维素酶浓度、酶解pH值、酶解温度以及酶解时间为4个因素,设计四因素三水平正交试验来优化超声辅助酶解法提取杠板归中总黄酮的提取工艺条件,正交试验因素水平见表1。正交试验结果用软件正交设计助手ⅡⅤ3.1专业版分析,正交试验结果见表2。

表1 L9(34)正交试验因素和水平设计

表2 正交试验结果
2.4.2正交试验结果分析据表2正交实验结果中极差值R分析,4个实验因素影响超声辅助酶解法提取杠板归中总黄酮的提取率的程度如下:C(酶解温度)>B(酶解pH)>D(酶解时间)>A(酶解浓度)。再综合各种因素的K值分析,超声辅助纤维素酶法提取杠板归中总黄酮的最优实验条件组合是C3B2D2A1,即酶解温度为50 ℃,酶解pH为5.0,酶解时间为90 min,纤维素酶浓度为0.2 mg·mL-1,在该条件下测定的杠板归中总黄酮得率为3.88%,相比传统乙醇回流提取法提高了97.0%,比单独使用超声提取法提高了78.8%。
2.5超声辅助酶解法提取杠板归中总黄酮的最佳提取工艺通过单因素实验并结合正交试验优选出超声辅助酶法提取杠板归中总黄酮的最佳工艺为:精密称取干燥杠板归粗粉约1.0 g,置于100 mL的圆底烧瓶中,取40 mL 60%乙醇溶液,调节溶液酶浓度为0.20 mg·mL-1后加入到烧瓶中,再用酸度计调节溶液pH值为5.0,放入温度设定为50 ℃的恒温水浴锅中,酶解90 min。酶解完成后,将圆底烧瓶取出,并用沸水水浴5 min做酶灭活处理。之后将蒸馏烧瓶放入超声仪内超声40 min。提取后趁热抽滤,用60%乙醇溶液10 mL洗涤滤渣2次,将滤液与洗涤液合并,即得。
2.6验证实验及不同批次样品比较
2.6.1验证实验分别精密称取约1.0 g的2015年四川产干燥杠板归粗粉,置于3个100 mL的圆底烧瓶中,在最佳提取工艺条件下进行超声辅助酶解法提取总黄酮,平均提取率为3.90%,实验结果见表3所示。表明通过正交实验优选出的提取工艺条件准确可靠。

表3 验证实验中各组杠板归总黄酮提取率
2.6.2不同批次样品比较分别精密称取约0.5 g的2016年四川产干燥杠板归粗粉置于3个100 mL的圆底烧瓶中,同样在最佳提取工艺条件下进行超声辅助酶解法提取杠板归中的总黄酮,得出2016年产杠板归中总黄酮的平均提取率为9.00%。见表4。

表4 2016年四川产杠板归总黄酮提取率
与“2.6.1验证实验”中2015年四川产杠板归中总黄酮提取率相比较,2016年四川产杠板归中总黄酮量明显高于2015年四川产杠板归,分析原因可能是2016年四川产杠板归本身总黄酮量较高,而2015年四川产杠板归含量较低,且2015年四川产杠板归在保存过程因保存不当,导致大量黄酮类化合物流失或者被氧化,所以含量较2016年四川主杠板归的含量低。
3 讨 论
朱良荣等[11]探究出的最佳超声提取条件为选用浓度为60%的乙醇,以1∶15料液比,在40 ℃环境下超声40 min。本实验是在该最佳提取条件下,采用纤维素酶解法联合超声提取法提取杠板归中总黄酮,主要探究其工艺中的最佳酶解条件及其工艺可行性,所以在实验中固定超声时间为40 min,并选用浓度为60%的乙醇进行提取。但实验采用料液比固定为1∶40,与参考文献[17]不同,原因是:在进行提取过程中,采用1∶15的料液比,发现乙醇溶液无法浸没杠板归粉末,这样容易导致提取不完全,得出的实验数据不具有可靠性;另外在朱良荣等[11]文献中料液比作为一个单因素所对应的极差R值较小,且进行方差分析后发现料液比对提取率的影响不显著,而且理论上扩大料液只会增加提取率或对提取率影响不大,因此本实验综合考虑采用1∶40料液比进行提取。
本文比较2015年和2016年四川产杠板归粉末的总黄酮含量,旨在了解不同年份的杠板归药材中总黄酮含量差异。实验结果表明年份更久杠板归药材总黄酮含量更低。在杠板归药材储藏过程中,由于微生物或空气氧化等原因,药材中的有效成分会大量流失,因此在临床上选用杠板归入药时,应尽可能选择年份较近的杠板归。

