干巴菌菌丝体多糖的制备及其水解特性
郑 岚,马耀宏*,孟庆军,王丙莲,杨俊慧,刘庆艾,彭 耀,韩 芳
(齐鲁工业大学(山东省科学院),山东省科学院生物研究所,山东省生物传感器重点实验室,山东 济南 250103)
干巴菌(Thelephora ganbajun Zang)为革菌属真菌,珍贵稀少,仅分布在我国滇中高海拔地区的弱酸性红壤地面上,与松树有外生菌根关系,难以实现人工栽培[1-3]。干巴菌不仅异香浓郁、口味极佳,而且具有提高免疫力、抗氧化等保健功效[4-6]。每年干巴菌上市时总是供不应求,导致无序乱采现象严重,产量逐年下降,价格逐年升高。由于其分布的局限性,国内外对干巴菌的研究极为有限,并且多集中在干巴菌的分类、菌种分离、菌种鉴定和生态环境等方面。因此,干巴菌是一种具有极高经济价值及营养价值的亟待研究开发的菌种资源。
食用真菌多糖是食用真菌的主要活性成分之一,具有抗氧化[7]、提高免疫力[8-9]、抗癌症[10]、降血脂[11]、保护肝脏[12]、促进肠道有益菌群生长[13]等广泛的生物活性,是被认可的没有副作用的天然健康的功能食品[14-16]。通过液体发酵途径制备干巴菌多糖是干巴菌资源开发的一条有效途径。其中干巴菌多糖的发酵条件、提取工艺是其有效利用的前提条件,而对干巴菌多糖结构和活性的研究是其开发利用关键点,寻找有效的提高多糖活性方法以及简单、准确的多糖结构分析方法具有重要意义。
本研究对干巴菌的产糖培养基进行了优化;利用Plackett-Burman(PB)试验及响应面试验设计方法,优化了干巴菌菌丝体多糖的超声提取工艺;采用酶水解和酸水解方法,进一步提高了多糖的抗氧化活性;利用逐级酸水解结合柱前衍生高效液相色谱(high performance liquid chromatography,HPLC)法的实验设计,分析多糖水解过程中单糖残基的解离规律,进而推断单糖残基在糖链结构中的分布规律。本研究建立了基于水解过程的多糖结构分析方法,并将没有成功栽培的干巴菌通过液体发酵技术获得有价值的多糖产物,从而使干巴菌的资源利用变得切实可行。
1 材料与方法
1.1 材料与试剂
干巴菌TG-01,由山东省科学院生物研究所分离保存。
2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS) 北京博奥拓达科技有限公司;蜗牛酶北京索莱宝科技有限公司;纤维素酶 国药集团化学试剂有限公司;乙腈(色谱纯) 美国Fisher公司;标准单糖(葡萄糖、甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖)、1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-menthy-5-pyrazolone,PMP)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 美国Sigma公司;溴化钾碎晶美国Thermo公司。其余化学试剂均为分析纯。
1.2 仪器与设备
ZQZY-CF组合式全温振荡培养箱 上海知楚仪器有限公司;UV-2700紫外-可见分光光度计 日本岛津制作所;JY92-II超声波细胞破碎机、Scientz-18ND立式冷冻干燥机 上海新芝生物技术研究所;5804R离心机德国Eppendorf公司;Dynex Spectra MR酶标仪 美国Dynex Technologies公司;SGD-IV全自动还原糖测定仪山东省科学院生物研究所;LE204E电子天平、S220台式pH计 梅特勒-托利多仪器(上海)有限公司;1260 HPLC仪 美国安捷伦科技有限公司;Nicolet 6700傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪 美国Thermo公司。
1.3 方法
1.3.1 干巴菌产糖培养基的优化
1.3.1.1 培养基的制备
活化培养基:马铃薯20%、葡萄糖2%、MgSO4·7H2O 0.1%、KH2PO40.1%、琼脂2%;种子培养基:马铃薯20%、葡萄糖2%、MgSO4·7H2O 0.1%、KH2PO40.1%;马铃薯葡萄糖培养基(A):马铃薯20%、葡萄糖2%、MgSO4·7H2O 0.1%、KH2PO40.1%;淀粉硝酸盐培养基(B):淀粉5%、NaNO30.33%、(NH4)2SO40.31%、MgSO4·7H2O 0.025%、FeSO4·7H2O 0.001%、KH2PO40.1%;酵母膏蛋白胨培养基(C):酵母提取物0.5%、蛋白胨0.15%、葡萄糖5%、KH2PO40.05%、MgSO4·7H2O 0.03%;葡萄糖玉米浆培养基(D):葡萄糖3%、玉米浆0.84%、KH2PO40.1%、MgSO4·7H2O 0.025%;葡萄糖玉米浆尿素培养基(E):葡萄糖3%、玉米浆0.8%、尿素0.1%、KH2PO40.05%、MgSO4·7H2O 0.03%;葡萄糖玉米浆氯化钠培养基(F)[17]:葡萄糖3%、玉米浆0.8%、尿素0.1%、KH2PO40.05%、MgSO4·7H2O 0.03%、NaCl 0.5%。
1.3.1.2 干巴菌的液体发酵培养
将斜面保藏的干巴菌TG-01接种于活化培养基平板中,25 ℃培养5 d,取0.5 cm2活化菌种接入种子培养基中,于摇床振荡培养6 d(25 ℃,130 r/min),即为种子液。取0.5 mL种子液分别转接入马铃薯葡萄糖培养基、淀粉硝酸盐培养基、酵母膏蛋白胨培养基、葡萄糖玉米浆培养基、葡萄糖玉米浆尿素培养基、葡萄糖玉米浆氯化钠培养基中,于摇床振荡培养7 d(25 ℃,130 r/min),每种培养基5 个重复。
1.3.1.3 干巴菌多糖的提取[18]
将培养物离心(8 000 r/min,10 min,4 ℃),分别用pH计和还原糖测定仪测定上清液中的pH值和残糖含量。将菌丝体沉淀用去离子水洗涤3 次后置于55 ℃烘箱中烘干,称质量,粉碎。菌丝体粉末以1∶20比例加入去离子水,超声破碎(300 W,10 min),置于水浴锅中90 ℃浸提2 h,离心(10 000 r/min,10 min,4 ℃)取上清液。重复提取3 次,合并上清液并减压浓缩至1/2~2/3体积,加入2 倍体积95%乙醇溶液,室温静置过夜,离心(8 000 r/min,10 min,4 ℃),沉淀于55 ℃烘箱中烘干并粉碎,即为干巴菌菌丝体多糖。
1.3.1.4 多糖得率的测定
苯酚-硫酸法测定多糖含量[19]。标准曲线的绘制:分别取2 mL不同浓度葡萄糖标准液于试管中,加入1 mL 6%苯酚和5 mL浓硫酸溶液,摇匀后静置20 min,于波长490 nm处测定吸光度,绘制标准曲线并求出回归方程。样品测定:将多糖溶解于去离子水中(50 ℃,2 h),离心(12 000 r/min,10 min,4 ℃),取2 mL上清液于试管中,加入1 mL 6%苯酚,以下操作同“标准曲线的绘制”,3 次重复取平均值,根据回归方程得出多糖质量浓度。多糖得率和多糖产量按公式(1)、(2)计算:

多糖产量/(g/L)=多糖得率/%×菌丝产量/(g/L) (2)
1.3.2 干巴菌多糖提取工艺的优化
1.3.2.1 PB试验
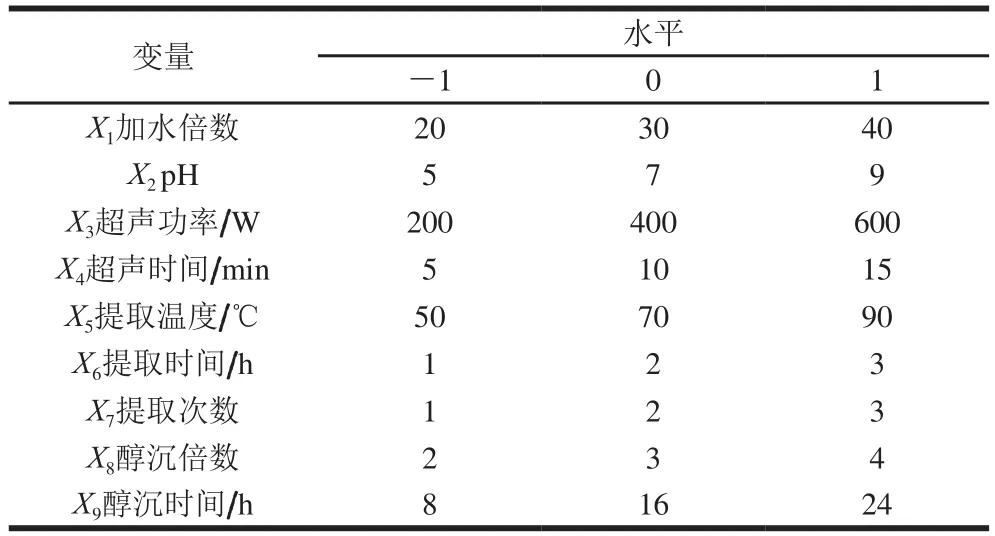
表1 PB试验因素和水平Table 1 Factors and levels used in PB design
选取影响干巴菌多糖得率的因素为响应变量(X),以干巴菌多糖得率为响应值(Y),用软件Design Expert 8.0.6设计PB试验,选出对多糖得率有显著影响的因素。PB试验选取因素和水平见表1。
1.3.2.2 响应面试验
根据Box-Behnken试验原理及PB试验结果,选取超声功率、超声时间、醇沉倍数作为响应变量(X),以干巴菌多糖的得率为响应值(Y),进行响应面试验分析。响应面试验因素和水平见表2。
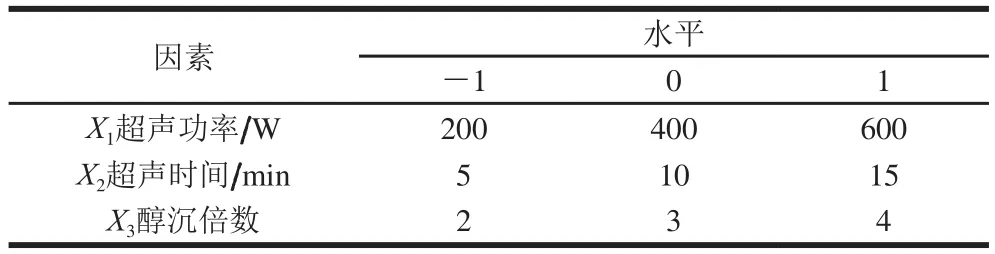
表2 响应面试验因素与水平Table 2 Factors and levels used in response surface design
1.3.3 多糖的纯化
将干巴菌多糖用去离子水溶解,离心(10 000 r/min,10 min,4 ℃),上清液采用Sevag法去蛋白(氯仿-正丁醇,5∶1,V/V)[20],重复多次,至乳化层消失且波长280 nm处无蛋白质吸收峰为止。用0.45 μm微孔滤膜过滤后加于DEAE-52纤维素阴离子交换柱(1.6 cm×30 cm)中,用0、0.05、0.1、0.3 mol/L的NaCl溶液进行洗脱,流速为1 mL/min,2 mL每管收集,用苯酚-硫酸法逐管进行检测,收集主要洗脱组分,冻干,溶解后加于Sephadex G-100葡聚糖凝胶柱(1.6 cm×50 cm)中,去离子水洗脱,流速为0.1 mL/min,2 mL每管收集,用苯酚-硫酸法逐管进行检测,并分别以管数为横坐标,吸光度为纵坐标绘制洗脱曲线。收集主要组分冻干,采用苯酚-硫酸法测定冻干组分的总糖含量。
1.3.4 FTIR分析
将干燥的多糖样品与KBr混合研磨后压片,用FTIR仪进行红外光谱测定,扫描范围4 000~400 cm-1,分辨率4 cm-1。
1.3.5 酶水解产物抗氧化能力的测定
1.3.5.1 酶水解产物的制备
分别称取适量干巴菌多糖于离心管中,加入10 mL去离子水,混匀,用乙酸缓冲液调节pH值为6。
纤维素酶水解:分别加入1%、5%、10%的纤维素酶,50 ℃水浴5 h(命名为EIPS-C1、EIPS-C2、EIPS-C3)。
蜗牛酶水解:分别加入1%、5%、10%的蜗牛酶,35 ℃水浴5 h(命名为EIPS-S1、EIPS-S2、EIPS-S3)。空白对照于50 ℃水浴5 h(命名为EIPS)。水解结束后,100 ℃水浴10 min,使酶失活,并调节pH值为7。离心(15 000 r/min,15 min,4 ℃)取上清液。
1.3.5.2 酶水解产物抗氧化能力的测定
还原力的测定[21]:取1 mL样品于试管中,加入2.5 mL磷酸钠盐缓冲液(pH 6.6,0.2 mol/L)和1 mL铁氰化钾溶液(10 g/L),混匀,50 ℃水浴20 min,然后加入2 mL三氯乙酸(100 g/L)和1.2 mL三氯化铁溶液(1 g/L),混匀后于波长700 nm处测定吸光度。用2,6-二叔丁-4-甲基苯酚作为阳性对照。
ABTS阳离子自由基清除能力的测定[22]:实验组:将ABTS溶液(7 mmol/L)和过硫酸钾溶液(4.9 mmol/L)等体积混合,避光静置20 h,用磷酸盐缓冲液(0.1 mol/L,pH 7.4)稀释,使其在波长734 nm处吸光度为0.7±0.02,即为ABTS工作液。取ABTS工作液3 mL,样品1 mL于试管中,室温避光反应6 min,于波长734 nm处测定吸光度A。实验对照组:将ABTS工作液换为磷酸钠盐缓冲液,测得吸光度为AC。空白对照组:将样品换为水,测得吸光度为AB。ABTS阳离子自由基清除率按公式(3)计算:
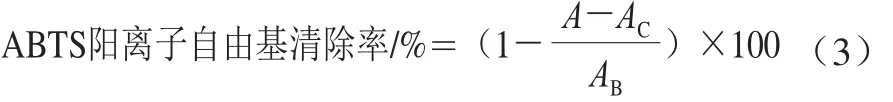
DPPH自由基清除能力的测定[23]:实验组:取2 mL样品和2 mL DPPH-乙醇溶液(0.2 mmol/L)于试管中,混合均匀后避光反应30 min,离心(5 000 r/min,10 min,4 ℃),上清液于波长517 nm处测定吸光度A。实验对照组:将DPPH-乙醇溶液换为乙醇溶液,测得吸光度为AC。空白对照组:将样品替换为去离子水,测得吸光度为AB。DPPH自由基清除率按公式(4)计算:
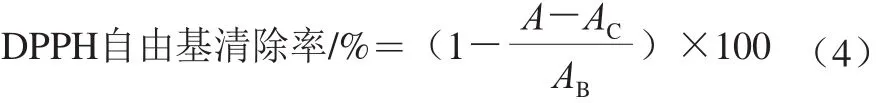
1.3.6 逐级酸水解产物抗氧化能力的测定
1.3.6.1 逐级酸水解产物的制备
分别称取适量干巴菌多糖于7 只安培瓶中(编号依次为1~7号),1~6号管加入10 mL硫酸溶液,按表3进行处理,使酸水解强度逐级提高,充入氮气并封口,置于100 ℃水浴中,分别命名为AIPS-1~AIPS-6。7号空白对照加入去离子水,50 ℃处理2 h(命名为AIPS)。水解结束后,离心(15 000 r/min,15 min,4 ℃)取2 mL上清液,用NaOH溶液(2 mol/L)调节pH值至7,定容至5 mL,离心(15 000 r/min,15 min,4 ℃),上清液即为逐级酸水解产物。
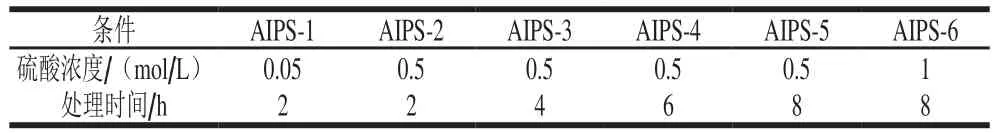
表3 硫酸处理浓度及时间Table 3 Concentrations and times of sulfuric acid treatment
1.3.6.2 逐级酸水解产物抗氧化能力的测定
还原力、ABTS阳离子自由基清除能力、DPPH自由基清除能力的测定:方法同1.3.5.2节。
总抗氧化能力的测定:向试管中加入0.2 mL样品和2 mL的P溶液(含0.6 mol/L硫酸、28 mmol/L磷酸钠、4 mmol/L钼酸铵),95 ℃水浴90 min,于波长695 nm处测吸光度。
超氧阴离子自由基清除能力的测定[24]:向试管中加入1 mL样品溶液及2 mL Tris-HCl缓冲液(pH 8.2,50 mmol/L)混合均匀,25 ℃水浴20 min,结束后加入25 ℃水浴预热过的邻苯三酚溶液0.4 mL(5 mmol/L),迅速混匀并于波长325 nm处每隔20 s测定一次吸光度,持续3 min。以去离子水替代样品作为空白对照。超氧阴离子自由基清除率按公式(5)计算:
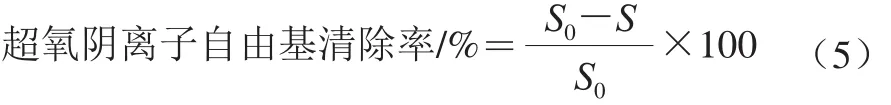
式中:S0为空白对照吸光度的斜率;S为样品吸光度的斜率。
羟自由基清除能力的测定[25]:向试管中依次加入1 mL硫酸亚铁溶液(9 mmol/L),1 mL水杨酸乙醇溶液(9 mmol/L),1 mL多糖样品,1 mL过氧化氢溶液(8.8 mmol/L)混合均匀,37 ℃水浴30 min,离心(5 000 r/min,10 min),取上清液于波长510 nm处测定吸光度A。VC作为阳性对照。羟自由基清除率按公式(6)计算:
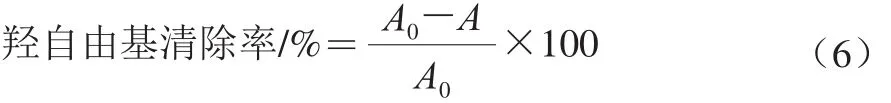
式中:A为样品的吸光度;A0为去离子水替代样品的吸光度。
1.3.7 多糖结构中单糖残基分布规律的测定
采用柱前衍生HPLC法分析逐级酸水解产物(AIPS-1~AIPS-6)中的单糖组成。配制2 mmol/L的单糖标准品溶液(甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖)。取50 μL单糖标准品溶液或待测样品(AIPS-1~AIPS-6)与50 μL PMP-甲醇溶液(0.5 mol/L)及50 μL NaOH(0.3 mol/L)混合均匀,70 ℃水浴30 min,冷却至室温,加入50 μL HCl(0.3 mol/L)和100 μL去离子水。向混合液中加入1 mL氯仿,涡旋混匀30 s随后静置5 min,吸取下层液弃去。从“加入1 mL氯仿”起重复操作4 次,即得衍生化的标准品或待测样品。
HPLC条件:流速为1 mL/min;检测波长为245 nm;进样量为20 μL;流动相为醋酸铵缓冲溶液(pH 5.5)-乙腈(77∶23,V/V)。根据逐级酸水解产物中的单糖种类及其物质的量含量绘制单糖残基的物质的量百分含量解离过程图,分析多糖结构中单糖残基的分布规律,按公式(7)计算单糖残基的物质的量百分含量:

1.4 数据处理与分析
实验数据采用Excel软件作图并进行统计学分析,组间比较采用t检验,P<0.05,差异显著。
2 结果与分析
2.1 干巴菌产糖培养基的优化
利用不同液体培养基培养干巴菌,液体发酵7 d后的菌丝体产量、多糖产量、pH值以及残糖含量见图1。
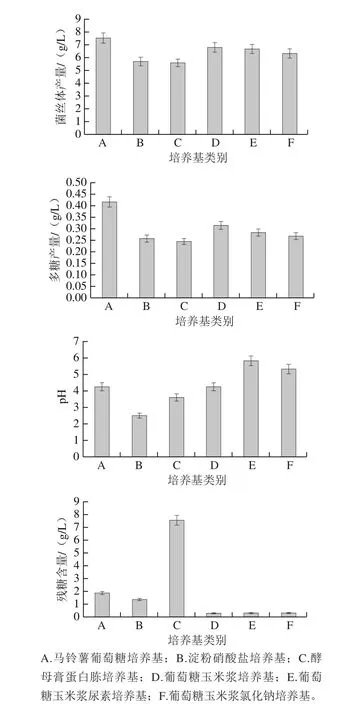
图1 培养基成分对干巴菌多糖产量的影响Fig. 1 Effect of medium composition on polysaccharide yield
由图1可知,采用不同液体发酵培养基培养干巴菌,多糖产量由高到低为:马铃薯葡萄糖培养基(A)>葡萄糖玉米浆培养基(D)>葡萄糖玉米浆尿素培养基(E)>葡萄糖玉米浆氯化钠培养基(F)>淀粉硝酸盐培养基(B)>酵母膏蛋白胨培养基(C)。其中,马铃薯葡萄糖培养基的多糖产量极显著高于其他培养基(P<0.01)。采用该培养基培养干巴菌7 d后,菌丝体产量可达7.56 g/L,多糖产量可达0.42 g/L,发酵结束时pH值为4.28,残糖产量为1.88 g/L。另外,以葡萄糖和玉米浆为主要碳、氮源的培养基也可以使干巴菌较为理想的生长并产生多糖。而以淀粉和硝酸盐为主要碳、氮源的培养基,以酵母膏、蛋白胨和葡萄糖为主要碳、氮源的培养基不适合干巴菌的液体发酵培养。
2.2 干巴菌多糖提取工艺的优化
2.2.1 PB试验
2.2.1.1 PB试验设计及结果
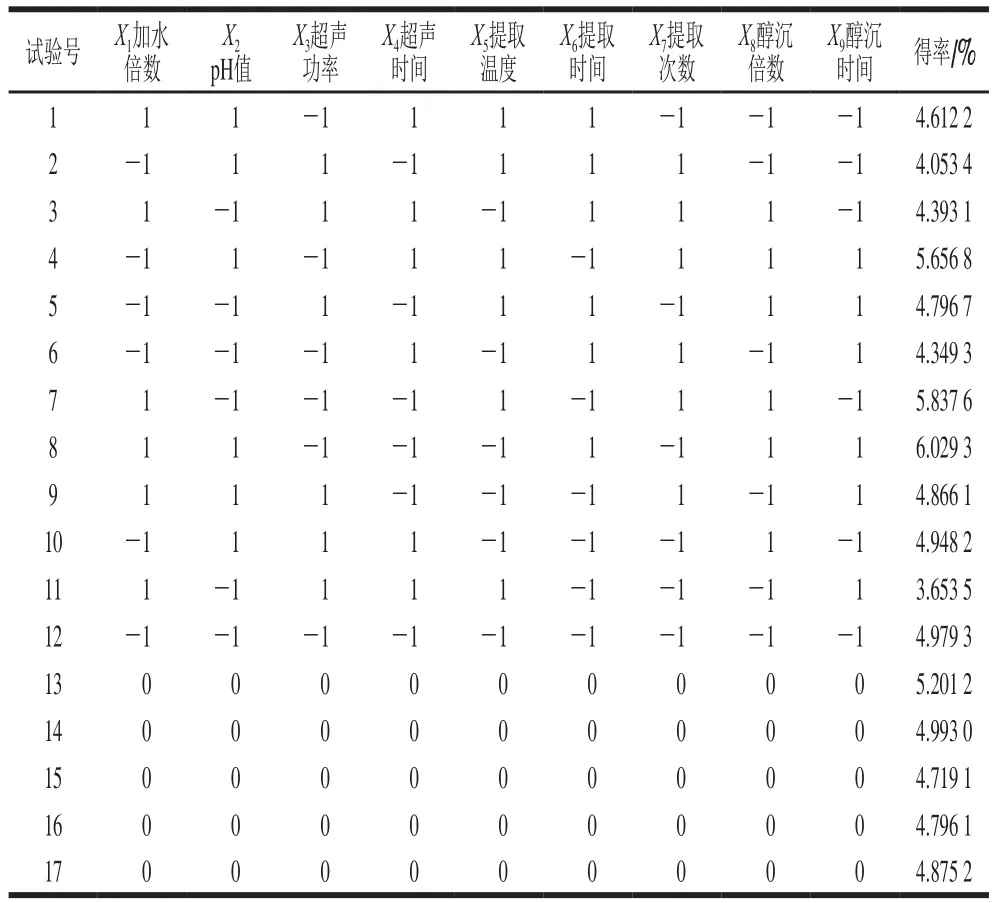
表4 PB试验设计及结果Table 4 PB design with experimental results
苯酚-硫酸法标准曲线的回归方程为y=0.009 2 x+0.152,R2=0.999 1。PB试验设计及结果见表4。对实验数据进行回归拟合,获得多元一次回归方程:Y=4.87+0.051X1+0.18X2-0.40X3-0.25X4-0.080X5-0.14X6+0.011X7+0.43X8+0.044X9,R2=0.963 9。
2.2.1.2 PB试验的回归模型方差分析
由表5可知,各因素对干巴菌多糖得率的影响顺序为:醇沉倍数>超声功率>超声时间>pH值>提取时间>提取温度>加水倍数>醇沉时间>提取次数。其中醇沉倍数、超声功率、超声时间为极显著因素,pH值和提取时间为显著因素,其余为不显著因素。模型显著(P<0.05),失拟值不显著(P>0.05),并且,决定系数R2为0.963 9,调整型决定系数R2Adj为0.917 4,说明方程模型可信度较高,模型在整个回归区域中拟合程度较好,能准确的描述实验结果。
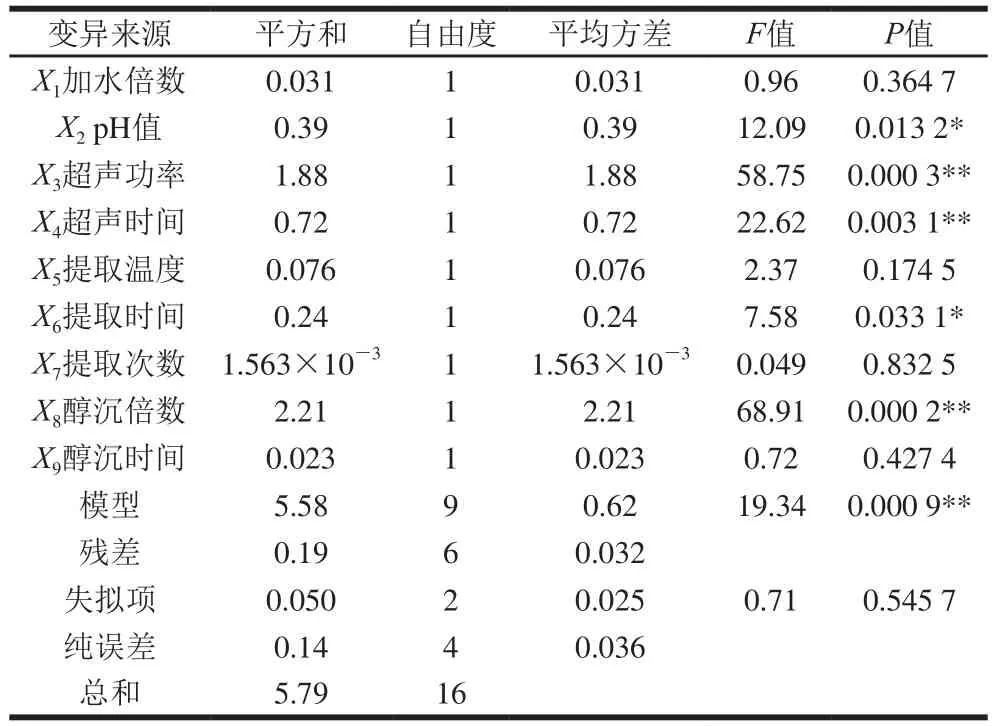
表5 PB试验的回归模型方差分析Table 5 Analysis of variance (ANOVA) for the regression model from PB experiment
2.2.2 响应面试验
2.2.2.1 响应面试验设计及结果

表6 响应面试验设计及结果Table 6 Response surface design with experimental and predicted polysaccharide yield
运用Design Expert 8.0.6软件对表6响应面试验数据进行多元回归拟合,获得二次多项回归方程:Y=6.77-0.039X1+0.091X2+0.15X3-0.096X1X2-0.047X1X3-0.029X2X3-0.68X12-1.03X22-0.57X32,R2=0.965 4。
2.2.2.2 响应面试验的回归模型方差分析
表7表明,二次项(X12、X22、X32)对干巴菌多糖的得率有极显著影响。模型极显著(P<0.01),失拟值不显著(P>0.05),R2为0.965 4,RA2dj为0.920 9,说明模型的拟合程度较好,可信度较高。
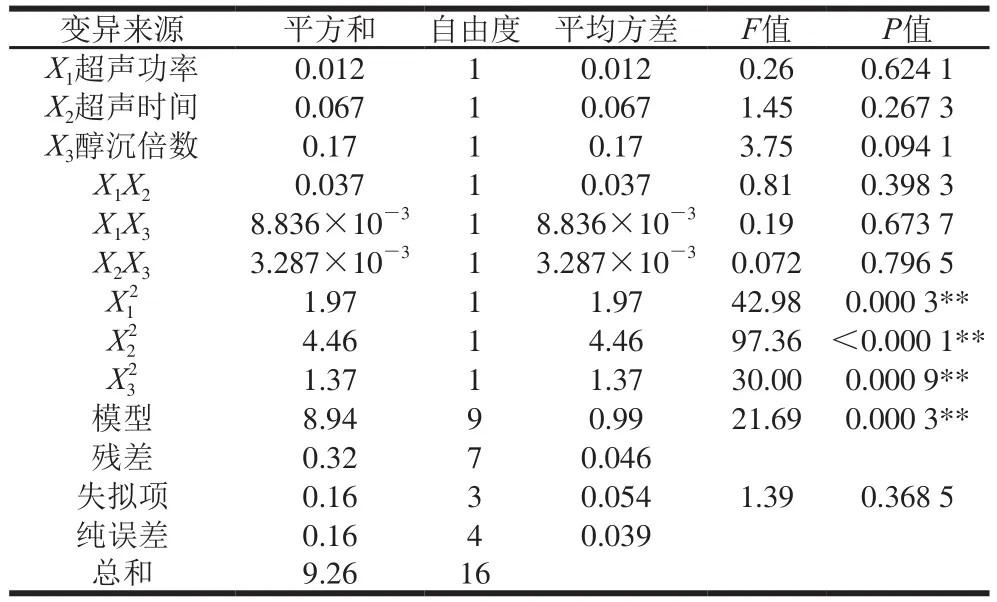
表7 响应面试验的回归模型方差分析Table 7 ANOVA for the regression model from response surface design
2.2.2.3 响应面图及等高线图
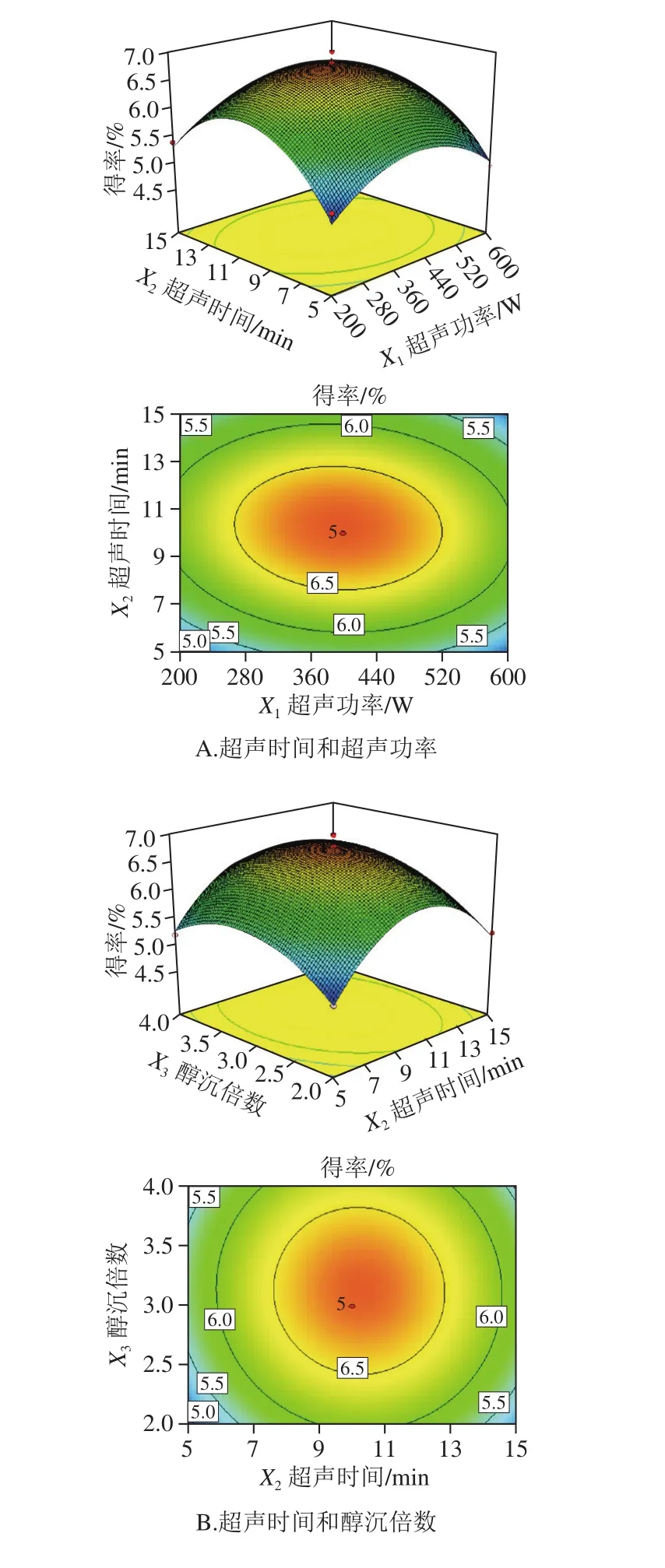
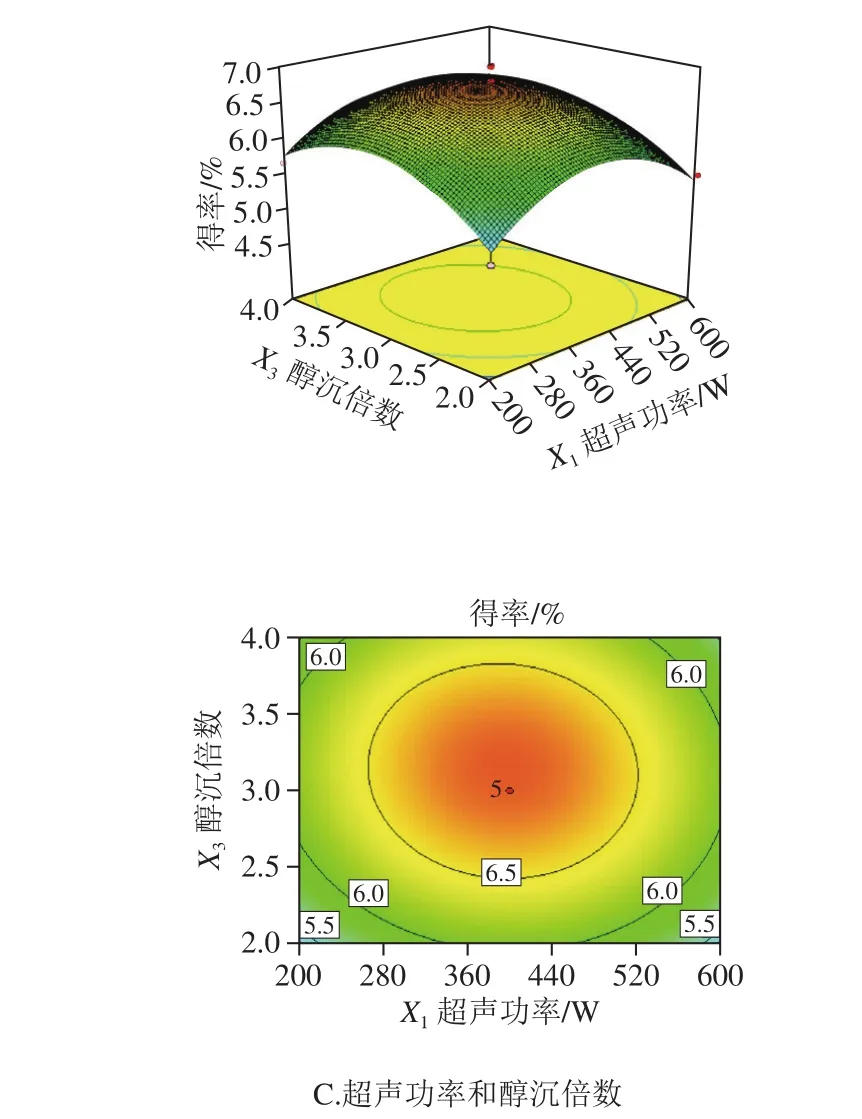
图2 各因素交互作用对多糖得率影响的响应面图及等高线图Fig. 2 Response surface plot and contour plot showing interactive effects of factors on polysaccharide yield
如图2所示,响应面均为开口向下的凸形曲面,说明响应值(Y)在响应变量(X)所选取的范围内存在最大值。由等高线图可以看出,超声时间和超声功率之间的相互作用较强,等高线图为椭圆形,而醇沉倍数与超声时间、醇沉倍数与超声功率之间的交互作用较弱。由响应面模型获得提取多糖的最优工艺条件为超声功率392.76 W、超声时间10.22 min、醇沉倍数3.13,预测提取率为6.78%。考虑到实际操作时的局限性,将工艺条件修正为超声功率400 W、超声时间10 min、醇沉倍数3 倍,在此条件下,干巴菌多糖的实际提取率为6.98%,与预测值基本一致。因此,通过Box-Behnken试验得到的最优提取工艺条件较为可靠,具有实际应用价值。
2.3 干巴菌多糖的纯化
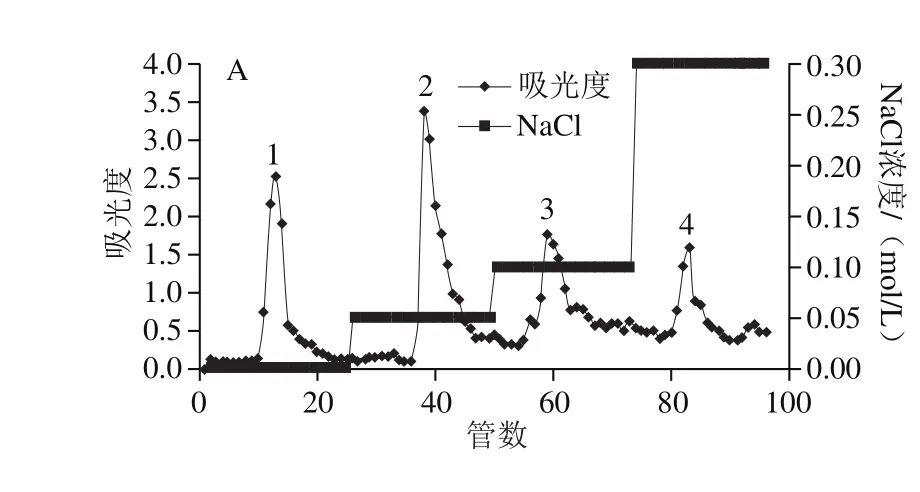
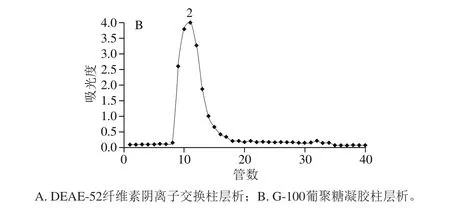
图3 干巴菌多糖的洗脱曲线Fig. 3 Elution curve of T. ganbajun Zang polysaccharides
如图3所示,干巴菌多糖经DEAE-52纤维素阴离子交换柱层析分离纯化后获得4 个纯化组分,其主要组分(2号组分)经G-100葡聚糖凝胶柱层析后为单个洗脱峰,表明2号组分分子大小相对均一,收集该组分冻干,并将其命名为IPS,IPS中总糖含量为916.36 mg/g。
2.4 FTIR测定结果
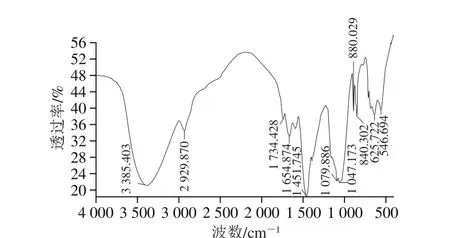
图4 FTIR光谱图Fig. 4 FTIR spectrum
由图4可知,IPS的FTIR光谱图表现出了多糖的典型特征吸收峰。3 600 cm-1和3 200 cm-1之间的强宽吸收峰表明存在O—H的伸缩振动[26]。2 900 cm-1附近的吸收峰由C—H键伸缩振动形成。1 734 cm-1附近的吸收峰是—COOH的C=O伸缩振动产生的,说明IPS含有糖醛酸[27]。1 654 cm-1处的吸收峰与C=O的伸缩振动有关。1 200~1 000 cm-1处的强吸收峰是由糖环振动、C—O—C糖苷键振动、C—OH侧基的伸缩振动叠加所致。880 cm-1和840 cm-1处的特征吸收峰表明IPS同时含有β-糖苷键连接的吡喃糖和α-糖苷键连接的吡喃糖[28-29]。
2.5 酶解产物的抗氧化活性
2.5.1 纤维素酶酶解产物的抗氧化活性
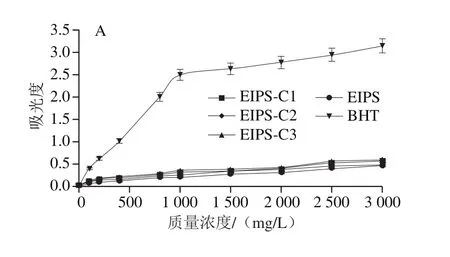
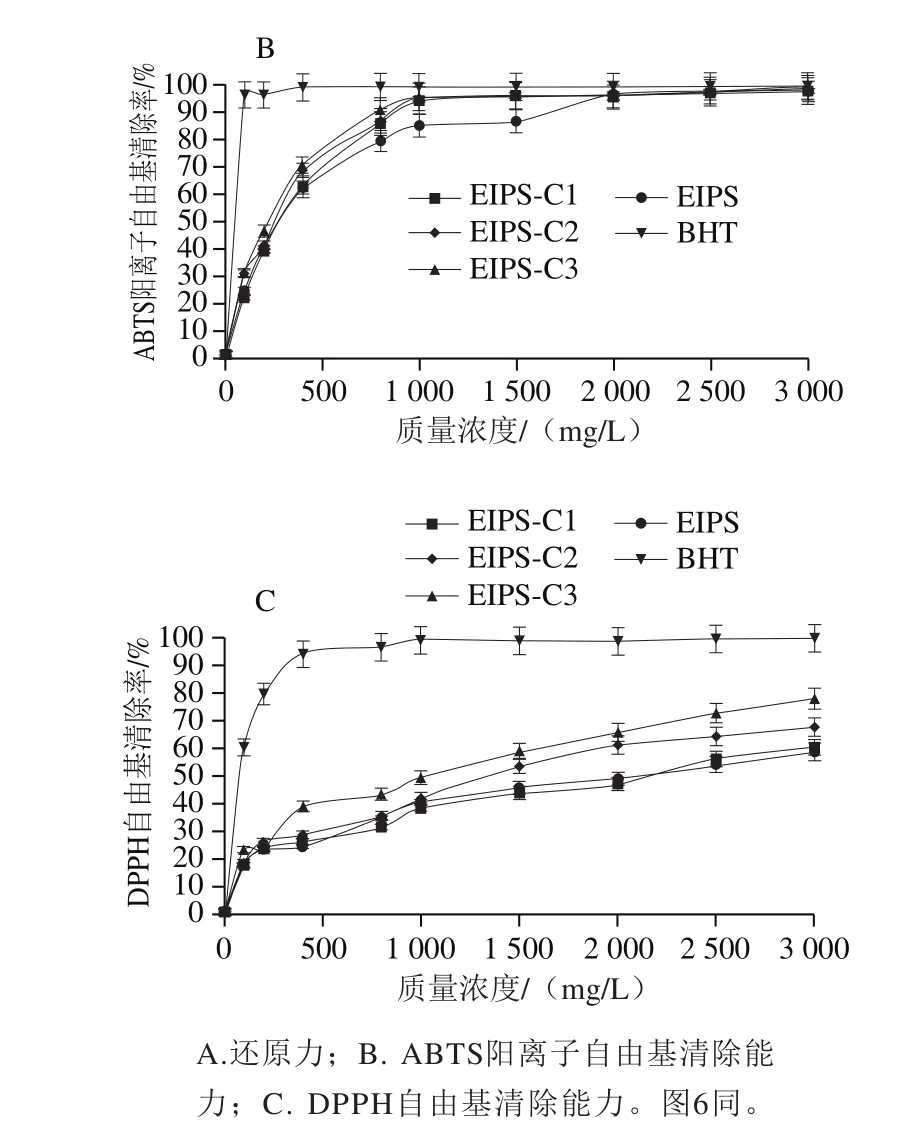
图5 EIPS及其纤维素酶酶解产物(EIPS-C1、EIPS-C2、EIPS-C3)的抗氧化能力Fig. 5 Antioxidant capacities of EIPS and its cellulase hydrolysates(EIPS-C1, EIPS-C2 and EIPS-C3)
由图5可知,EIPS及其纤维素酶酶解产物(EIPS-C1、EIPS-C2、EIPS-C3)的还原力、ABTS阳离子自由基清除能力和DPPH自由基清除能力随着酶添加量的增加而逐步提高。EIPS及EIPS-C1、EIPS-C2、EIPS-C3在3 000 mg/L质量浓度时的还原力分别为0.464、0.493、0.579、0.597。自由基的清除能力以EC50值表示,清除ABTS阳离子自由基的EC50值分别为290.59、292.08、265.75 mg/L和229.42 mg/L;清除DPPH自由基EC50值分别为2 066.63、2 147.93、1 335.97 mg/L和1 014.97 mg/L。EIPS-C3的还原力较EIPS提高24.78%(P<0.01),EIPS-C3清除ABTS阳离子自由基、清除DPPH自由基的EC50值较EIPS分别降低21.05%(P<0.01)、50.89%(P<0.01)。
2.5.2 蜗牛酶酶解产物的抗氧化活性
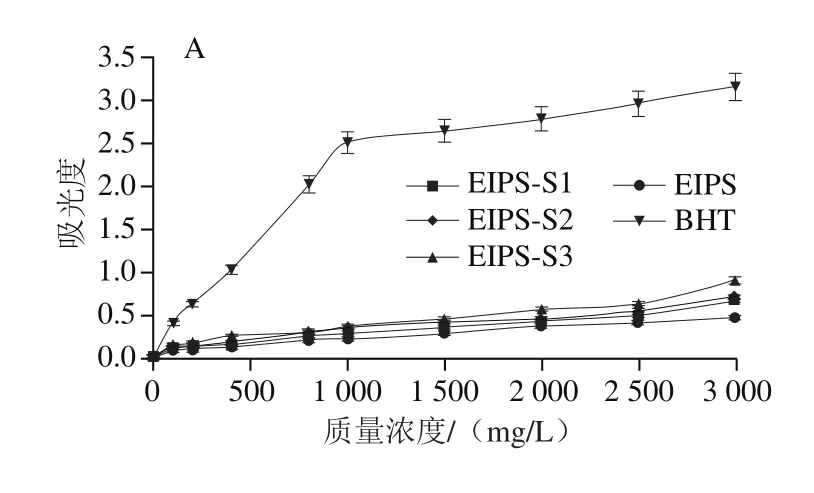
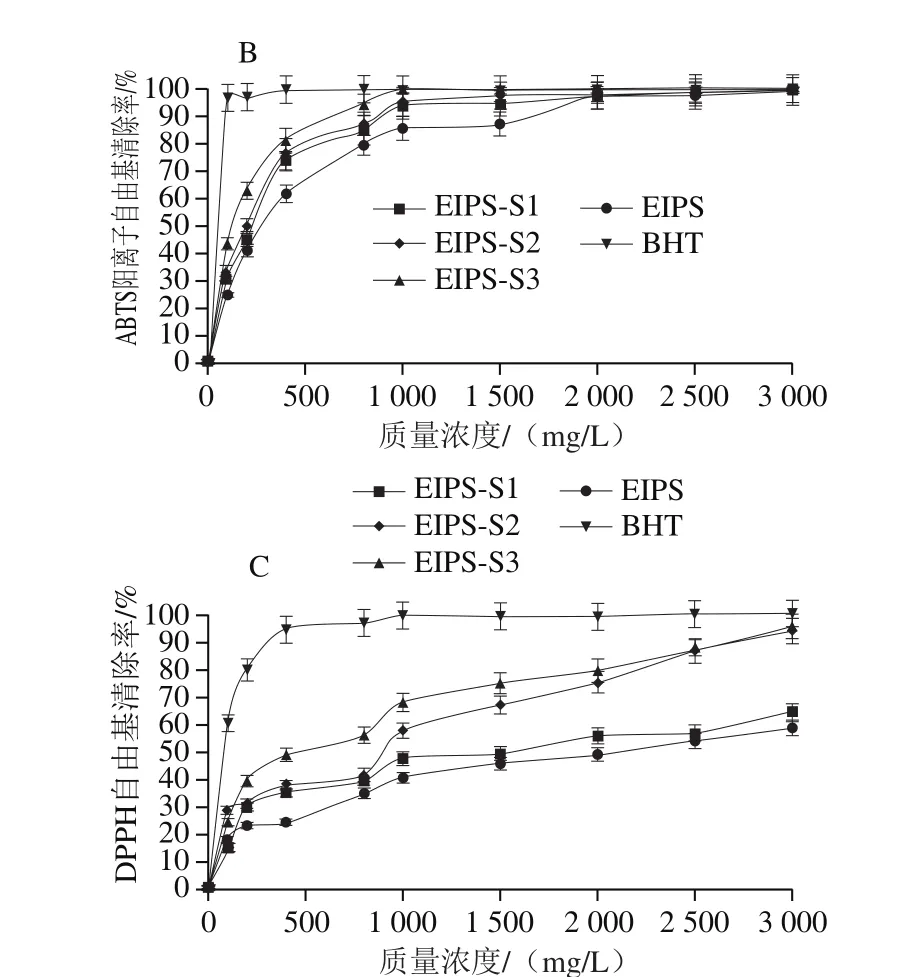
图6 EIPS及其蜗牛酶酶解产物(EIPS-S1、EIPS-S2、EIPS-S3)的抗氧化能力Fig. 6 Antioxidant capacities of EIPS and its snailase hydrolysates(EIPS-S1, EIPS-S2 and EIPS-S3)
由图6可知,EIPS及其蜗牛酶酶解产物(EIPS-S1、EIPS-S2、EIPS-S3)的还原力、ABTS阳离子自由基清除能力和DPPH自由基清除能力和酶的添加量之间表现出了明显的量效关系。EIPS及EIPS-S1、EIPS-S2、EIPS-S3在3 000 mg/L质量浓度时的还原力分别为0.464、0.658、0.711、0.894;清除ABTS阳离子自由基的EC50值分别为287.59、234.38、198.85 mg/L和133.07 mg/L;清除DPPH自由基EC50值分别为2 066.63、1 538.74、898.74 mg/L和449.44 mg/L。EIPS-S3的还原力较EIPS提高92.67%(P<0.01),EIPS-S3清除ABTS阳离子自由基、清除DPPH自由基的EC50值较EIPS分别降低53.73%(P<0.01)、78.25%(P<0.01)。
由图5、6可知,利用纤维素酶或蜗牛酶处理多糖后,多糖的抗氧化能力均有一定程度的提高。其原因包括以下2 个方面:一方面,多糖的生物活性与其分子大小及空间结构密切相关,分子质量过大或分支过多均不利于多糖生物活性的发挥[30-31],纤维素酶和蜗牛酶可以断裂多糖链中的共价键,使其成为具有适中主链长度、支链频率、分子质量的多糖。另一方面,多糖链的断裂能增加水解产物中具有还原性的活性端基数量,从而提高酶水解产物的抗氧化能力。
纤维素酶的酶切位点为β(1→4)糖苷键,蜗牛酶的酶切位点一般为β(1→3)糖苷键。比较可知,蜗牛酶较纤维素酶具有更明显的处理效果,其原因可能为蜗牛酶是包含纤维素酶、半纤维素酶、α-淀粉酶等酶类的混合酶,多糖含有更多的蜗牛酶酶切位点。因此,该多糖结构中含有β(1→4)糖苷键,并且可能含有β(1→3)糖苷键。
2.6 逐级酸解产物的抗氧化活性
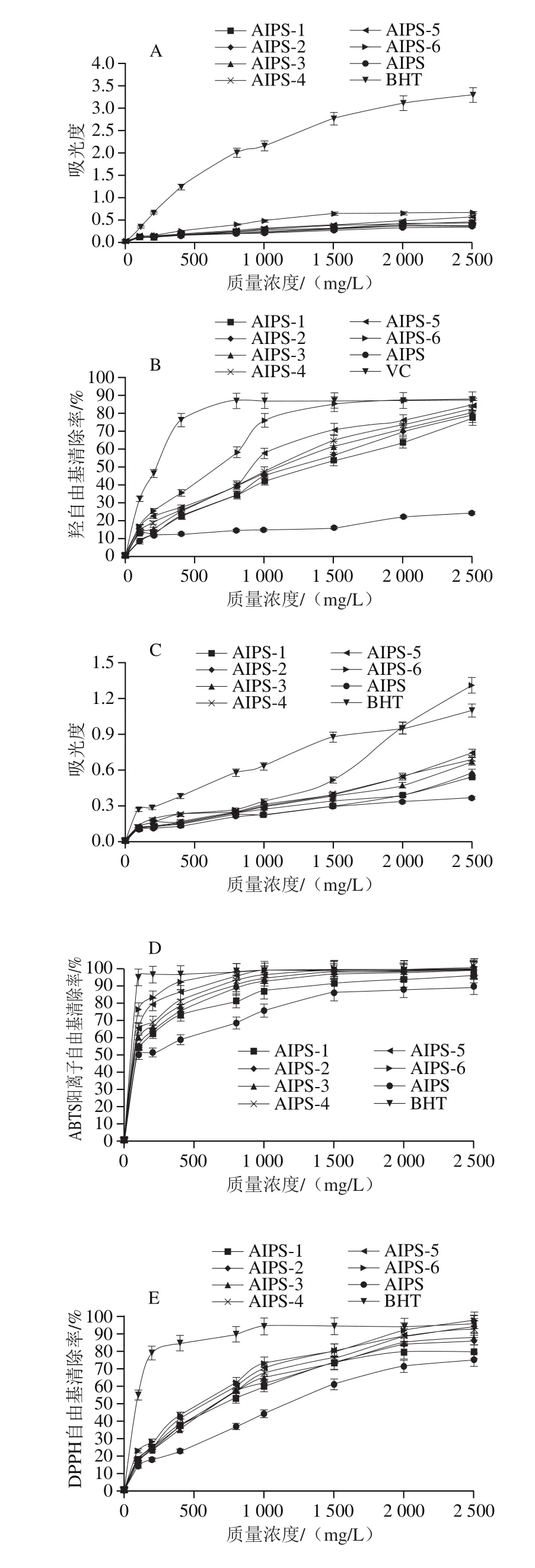
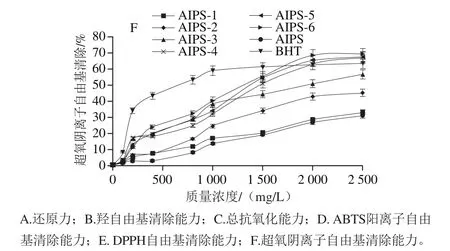
图7 AIPS及其酸解产物(AIPS-1、AIPS-2、AIPS-3、AIPS-4、AIPS-5、AIPS-6)的抗氧化能力Fig. 7 Antioxidant capacities of AIPS and its acid hydrolysates (AIPS-1,AIPS-2, AIPS-3, AIPS-4, AIPS-5 and AIPS-6)
由图7可知,AIPS及其逐级酸解产物(AIPS-1、AIPS-2、AIPS-3、AIPS-4、AIPS-5、AIPS-6)的还原力、总抗氧化能力、自由基清除能力随着酸水解强度的增强而逐步提高。AIPS及酸解产物AIPS-6在2500 mg/L时的还原力分别为0.367、0.670,酸解后AIPS-6较AIPS提高了82.56%(P<0.01);总抗氧化能力分别为0.37、1.31,酸解后提高了254.05%(P<0.01);清除DPPH自由基EC50值分别为1 162.81 mg/L和554.86 mg/L,酸解后降低了52.28%(P<0.01);清除ABTS阳离子自由基的EC50值分别为100 mg/L和65.42 mg/L,酸解后降低了34.58%(P<0.01);AIPS清除羟自由基的能力和清除超氧阴离子自由基的能力较弱,在质量浓度小于2 500 mg/L时没有达到EC50值(即EC50值>2 500 mg/L),而AIPS-6的EC50值达到572.93 mg/L和1 389.64 mg/L,较AIPS有了明显提高(P<0.01)。因此,酸水解处理可以显著提高多糖的抗氧化能力,并且在一定范围内酸水解强度越强抗氧化能力越高。
2.7 多糖结构中单糖残基分布规律的分析
多糖在水解过程中其单糖残基的解离规律与多糖结构密切相关,处于支链末端及支链外侧的单糖残基更容易被水解游离出来,反之处于主链及支链内侧中的单糖残基较难水解游离。本研究通过逐渐提高水解强度获得逐级酸解产物,并检测逐级酸解产物中单糖种类及其含量,绘制单糖残基的物质的量百分含量解离过程图,进而分析单糖残基在多糖结构中的分布。柱前衍生HPLC图及单糖残基的物质的量百分含量解离过程见图8、9。
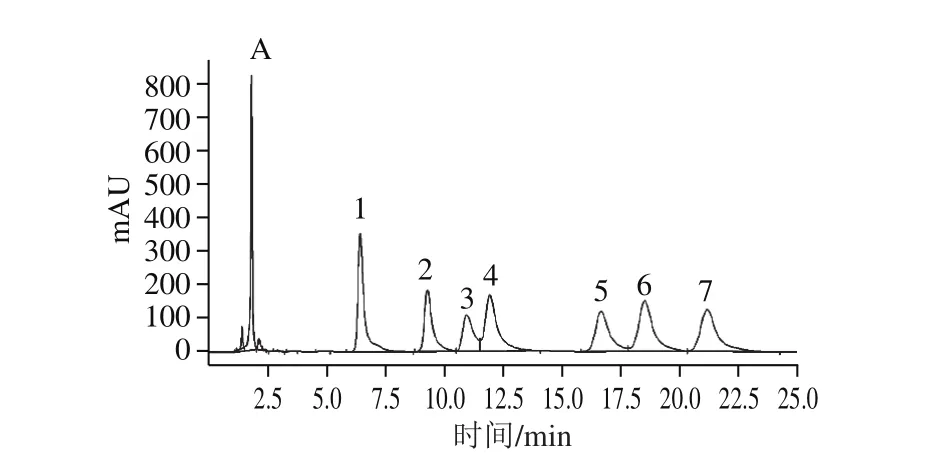

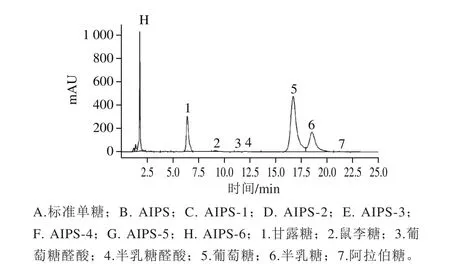
图8 逐级酸解产物的柱前衍生HPLC图Fig. 8 Pre-column derivatization HPLC of stepwise acid hydrolysates
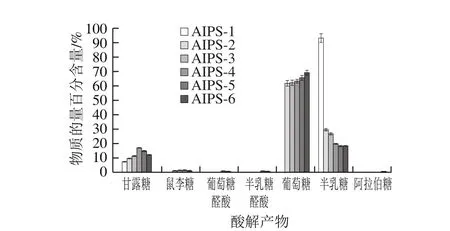
图9 单糖残基的物质的量百分含量解离过程图Fig. 9 Monosaccharide composition (in molar percentage) of stepwise acid hydrolysates
如图8、9所示,AIPS几乎不含游离单糖,只含有极微量的甘露糖。随着硫酸浓度的提高和水解时间的延长,酸水解产物中游离出的单糖逐渐增多,并呈现出一定的规律性。低强度酸水解时,半乳糖和甘露糖最先游离出来,说明半乳糖和甘露糖构成多糖的支链末端残基,并且末端残基主要由半乳糖构成。随着水解强度增大,半乳糖在所有单糖中所占的物质的量比例逐渐降低,由93.03%下降到17.91%,说明半乳糖主要分布于支链外侧及支链末端位置;葡萄糖的物质的量比例由61.57%上升到68.84%,说明葡萄糖是多糖的主要单糖成分,并且葡萄糖更多的分布于支链内侧及主链核心位置;甘露糖随着水解强度的增加表现出先上升后下降的趋势,由6.97%上升到16.62%然后下降到11.83%,说明甘露糖更多的分布于支链内侧。另外,干巴菌胞内多糖还含有微量鼠李糖、葡萄糖醛酸、半乳糖醛酸及阿拉伯糖,这些单糖残基零星的分布于糖链中。
3 结 论
马铃薯葡萄糖培养基是干巴菌的最适产糖培养基,干巴菌在该培养基中生长旺盛,培养7 d后菌丝体产量为7.56 g/L,多糖产量为0.42 g/L。采用PB试验及响应面试验优化干巴菌多糖的提取工艺,结果表明,极显著影响因素及其最优条件为超声功率400 W、超声时间10 min、醇沉倍数3 倍,在该条件下干巴菌多糖的得率可达6.98%。FTIR分析表明,干巴菌多糖的构型为β-糖苷键和α-糖苷键连接的吡喃糖。体外抗氧化实验表明,干巴菌多糖具有良好的抗氧化活性,并且利用纤维素酶、蜗牛酶和硫酸水解多糖可以使多糖的抗氧化能力显著增强,水解强度与抗氧化能力呈现出明显的量效关系。由酶解实验可以推测多糖结构中含有β(1→4)糖苷键,并且可能含有β(1→3)糖苷键。逐级酸水解结合柱前衍生HPLC法分析多糖结构发现:支链末端残基以半乳糖为主,并含有部分甘露糖;半乳糖大多分布于支链外侧及支链末端位置;葡萄糖是其主要单糖成分,主要分布于支链内侧及主链核心位置;甘露糖在支链内侧分布较多;另有微量葡萄糖醛酸、半乳糖醛酸及阿拉伯糖零星的分布于糖链中。该方法通过绘制多糖水解过程中单糖残基的物质的量百分含量解离过程图直观地反映了多糖结构,创新了多糖结构的分析方法。因此,本研究为干巴菌菌丝体多糖的资源化利用提供了理论基础,并且发现酶水解和酸水解是提高多糖活性、分析多糖结构的有效方法。

