微滴式数字PCR定量检测杏仁露中杏仁、花生源性成分
郭楠楠,张 岩,李永波,张 涛,张雅伦,周 巍,*,王 红,,*
(1.河北师范大学生命科学学院,河北 石家庄 050024;2.河北省食品检验研究院,河北省食品安全重点实验室,河北 石家庄 050071)
植物蛋白饮料目前已成为饮料市场上不可或缺的产品,“天然、绿色、营养、健康”的特征使其越来越受消费者的喜爱,拥有广阔的消费市场[1]。与此同时,一些不法商家为谋取利益在植物蛋白饮料中掺杂使假、以次充好,欺骗消费者,扰乱市场秩序等质量安全问题受到了社会的广泛关注。传统的定性检测方法难以准确甄别掺假程度,因此建立精准的定量分析检测方法意义重大。
在食品安全检测领域,应用较为广泛的分子生物学技术主要包括聚合酶链式反应(polymerase chain reaction,PCR)技术、DNA条形码技术和实时荧光PCR技术等。常规PCR技术灵敏度高、特异性好[2],DNA条形码技术成本低、快速可靠[3],均被广泛用于食品中进行定性检测;实时荧光PCR技术不仅可用于定性检测,还可测定循环阈值(Ct值)和初始DNA模板浓度进行相对定量[4-5]。但这些技术却无法满足精准定量分析的需求,微滴式数字PCR(droplet digital PCR,ddPCR)的出现为食品安全检测带来了新的方案。ddPCR是准确定量核酸的一门新兴核酸扩增技术[6-7],其利用有限稀释分析和泊松分布分析来实现靶DNA拷贝数的绝对定量[8-10],被称为“第三代PCR”技术[11]。ddPCR不依赖标准曲线,对稀有事件检测准确、灵敏,广泛应用于拷贝数变异检测分析[12-13]、单核苷酸多态性分析[14]、产前诊断[15-17]、转基因食品检测[18-20]和微生物检测[21-23]等。
ddPCR技术的兴起为解决食品的掺杂使假问题提供了思路,目前,ddPCR技术在肉源性食品真伪鉴别领域研究较多,而在植物源性食品真伪鉴别领域应用较少。在肉类掺假研究中,王珊等[24]建立了羊肉制品中羊肉和猪肉的定量检测方法,完成了ddPCR技术和荧光PCR技术的比较;Cai Yicun[25]、苗丽[26-27]、陈晨[28]等分别研究猪肉和鸡肉产品、肉及肉制品中猪牛源和羊源成分、羊肉和猪肉制品的定量分析方法。在植物源性食品真伪鉴别中,杨硕等[1]采用多重ddPCR技术,通过单位质量下靶基因拷贝数之比换算植物源性成分投料比,完成了核桃露中核桃、大豆成分的定量检测研究。
本研究在前人的基础上探索植物及植物蛋白饮料(杏仁露)中杏仁和花生的定量检测方法,基于ddPCR技术建立两物种质量与拷贝数之间的计算公式,进行特异性、人为掺假样品和市售样品的检验,确定该方法的准确性和适用性,达到定量分析和甄别掺假的目的。
1 材料与方法
1.1 材料与试剂
杏仁、花生购自石家庄大型超市;10 个品牌12 个批次的杏仁露购自石家庄大型超市和农贸市场。
深加工食品DNA提取试剂盒(非离心柱型) 天根生化科技(北京)有限公司;氯仿 北京酷来博科技有限公司;异丙醇、无水乙醇(均为分析纯) 天津市科密欧化学试剂有限公司。
1.2 仪器与设备
ME204/02电子天平 梅特勒-托利多仪器(上海)有限公司;分析研磨机 德国IKA公司;AdVantage Pro真空冷冻干燥机 美国VirTis公司;Milli-Q Integral 3纯水/超纯水一体化系统 美国Millipore公司;SHA-AD恒温振荡器 金坛市华城敏科实验仪器厂;1-15PK冷冻离心机 德国Sigma公司;NanoDrop 2000微量核酸蛋白测定仪 美国Thermo公司;QX200 ddPCR微滴生成仪、微滴读取仪、S1000 thermal cycler基因扩增仪 美国Bio-Rad公司。
1.3 方法
1.3.1 样品制备
杏仁、花生:用分析研磨机进行初步研磨于超低温真空冷冻干燥机中冻干,用液氮进行破碎处理研磨成超细的粉末,此样品用作本研究的模板样品及掺假模型的制备。
市售杏仁露:分装于玻璃容器内于超低温真空冷冻干燥机中冻干,用液氮进行破碎处理研磨成超细的粉末,此样品用于实际检测分析。
样品制备过程中注意防止交叉污染。
1.3.2 DNA提取
梯度称取10~100 mg杏仁、花生的模板样品,采用优化的深加工食品DNA提取试剂盒法进行DNA的提取:1)取梯度称取的模板样品至灭菌离心管中,加入500 μL的缓冲液GMO1和20 μL的Proteinase K(20 mg/mL),振荡混匀;2)56 ℃孵育1 h,其间每隔15 min上下颠倒混匀一次;3)加入200 μL缓冲液GMO2和400 μL氯仿,振荡混匀,静置10 min;4)12 000 r/min离心5 min,小心吸取上清液;5)向上清液中加入0.7 倍体积的异丙醇,充分混匀后12 000 r/min离心3 min,小心弃上清液;6)加入700 μL 70%的乙醇溶液,涡旋振荡5 s,12 000 r/min离心2 min,弃上清液;7)重复6);8)于室温开盖放置,晾干残留的乙醇;9)加入50 μL洗脱缓冲液TE,吹吸混匀,即可得到基因组DNA溶液,储存于-20 ℃备用。
1.3.3 特异性引物和探针
根据GenBank中公布的杏仁过敏源性成分Pru du1基因序列,通过软件Primer 5.0和PRIMER设计杏仁源性的特异性引物和探针序列Almond1~5;花生源性和真核生物18S rRNA内参照基因的引物和探针序列参考国家出入境检验检疫行业标准[29-30]。本实验所用引物和探针(表1)均由生工生物工程(上海)股份有限公司合成。

表1 引物和探针序列Table 1 Sequences of primers and probes used in this study
1.3.4 微滴式数字PCR反应程序
20 μL反应体系:ddPCRTMSupermix for Probes(no dUTP)10 μL,上下游引物各1.2 μL(900 nmol/L),探针0.4 μL(250 nmol/L),DNA模板4 μL,剩余用ddH2O补足。用微滴发生器生成微滴,进行普通PCR反应。PCR反应条件:95 ℃、10 min;94 ℃、30 s,60 ℃、1 min,40 个循环;98 ℃ 10 min。最后用微滴分析器分析扩增产物。发生微滴过程中注意避免产生气泡。
1.3.5 特异性分析
基于实时荧光PCR和数字PCR技术对特异性设计序列进行初步筛选,将初筛所得引物以无菌双蒸水作为空白对照,分别选用植物源性物种杏仁、花生、核桃、大豆、榛果、芝麻、腰果、开心果、松子、葵花籽的DNA为模板进行数字PCR检测,验证引物的特异性。
1.3.6 杏仁和花生质量与拷贝数计算公式的确定
1.3.6.1 两物种质量与DNA含量的关系
分别准确称取10 个质量梯度的杏仁和花生(质量依次从10~100 mg)样品,提取植物基因组DNA,用NanoDrop 2000测定所提DNA的浓度。每个梯度实验进行3 次重复。相关系数R2用Origin 9分析生成。
1.3.6.2 两物种DNA含量与DNA拷贝数的关系
为摸索DNA含量与拷贝数的线性关系,将提取好的杏仁和花生DNA进行梯度稀释,分别稀释为5、10、20、30、40、50、60、70、80、90、100 ng/μL,以ddH2O为空白对照,取4 μL DNA进行ddPCR检测。每个梯度实验进行3 次重复。相关系数R2用Origin 9分析生成。
1.3.7 方法验证实验
为验证所建立的ddPCR方法的准确性,在80 mg的质量范围内建立杏仁和花生已知混合比例的掺假模型(杏仁和花生的最低质量分数均为6.25%),按1.3.2节的方法提取各混合样品的DNA,将提取的DNA进行30 倍稀释,取4 μL进行ddPCR检测,进行3 次重复。
1.3.8 检测方法的实际应用
10 个不同品牌12 个批次的杏仁露,按1.3.1节的方法进行前处理,按1.3.2节的方法提取DNA,用建立的ddPCR定量分析方法对杏仁露中杏仁和花生源性成分的质量进行检测分析,进行3 次重复,进一步验证本研究所建方法的准确性和实际适用性。
1.4 数据分析
采用Origin 9对实验数据进行统计学分析和图表绘制。
2 结果与分析
2.1 植物源性分析
用真核生物18S rRNA通用引物分别对杏仁、花生模板样品和12 个市售样品的DNA进行普通PCR扩增,并进行2%琼脂糖凝胶电泳。如图1所示,空白对照、阴性对照均未出现扩增条带,杏仁、花生和样品DNA均出现大小140 bp左右的目的条带,证明DNA提取成功,适宜进行后续PCR扩增反应。

图1 植物源性成分通用引物PCR结果Fig. 1 PCR results obtained with the 18S rRNA primers and probe
2.2 引物和探针的特异性检测结果
基于实时荧光PCR技术对杏仁引物进行初步筛选,结果显示引物Almond1、2 对杏仁模板DNA均有明显扩增曲线;将这2 对引物以杏仁DNA为模板进行ddPCR检测分析,结果显示引物Almond1能更好地区分阴、阳性微滴,初步确定Almond1为杏仁的特异性引物。在此基础上,选择多种常见植物物种作为DNA模板对杏仁、花生引物进行进一步的特异性检测分析,ddPCR结果(图2、3)显示本研究选用的杏仁和花生的引物和探针特异性良好,与其他植物物种均无交叉反应,适用于杏仁和花生的定量检测。
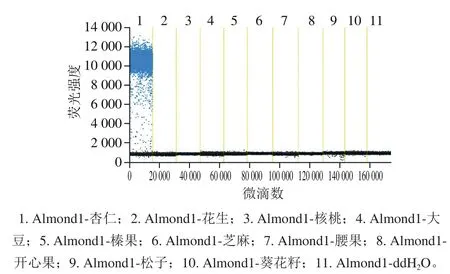
图2 杏仁引物和探针的特异性检测Fig. 2 Specificity evaluation of apricot kernel primer-probe system
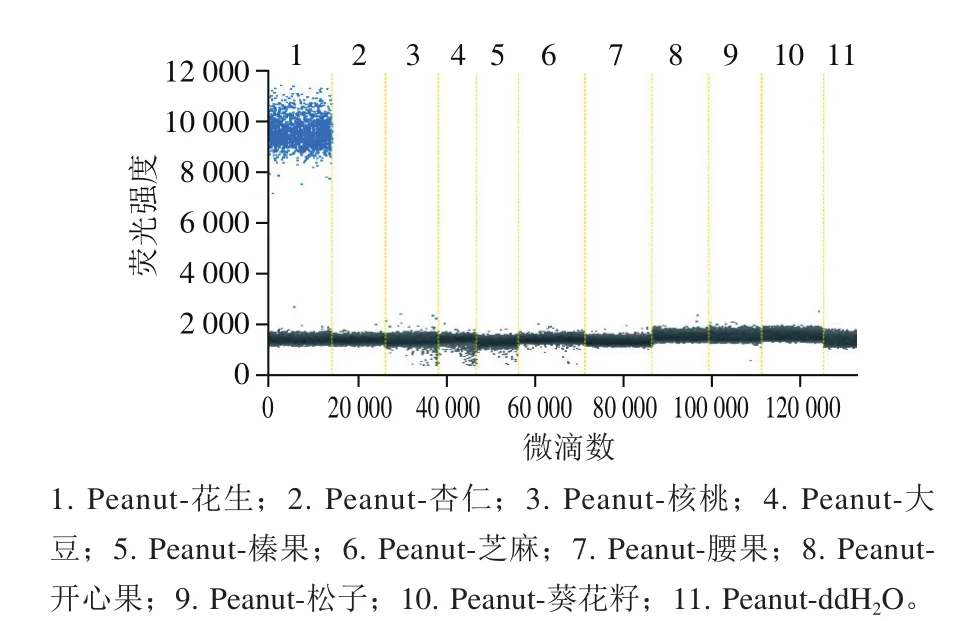
图3 花生引物和探针的特异性检测Fig. 3 Specificity evaluation of peanut primer-probe system
2.3 DNA提取及含量的测定结果
为考察杏仁、花生质量与DNA含量的关系,各提取10 个质量梯度(10~100 mg)杏仁和花生的DNA,测得DNA含量。每个梯度各重复测得DNA含量的变异系数最大为4.13%,差异较小。取3 次重复实验的平均值进行线性拟合,结果显示杏仁在10~100 mg的质量范围内与DNA含量呈明显的线性关系,花生在10~80 mg的质量范围内与DNA含量呈明显线性关系(图4)。两物种的质量与其DNA含量呈明显线性关系,杏仁和花生的相关性系数R2分别为0.997和0.994。

图4 杏仁(A)和花生(B)质量与DNA含量的关系Fig. 4 Linear relationship between plant quantity and nucleic acid contents of apricot kernel (A) and peanut (B)
2.4 DNA含量和DNA拷贝数的关系
将提取的杏仁、花生DNA分别进行梯度稀释,取4 μL稀释后的DNA进行ddPCR检测,每个梯度实验进行3 次重复,扩增结果如图5所示。每个梯度各重复所得DNA拷贝数的变异系数最大为4.72%,差异较小。取DNA拷贝数的平均值进行线性拟合,结果显示杏仁稀释质量浓度在5~50 ng/μL范围内、花生稀释质量浓度在5~100 ng/μL范围内,随着DNA含量的增加,DNA拷贝数相应增加,两者呈现一定的线性关系(图6),杏仁和花生线性相关系数R2分别为0.997和0.999。
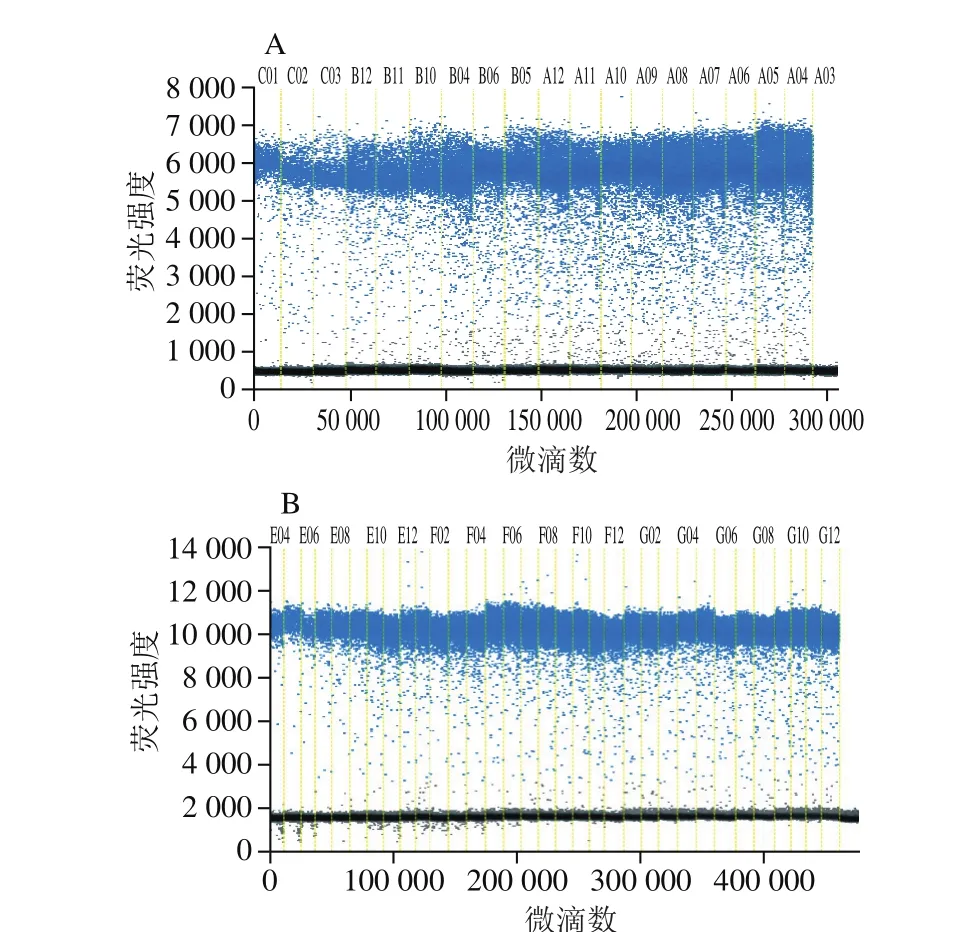
图5 梯度DNA含量条件下的杏仁(A)和花生(B)拷贝数Fig. 5 DNA copy numbers of apricot kernel (A) and peanut (B) at different nucleic acid contents

图6 杏仁(A)和花生(B)DNA含量与DNA拷贝数的关系Fig. 6 Linear relationship between nucleic acid content and DNA copy number of apricot kernel (A) and peanut (B)
2.5 杏仁和花生质量与拷贝数计算公式的建立
根据杏仁、花生质量和DNA含量、DNA含量和DNA拷贝数之间的线性关系,分别以DNA含量为中间换算值,计算得出两物种质量与DNA拷贝数之间的公式,M杏仁=0.13C+1.24,M花生=0.081C-0.63,其中,M为植物源性成分的质量(mg),C为DNA拷贝数(copies/μL)。
2.6 方法验证实验结果
分别提取已知比例混合样品的基因组DNA,30 倍稀释后,取4 μL进行ddPCR检测,进行3 次重复测定,分析各重复间变异系数,将测得的拷贝数取平均值代入本研究建立的计算公式中得到测得杏仁和花生的质量。结果显示,各重复间变异系数均小于15%,混合样品中杏仁、花生的测得值与实际值基本一致,最大相对误差为-12.86%(表2),在统计学许可范围内。通过对已知掺假模型的检测,验证本研究所建立的ddPCR精准定量方法的准确性,表明该方法可有效应用于对市售杏仁露样品的检测。

表2 已知比例掺假模型分析结果Table 2 Results of quantification of known samples
2.7 方法应用结果
利用本研究建立的ddPCR方法,对12 个市售杏仁露中的杏仁和花生源性成分进行检测分析,取3 次重复实验平均值进行计算,各重复间差异较小,变异系数均小于15%。如表3所示,实验测得杏仁露2的杏仁含量最高(90.93%),杏仁露3中未测得杏仁源性,杏仁露10、11中测得杏仁含量极少,杏仁露1、9中测得微量的花生,杏仁露12中测得杏仁含量较少(5.22%)而花生含量较多(47.61%)。这一系列的检测结果表明市售杏仁露中存在不同程度的掺假现象。
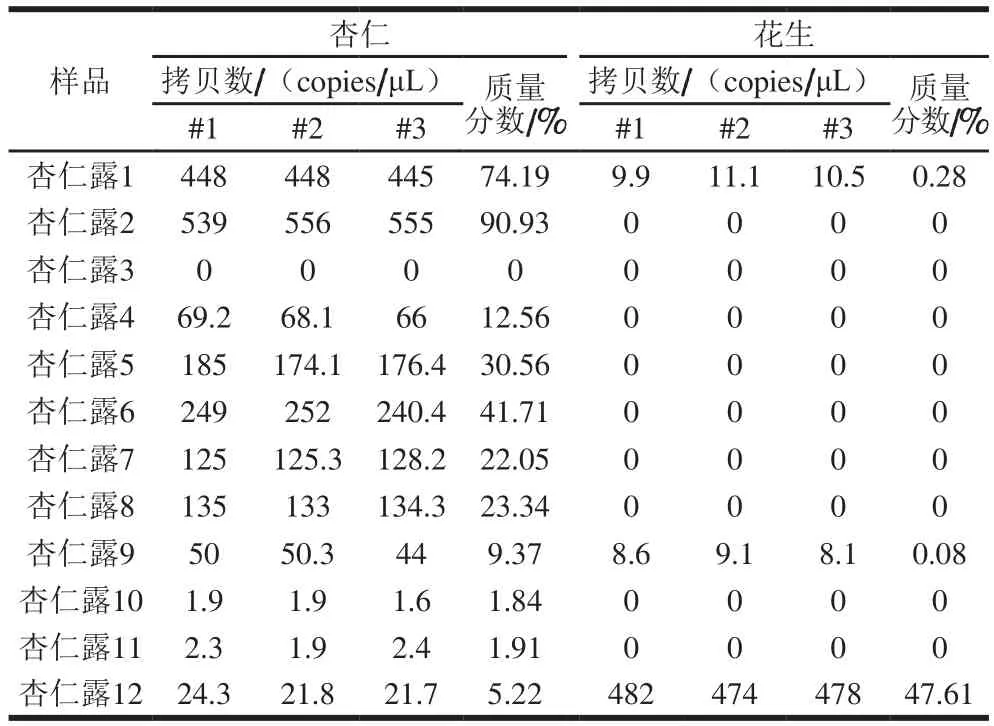
表3 市售样品检测结果Table 3 Detection of commercial samples
3 结论与讨论
本研究采用ddPCR技术探索杏仁露中杏仁和花生的定量检测方法,通过建立质量与DNA含量、DNA含量与DNA拷贝数之间的线性关系,换算出杏仁、花生质量与DNA拷贝数的计算公式,建立了可靠的定量分析方法。
本研究中将杏仁、花生原料和市售杏仁露进行冻干处理并研磨成粉,采用优化的深加工食品DNA提取试剂盒法提取DNA,提高了提取效率,且多次重复实验结果中杏仁、花生的质量与DNA含量均呈明显线性关系。该提取方法将原料与产品的提取方法一致化,保证了本研究所建立计算公式的适用性。
基于ddPCR技术建立了杏仁、花生的计算公式,通过已知比例掺假模型验证了该方法体系的准确性。在掺假模型中,混合样品的总质量为80 mg,杏仁和花生的最低掺入量均为5 mg(6.25%),混合样品中杏仁、花生的实验测得含量与其真实含量相差不大,其中人为掺入量越小相对误差值越大,最大误差为-12.86%。表明该方法能对杏仁、花生源性进行准确定量,可有效应用于市售杏仁露的定量检测。
对市售的10 个品牌12 个批次的杏仁露样品进行检测分析,其中,杏仁露2测得杏仁质量分数最高,占90.93%;杏仁露3中杏仁质量分数最低,为0%且并未测得花生源性,判断该样品可能掺假其他物种;杏仁露9测得杏仁质量分数不到10%;杏仁露10和11的杏仁质量分数极少,占2%左右;杏仁露12中测得杏仁质量分数为5.22%但花生质量分数为47.61%,可判断其为恶意掺假;杏仁露1和9中测得花生含量近乎为零,而实时荧光PCR检测1、9的结果均为检出花生源性成分,判断可能是生产过程中的无意带入而非恶意掺杂。检测结果表明市售杏仁露中存在掺假现象,且掺假程度不一,本研究建立的定量分析方法可准确区分恶意掺假与无意掺杂,适宜推广应用。
ddPCR的每个反应中,总微滴数均大于13 000,检测有效,确保了本研究中定量方法的准确性。
本研究中定量方法的建立、验证和实际应用中各重复实验之间差异较小,变异系数均小于15%,在统计学许可范围内。
本研究建立的ddPCR定量检测体系准确可靠、灵敏度高、重复性好,可有效甄别市售杏仁露中的无意掺杂和恶意假冒伪劣问题,适合用于常规的量化检测分析。该方法实现的精准定量检测,可有效保护植物源性成分过敏人群,打击制假掺假的不法商家,保护消费者权益,为植物蛋白饮料的市场监管提供了新思路。
与此同时,该方法也可应用于其他植物及植物蛋白饮料的定量检测,并有望实现多种植物源性成分的同时定量,建立更健全的定量检测体系,监控植物蛋白饮料的掺假问题,维持市场秩序,为市场监管提供技术保障。

