黄曲霉毒素分解酶基因克隆及其在大肠杆菌中的融合表达
李 旺 史敦胜 丁 轲 曹平华 赵龙妹
(河南科技大学动物科技学院,河南 洛阳 471023)
黄曲霉毒素(Aflatoxins,AFT)是一类化学结构类似的剧毒物质[1],主要由曲霉菌属的黄曲霉(Aspergillusflavus)、寄生曲霉(Aspergillusparasiticus)等真菌在一定的环境条件下生物合成的次级代谢产物[2-3],具有强烈的致畸、致癌和致突变作用[4-5]。AFT是各种粮食、食品和饲料中广泛存在的一类霉菌毒素,对全世界人类和动物的健康构成极大的威胁[6-8]。近年来微生物及其产生的分解酶对AFT进行生物抑制和降解的方法陆续被报道,其中黄曲霉毒素分解酶(Aflatoxin-detofizyme,ADTZ)是特异性分解黄曲霉毒素的活性物质[9-12]。但天然黄曲霉毒素分解酶,难以从菌株中分离,不同微生物菌种对AFT的降解作用机理还不明确,酶的活性不高,大部分对标准品黄曲霉毒素B1(AFB1)具有分解效果[9,13],而所筛选的酶对天然谷物等感染的黄曲霉毒素分解研究甚少。利用分子生物学和基因工程技术将ADTZ基因克隆,并在异源宿主中进行表达,可以获得明确的分解酶产物,提高ADTZ的产量和活性[14]。
本研究拟通过已报道[15]的ADTZ序列合成引物,扩增ADTZ基因,在大肠杆菌中融合表达,验证ADTZ基因是否可以进行异源表达,同时检测表达产物表达量并应用到对谷物中黄曲霉毒素的分解上,以期获得更高活性的ADTZ,对天然谷物中黄曲霉毒素的生物降解提供参考。
1 材料与方法
1.1 材料
1.1.1 质粒菌种
质粒pGEM-Teasy:美国Promega公司;
质粒pMAL-c5x、大肠杆菌Rosetta(DE3):生工生物工程(上海)股份有限公司;
大肠杆菌(E.coliDH5ɑ):本实验室保存;
混合菌种混悬液:本实验经发霉玉米制备,用以扩增ADTZ目的基因。
1.1.2 主要试剂
质粒小提试剂盒、DNA凝胶回收试剂盒、DNA Marker:天根生化科技(北京)有限公司;
黄曲霉毒素B1ELISA检测试剂盒:北京华安麦科生物技术有限公司;
非预染蛋白Marker、预染蛋白Marker:生工生物工程(上海)股份有限公司;
NcoI、BamHI、DNA聚合酶(500 U)、DNA连接酶(100 U):美国Promega公司。
1.1.3 主要设备
恒温培养箱:DNP-9272BS型,上海新苗医疗器械制造有限公司;
恒温培养摇床:SKY-2102型,上海苏坤实业有限公司;
冷冻离心机:Thermo Micro 21R型,美国Thermo Electron Corporation公司;
电泳仪:JY600C型,北京君意东方电泳设备有限公司;
凝胶成像系统:Tanon 4600SF型,上海天能科技有限公司;
酶标仪:DNM-9606型,北京普朗新技术有限公司。
1.2 方法
1.2.1 混合菌种混悬液制备 称取200 g发霉玉米,破碎后置于500 mL烧杯中,加入20 mL蒸馏水,用塑料袋封住烧杯口,室温条件下放置14 d,待霉菌菌丝长出,取表面10 g发霉玉米,加入30 mL的蒸馏水,用涡旋震荡器震荡5 min,经3层纱布过滤杂质,取180 μL的滤液沸水浴5 min后,加入20 μL的溶菌酶,在37 ℃水浴30 min。
1.2.2 目的基因的TA克隆与鉴定 以处理过的发霉玉米混合菌液为模板,利用表1中合成的引物(上游引物含NcoI酶切位点,下游引物含BamH I酶切位点),55 ℃退火温度扩增ADTZ基因,琼脂糖凝胶电泳检测后,回收PCR产物。将回收的PCR产物与pGEM-Teasy载体连接,转化到E.coliDH5α中,对重组菌进行培养,提取质粒命名pGEM-Teasy-ADTZ,并用NcoI、BamH I进行双酶切鉴定。序列测定由生工生物工程(上海)股份有限公司完成。

表1 目的基因引物信息Table 1 The primers of objective gene
1.2.3 表达载体的构建与鉴定 分别对重组质粒pGEM-Teasy-ADTZ、质粒PMAL-c5x用NcoI、BamH I进行双酶切,用琼脂糖凝胶回收试剂盒回收目的基因片段。用T4DNA连接酶连接、转化到感受态细胞Rosetta(DE3)中,涂板在培养皿上形成单菌落。挑取阳性克隆菌落,提取质粒,对重组质粒进行酶切和测序,将重组的质粒命名为pMAL-c5x-ADTZ。
1.2.4 ADTZ基因的诱导表达及分析 挑取含pMAL-c5x-ADTZ质粒的Rosetta(DE3)菌落于含10 mL的LB培养基的大试管中,37 ℃,220 r/min摇床过夜扩大培养;将培养的菌液按体积比1∶100比例分别接种于8个装液100 mL LB培养基的500 mL三角瓶中,添加Amp(1 μg/mL)溶液,37 ℃,220 r/min振荡培养约2 h,当菌液OD值达到0.6~0.8时,在4个摇瓶中分别添加终浓度为1 mmol/mL的IPTG,并将4个三角瓶分2组,2瓶于25 ℃,220 r/min振摇诱导过夜;另2瓶于37 ℃,220 r/min 振摇诱导4 h。未加IPTG诱导培养的4个摇瓶菌种按照同样的接种流程分别在25,37 ℃培养。对所有菌液进行低温离心收集菌体和上清液,菌体进行超声波破碎,然后将破碎的菌体和上清液分别进行SDS-PAGE电泳检测。
1.2.5 ADTZ粗酶液降解玉米AFB1试验
(1)粗酶液的制备:将含pMAL-c5x-ADTZ质粒的Rosetta(DE3)菌液活化,加入IPTG,220 r/min,37 ℃诱导过夜培养;离心收集菌体,用10倍PBS缓冲液重悬超声波破碎后,即为粗酶液。
(2)降解试验:称取5 g发霉玉米样品置于25 mL的小烧杯中,121 ℃灭菌20 min。取5 mL的ADTZ粗酶液,加入到发霉的玉米样品中,搅拌均匀,在37 ℃水浴锅中反应48 h,在65 ℃条件下烘干样品备测。对照组将ADTZ粗酶液煮沸灭活,同样操作,对照组和试验组各3个重复样品。
(3)黄曲霉毒素检测:取样品5 g,加入60%甲醇25 mL 萃取AFB1;3 000 r/min离心10 min,取上清 1 mL 萃取液,再加入4 mL去离子水,稀释至甲醇浓度12%的待测液(样品共稀释25倍)。按照ELISA 检测试剂盒说明书操作方法测定样品AFB1的含量。按式(1)计算AFB1降解率。
(1)
式中:
d——降解率,%;
c——对照组AFB1含量,μg/kg;
t——试验组AFB1含量,μg/kg。
2 结果与分析
2.1 ADTZ序列的克隆与序列分析
以发霉玉米提取的混合菌液为模板,对ADTZ序列进行PCR扩增,凝胶电泳结果显示成功扩出了大于2 100 bp 大小目的的条带,如图1(a)泳道1、2、3。将PCR扩增产物与pGEM-Teasy进行连接,提取重组质粒,命名为pGEM-Teasy-ADTZ,对其进行NcoI、BamH I双酶切鉴定,酶切后获得两条目的条带,其中一条约为3 000 bp,另一条约为2 100 bp,与PCR扩增结果和载体大小一致,如图1(b)所示。将质粒进行测序,结果表明该基因片段大小为2 088 bp,连续编码695个氨基酸。在NCBI(National Center for Biotechnology Information)网站上的BLAST比对,结果显示,该基因与NCBI网站公布报道的黄曲霉毒素分解酶基因(gene ID:AY941095.1)序列[15]相似性达到99%(见图2),整个序列中有3处共9个碱基与已报道[15]的黄曲霉基因碱基不同,说明已成功从发霉玉米混悬菌液中克隆得到黄曲霉毒素分解酶基因。

图1 ADTZ基因的PCR扩增和酶切鉴定Figure 1 PCR amplification and identification of the ADTZ sequence
已知的ADTZ基因来源于真菌假密环菌(Armillariellatabescens)[15],但也有报道[9-12]表明,很多微生物具有降解黄曲霉毒素的能力。本试验中ADTZ基因,是从发霉玉米中提取的混合菌液中扩增得到,且与黄曲霉毒素分解酶(ADTZ)基因序列相似性达到99%。结合李俊霞等[16]从发霉饲料中筛选出两株降解AFB1菌株的试验结果,推测发霉玉米中不仅含有能够产生AFT的微生物,同时也具有能够降解黄曲霉毒素的微生物的存在。其可能为较高浓度的毒素作为一种选择压力,能够降解AFT菌株更容易生存。在模板不明确的条件下,从混合菌液中成功获得ADTZ基因,表明PCR探针能够有效地筛选出目的基因。与常规的PCR技术进行比较,利用菌液PCR技术筛选目的基因快速灵敏,成本较低,是获得目的基因片段的有效途径[17]。

方框内ADTZ碱基序列与已报道的黄曲霉基因(AY941095.1)碱基不同图2 ADTZ序列分析与比对Figure 2 Analysis and alignment of ADTZ sequences
2.2 重组质粒pMAL-c5x-ADTZ的构建与鉴定
ADTZ基因片段经NcoI、BamH I双酶切后连接、转化,构建重组质粒pMAL-c5x-ADTZ,该质粒的各序列结构图谱如图3所示。
挑取含有pMAL-c5x-ADTZ重组质粒的阳性菌,扩大培养后提质粒,用限制性内切酶NcoI、BamH I双酶切鉴定,结果如图4所示。质粒酶切后获得两条DNA片段,其中一条与载体大小一致,约为5 700 bp,另一条与ADTZ目的基因大小一致,约为2 100 bp,表明目的基因成功连接到大肠杆菌表达载体上。
2.3 ADTZ基因在大肠杆菌中的表达
将含有重组质粒pMAL-c5x-ADTZ的大肠杆菌Rosetta(DE3)和宿主菌在25,37 ℃下培养,收集菌体和上清,对菌体破碎后进行聚丙烯酰胺电泳(SDS-PAGE),结果如图5所示。
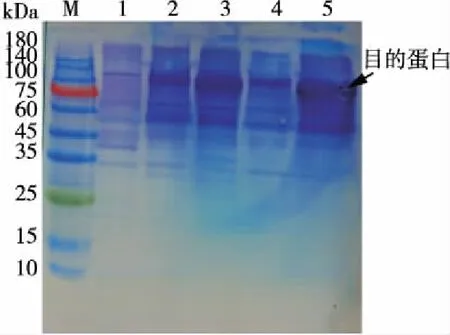
由图5可知,在宿主大肠杆菌Rosetta(DE3)菌体蛋白中未出现于目的蛋白大小相当的条带。在重组大肠杆菌的上清液和菌体蛋白中(泳道2~4)均可检测到分子量约116 kDa 的蛋白条带,与MBP标签和ADTZ蛋白两者融合产生的蛋白分子量一致。其中菌体中的目的蛋白含量更多,37 ℃培养的细菌菌体中目的蛋白含量高于25 ℃培养,而上清液中目的蛋白含量相反。
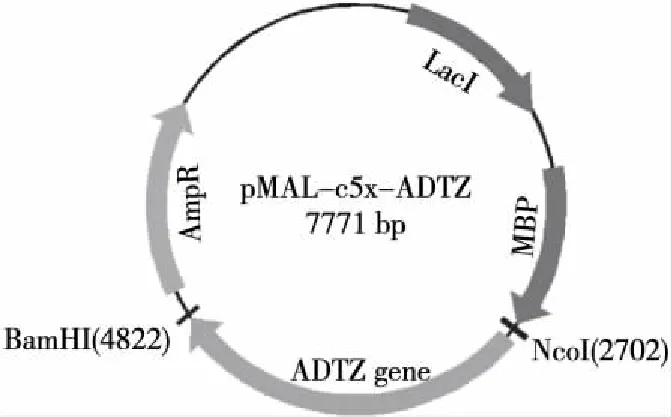
图3 重组质粒pMAL-c5x-ADTZ模式图Figure 3 Schematic diagram of the recombinant plasmid pMAL-c5x-ADTZ
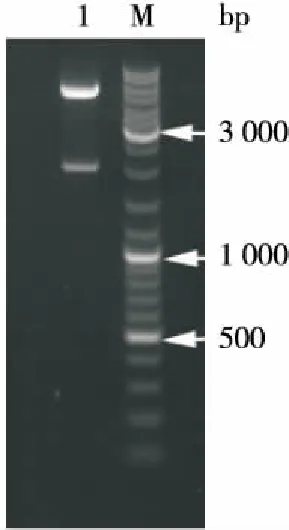
DNA分子标量从上到下依次为10 000,8 000,6 000,5 000,4 000,3 500,3 000,2 500,2 000,1 500,1 200,1 000,900,800,700,600,500,400,300 bp
图4 质粒PMAL-c5x-ADTZ的双酶切鉴定
Figure 4 Identification of plasmid PMAL-c5x-ADTZ by double digestion

M.Protein Marker 1.Rosetta(DE3)总蛋白 2.25 ℃上清 3.25 ℃沉淀 4.37 ℃上清 5.37 ℃沉淀图5 MBP-ADTZ融合蛋白SDS-PAGE检测Figure 5 MBP-ADTZ fusion protein SDS-PAGE detection
对重组大肠杆菌进行IPTG诱导表达结果如图6所示。宿主Rosetta(DE3)诱导后无与目的蛋白大小一致的条带出现;而其他4条泳道均有大小与目标蛋白一致的蛋白条带,其规律未进行诱导的结果一致,表达的蛋白量高于未经诱导的菌株。进一步验证了ADTZ基因能够在大肠杆菌中与MBP标签进行了融合并表达,表达产物大部分在细胞内,受诱导物的诱导。
pMALTM系统是一种高效的蛋白融合表达系统,其中pMAL 载体含有编码麦芽糖结合蛋白(Maltose Binding Protein,MBP)的基因,其下游插入目的基因,可利用 MBP 标签对麦芽糖的特异性,结合实现融合蛋白的一步亲和纯化[18]。其中MBP蛋白大小为40 kD,由大肠杆菌K12的malE基因编码,具有表达效率高、蛋白稳定、易于纯化等优点,能够协助新生的多肽链折叠,并组装成稳定的有生物活性的结构[19-20]。本试验正是利用该表达系统的特点,进行ADTZ基因的融合表达,并获得了具有生物活性的表达产物。验证了该系统的可靠性。
M.预染Protein Marker 1.诱导前总蛋白 2.25 ℃上清 3.25 ℃沉淀 4.37 ℃上清 5.37 ℃沉淀图6 MBP-ADTZ诱导表达电泳图Figure 6 Induced expression electrophoresis of MBP-ADTZ
已报道[16,21]来源于假密环菌(Armillariellatabescens)的ADTZ基因,编码合成的生物蛋白为假密环菌的胞内酶,具有降解AFT的能力,能独立完整地表达具有活性的ADTZ蛋白,并能够在大肠杆菌以及酵母菌(Pichiapastoris)中表达[22-23]。温思霞等[15]通过分子克隆技术,成功克隆并重组表达了一种具有AFB1转化功能的黄曲霉毒素氧化酶(Aflatoxin-oxidase,AFO),同时试验推测ADTZ酶可能存在于其他能够降解AFT的生物菌株中。本试验扩增的ADTZ基因与已有的报道,虽然同源性高达99%,但存在3处碱基的突变,通过构建表达载体pMAL-c5x实现了黄曲霉毒素在大肠杆菌中的异源融合表达,表达产物具有生物活性,丰富了AFB1降解基因的种类。
2.4 AFDZ表达产物对玉米AFB1的分解
为了验证ADTZ基因表达产物——黄曲霉毒素分解酶的酶活性,用其对发霉玉米的AFB1进行分解试验,结果如表2所示。对照组中AFB1测定结果平均值为27.97 μg/kg,试验组中AFB1的平均值为6.24 μg/kg,AFB1平均降解率为77.69%。表明,ADTZ基因在大肠杆菌中的表达产物能够有效地降低天然发霉样品中的AFB1的含量,更进一步验证了ADTZ基因结构完整,能够实现异源表达,且表达产物具有生物学活性。

表2 表达产物对玉米AFB1的降解结果Table 2 Degradation of expressed products to maize AFB1
本试验中重组菌粗酶液对黄曲霉毒素的降解率为77.69%,低于已报道的降解率(达到80%以上[24-25])。分析其原因可能:本试验表达产物为融合蛋白,在降解功能上可能受到影响;本试验测定的降解率为天然发霉玉米种的AFB1,与标准品AFB1比较,天然样品的结构更复杂,降解其中的AFB1难度更高。
3 结论
采用PCR的方法成功从发霉玉米样品中扩增到黄曲霉毒素分解酶基因,通过序列分析与已报道[15]的基因相似度达到99%,说明黄曲霉毒素分解酶基因广泛存在于自然界的微生物菌种中,并丰富了黄曲霉毒素分解酶基因序列。通过构建表达载体实现了该基因在大肠杆菌中的表达,表达产物表现出了分解黄曲霉毒素的能力,说明可以通过异源表达获得高纯度的黄曲霉毒素分解酶。本研究使用大肠杆菌表达系统进行基因表达,后续的研究将集中在该基因产物的分离纯化方面,以获得纯度较高的酶蛋白,并通过分子手段从基因水平对其进行改造以提高表达产物分解天然黄曲霉毒素的效果。

