桑色素与血清白蛋白相互作用热力学行为
谢文,何欢,董家新,郭清莲,*,刘义
1武汉大学中南医院,武汉 4300712武汉大学化学与分子科学学院,病毒学国家重点实验室和生物医学分析化学教育部重点实验室,武汉 4300723广西师范大学化学与药学学院,广西 桂林 541004

1 引言
血清白蛋白(SA)是动物血浆当中含量最多的载体蛋白1,2,也是循环系统中最常见的可溶性蛋白质,主要承担储存和运输内、外源物质的功能3,4。绝大多数生物活性物质,如类固醇激素、氨基酸、金属离子和许多药物分子,与血清白蛋白的亲和力,直接决定了它们在机体中的分布5-7。其中,药物分子进入血液后,通常首先与血清白蛋白结合,依赖血清白蛋白进行运输,并转运至病灶发挥生理药理活性8。研究药物与SA结合的热力学行为和特征,有助于从分子层面深入阐述药物在体内的运输过程以及作用机制,是目前化学、医药学、生命科学领域共同感兴趣的课题。
桑色素(英文名称Morin,分子式C15H10O7,分子量302.23,分子结构如图1所示)是一种从黄桑木、黄橙树等桑科植物的树皮中提取的天然黄酮类化合物。它具有抗菌、抗病毒、抗癌、解痉等多种药理作用9。研究发现桑色素对金黄色葡萄球菌、痢疾杆菌和伤寒杆菌均有较强的抗菌作用10。桑色素对腹水型肝癌细胞具有永久性光敏杀伤作用,能够抑制腹水型肝癌细胞DNA的合成11。最新的研究发现桑色素还可以和许多金属离子形成配合物,其抗菌、抗病毒、抗氧性和抗癌活性更显著12,13。因此,新型金属-桑色素复合物的设计、合成及其生理活性的研究,是当前的研究热点之一14,15。
图1 Morin的化学结构Fig. 1 Chemical structure of Morin.
桑色素具有优良的抗菌、抗肿瘤等生理活性,因此其与蛋白质、核酸等生物大分子的相互作用引起了许多研究人员的关注。戚祖德等人通过多种光谱手段,研究了Morin与人血清白蛋白(HSA)的相互作用,发现Morin能与HSA形成稳定的复合物16。Wang等人的报导指出0.5 mg·L-1的牛血清白蛋白(BSA)和人血清白蛋白就能够有效猝灭桑色素的内源性荧光,且BSA的猝灭作用强于HAS17。宋玉民等通过电化学方法,研究了Morin与小牛胸腺DNA的相互作用,发现Morin与DNA发生较强烈的嵌入结合作用18。本文选择牛血清白蛋白作为模型蛋白,利用荧光光谱、紫外-可见吸收光谱、圆二色谱和分子模拟技术,研究了牛血清白蛋白与桑色素的结合模式。
2 实验部分
2.1 仪器和试剂
日立F-2500荧光分光光度计(配以恒温附件,日本),普析TU-1901 UV-Vis分光光度计(中国),Sartorius ME215S分析天平(德国),Millipore纯水仪(美国)。
分子对接实验由Sybyl 8.1软件(美国)Surflex-Dock模块运行,操作系统为CentOS5.0系统。
牛血清白蛋白(BSA)和桑色素(纯度 > 99%)均购自Sigma公司。BSA溶液由Tris-HCl缓冲溶液(0.05 mol·L-1、pH = 7.4)配制。三羟甲基氨基甲烷纯度高于99.9%,NaCl、HCl和DMF等为分析纯,桑色素用DMF溶解。试验中DMF最大使用浓度为2%,该浓度下DMF对BSA没有变性作用。
2.2 实验方法
2.2.1 荧光光谱
荧光猝灭光谱:移取2.5 mL 1.0 × 10-5mol·L-1的BSA溶液于1 cm的石英比色皿中,用微量进样器逐次加入Morin溶液,搅拌混合均匀,并延时1.5 min进行荧光强度测定,测试温度分别为298、303、308和313 K。激发波长为280 nm,发射波长扫描范围为300-450 nm。激发和发射的狭缝宽度均为2.5 nm。据上述方法,测定BSA与Morin在不同摩尔比情况下的荧光强度。
同步荧光光谱:采取同步扫描模式,激发扫描起始波长为230 nm,发射光谱扫描起始波长为290 nm,Δλ分别为15和60 nm。室温条件下,测定BSA溶液以及BSA溶液与Morin在不同摩尔比情况下的同步荧光光谱。
2.2.2 紫外-可见吸收光谱
室温条件下在210-500 nm波长范围内测定BSA溶液(1.0 × 10-5mol·L-1)和Morin溶液(1.0 ×10-5mol·L-1)的吸收光谱,以及BSA与Morin摩尔比为1 : 1时的吸收光谱。
2.2.3 圆二色谱
室温条件下采用Jasco J-810圆二色光谱仪测定BSA-Morin混合体系的CD光谱。BSA浓度为1.0 ×10-5mol·L-1,Morin浓度为0、1.0 × 10-5、2.0 × 10-5、4.0 × 10-5mol·L-1。扫描波长范围为200-260 nm。用Tris-HCl缓冲溶液作为空白参比,从样品光谱图中扣除。
2.2.4 分子对接
BSA的晶体结构信息由Protein Data Bank(PDB)获取,结构编号为3v0319。采用GaussView软件构建Morin分子并优化其构型。应用选择BSA中配体的方法,定义对接原型分子。
3 结果与讨论
3.1 荧光猝灭机制及猝灭常数
荧光猝灭现象指荧光分子与溶剂分子或其它溶质分子相互作用,造成荧光强度降低、消失或荧光强度与浓度不呈现线性关系20,21。图2给出了在298-313 K温度条件下,Morin与BSA相互作用的荧光猝灭光谱。可以看出,随着Morin的不断加入,BSA的荧光峰强度均明显降低,并且其降低程度随Morin浓度增加呈一定的规律性,表明Morin能有效地与BSA发生相互作用22。同时,我们还发现随着Morin的加入,BSA的最大发射波长并没有明显的变化,表明BSA生色基团周围微环境的极性改变不大23。
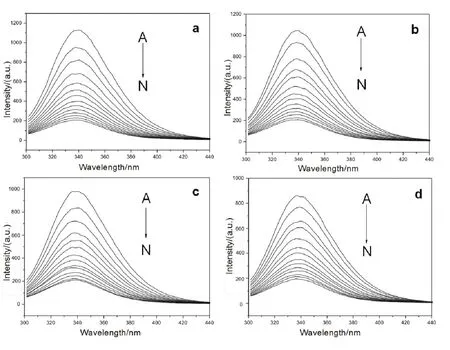
图2 298-313 K温度下Morin-BSA体系荧光光谱Fig. 2 Fluorescent spectra of BSA in presence of Morin at 298-313 K.c(BSA) = 1.0 × 10-5 mol·L-1; 105c(Morin)/(mol·L-1), A-N: 0.0, 0.4, 0.8,1.2, 1.6, 2.0, 2.4, 2.8, 3.2, 3.6, 4.0, 4.4, 4.8, 5.2, respectively.a: 298 K; b: 303 K; c: 308 K; d: 313 K.
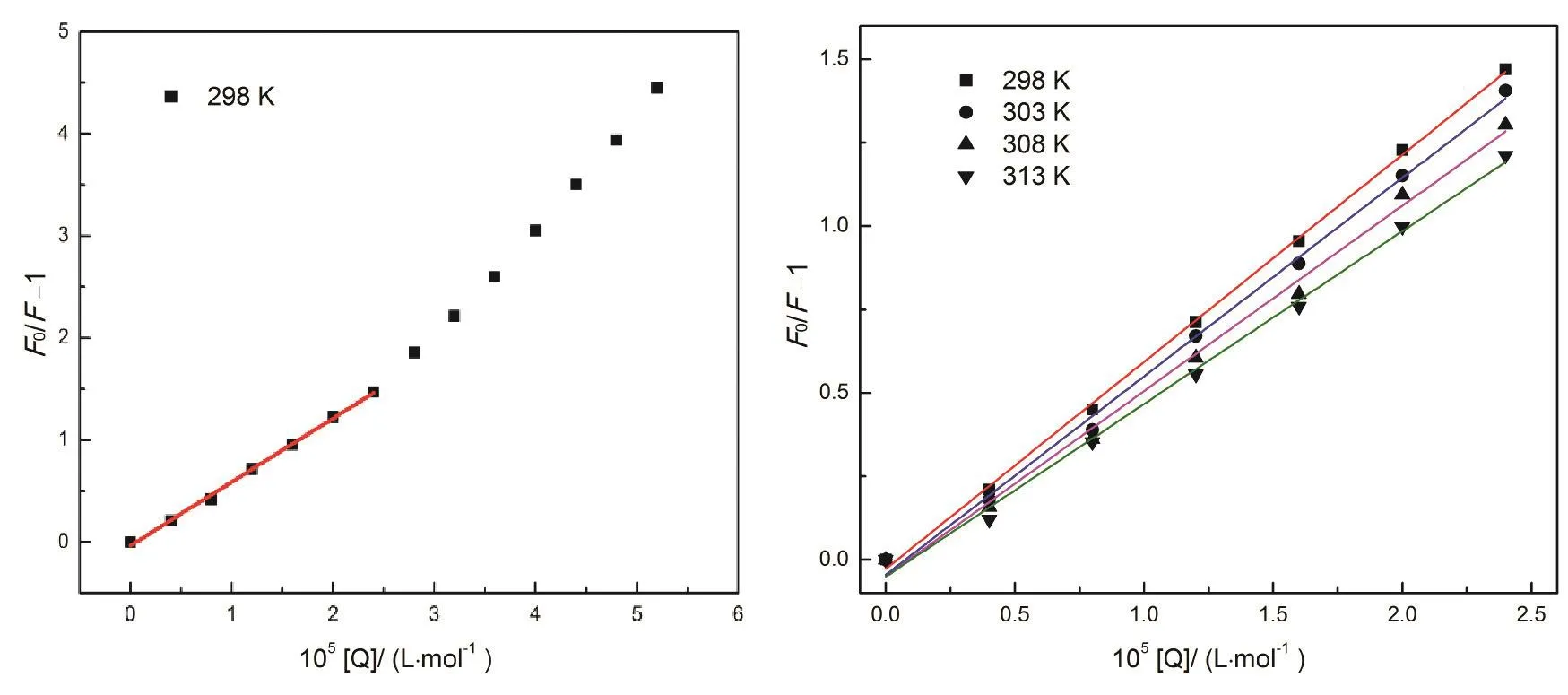
图3 298-313 K温度下BSA-Morin体系Stern-Volmer关系图Fig. 3 Plots of Stern-Volmer equation of BSA-Morin system at 298-313 K.
大量的研究表明通过测定温度对粘度或结合常数的影响可以区分荧光分子荧光猝灭机制24,25:静态猝灭过程KSV随温度升高而降低,动态猝灭过程KSV随温度升高而升高26。基于此,我们对图2中各浓度下的峰值按Stern-Volmer方程27分析:
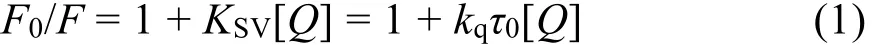
式中F0和F指有无猝灭剂时体系荧光强度;KSV为猝灭常数;[Q]为Morin的浓度;kq为BSA的猝灭速率常数;τ0为不存在猝灭剂时生物BSA的平均荧光寿命。根据文献28报道,生物大分子的荧光平均寿命为10-8s。由图3可以看到,Morin对BSA的荧光猝灭作用并不能在所有的浓度范围内都呈现出良好的线性关系,但其在低浓度范围内(0-2.4 μmol·L-1)具有良好的线性关系(线性相关系数R大于0.99)。因此,我们选取低浓度的荧光数据来进行处理,计算了不同温度下KSV和kq,列在表1中,发现KSV随温度升高而减小,kq高于蛋白质最大碰撞猝灭速率常数29,推断BSA与Morin分子之间的荧光猝灭可能是由于形成了复合物的静态猝灭过程。
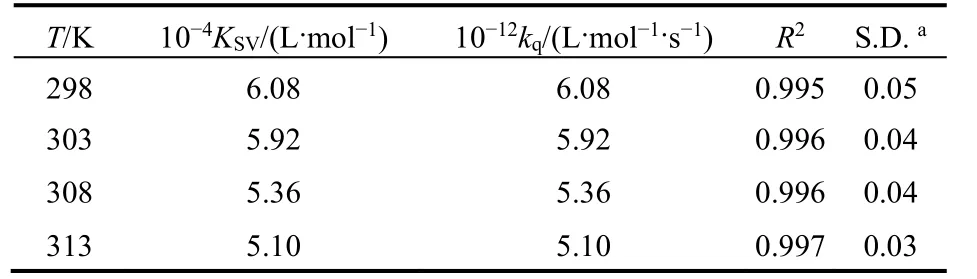
表1 pH = 7.4时298-313 K温度下BSA-Morin体系猝灭常数Table 1 Quenching constants of Morin-BSA system at 298-313 K and pH = 7.4.
为了验证Morin对BSA荧光的猝灭是静态猝灭过程,分别测定了BSA、Morin单独和混合条件下的紫外-可见吸收光谱。如图4所示,可以发现BSA紫外-可见吸收光谱280 nm处的吸收峰在加入Morin之后明显下降,表明Morin与BSA之间形成了基态复合物30,这进一步证实了BSA与Morin之间的静态猝灭机制。
3.2 Morin与BSA间的作用模式
静态猝灭过程的荧光数据可以用Lineweaver-Burk双倒数函数来进一步处理31:
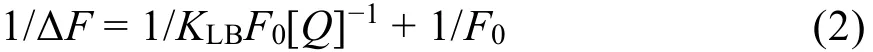
式中,F0表示不存在Morin时BSA的荧光强度;ΔF表示体系在不存在Morin与Morin浓度为[Q]时的荧光强度的差值;KLB是Lineweaver-Burk生成常数,用来反映BSA与Morin之间的结合达到平衡时的量效关系。根据Lineweaver-Burk双倒数图的直线斜率和截距进行计算,得到KLB等相关参数,列于表2中。
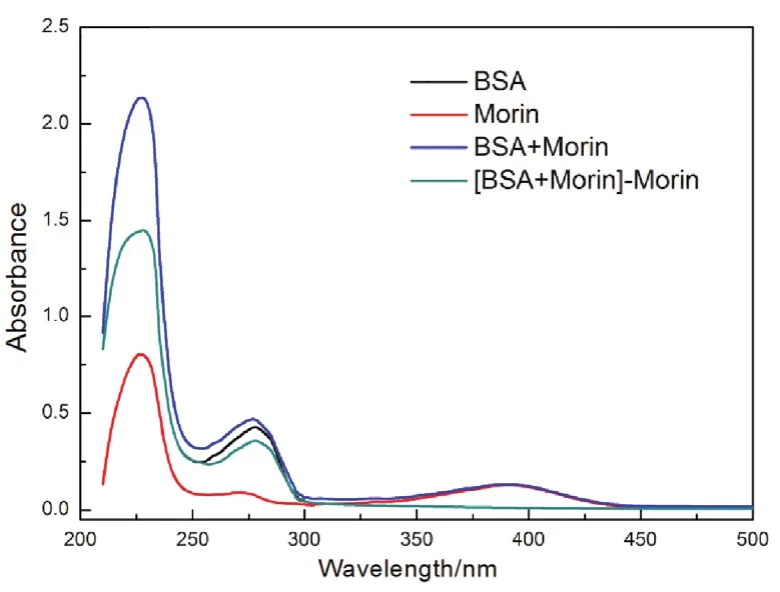
图4 Morin-BSA体系的紫外-可见吸收光谱Fig. 4 UV-Vis absorption spectra of BSA-Morin system.c(BSA) = 1.0 × 10-5 mol·L-1; c(Morin) = 1 × 10-5 mol·L-1.
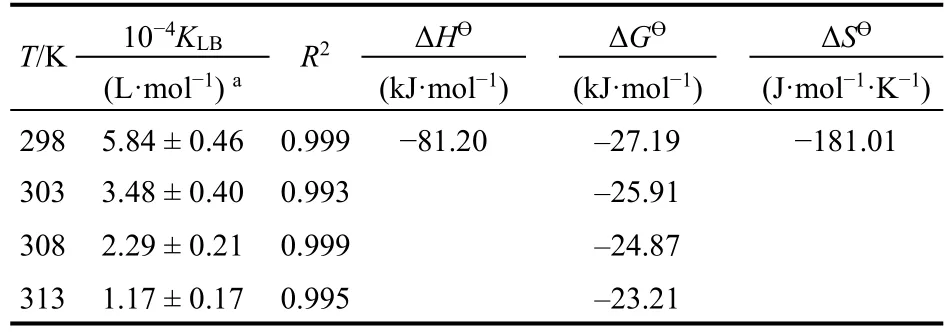
表2 298-313 K温度下BSA-Morin体系的热力学参数Table 2 Thermodynamic parameters of the interaction at 298-313 K.
根据作用距离及偶极矩差异,可将蛋白质与药物小分子之间相互作用力分为范德华力、氢键、疏水作用力和静电作用力;根据Ross等人的实验结果,相互作用力类型可以通过相互作用热力学参数的大小和符号来进行判断32。为了研究BSA与Morin的作用力类型,计算了298-313 K下的ΔHƟ、ΔSƟ、ΔGƟ。相互作用过程的焓变ΔHƟ和熵变ΔSƟ可以通过van't Hoff方程获得33:
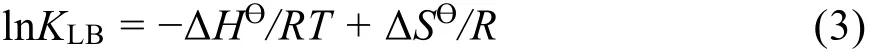
其中,R是气体常数。ΔGƟ下式获得:
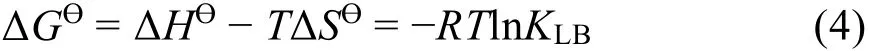
如图5所示,以lnKLB对1/T直线拟合,从斜率和截距获得焓变ΔHƟ和熵变ΔSƟ,得到298-313 K的吉布斯自由能变ΔGƟ,结果列于表2。ΔGƟ小于零可得BSA与Morin的结合是自发的,负的ΔHƟ和ΔSƟ说明氢键和范德华力是结合驱动力34。
3.3 Morin与BSA相互作用位点数
蛋白质等生物大分子通常有相互独立的结合位点。对于静态猝灭过程,药物分子在蛋白质上的结合位点数可以由荧光强度-药物浓度间对数关系式求出35:
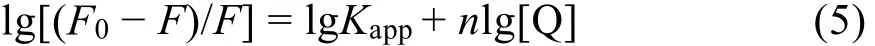
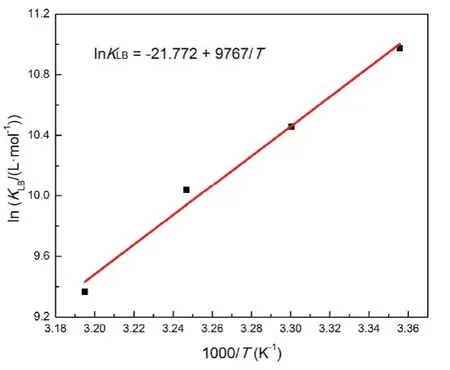
图5 BSA-Morin体系的van't Hoff曲线Fig. 5 van't Hoff plot for BSA-Morin system.
式中F0和F分别表示不存在和存在Morin时BSA的荧光强度;[Q]为Morin的浓度,Kapp和n是表观结合常数和结合位点数。
由上式拟合,从直线斜率和截距求出Morin与BSA相互作用的结合位点数n及表观结合常数Kapp,列于表3。可以发现Morin与BSA平均结合位点数(naverage)为1.20,且温度对结合位点数的影响不大,说明Morin与BSA之间基本上是1 : 1结合,有一个较强的结合位点。同时,Morin-BSA体系的表观结合常数达到104数量级,进一步证实了Morin与BSA之间存在强的结合,表明了血清白蛋白在体内能起到储存和运输Morin分子的作用,能使Morin分子通过血液循环达到作用部位,从而发挥其生理生化效应。
3.4 Morin与BSA结合距离的计算
药物分子与蛋白质的结合距离可以利用荧光共振能量转移理论(Fluorescence Resonant Energy Transfer,FRET)进行计算,其猝灭程度满足下式36:

式中,E表示蛋白质和药物分子之间能量转移效率;r指供体、受体真实距离;R0指50%转移效率时临界距离37:

在上式中,K2为偶极方向空间因子,n表示介质的平均折射率38。φ为荧光残基的荧光量子产率,J为光谱重叠积分,即:

F(λ)为蛋白质在波长λ处荧光强度,ε(λ)指药物分子在λ处摩尔消光系数。图6为Morin与BSA的浓度均为1 × 10-5mol·L-1时,Morin-BSA体系的发射光谱。将发射光谱与吸收光谱重叠区域按上式计算,得到J = 1.82 × 10-14cm3·L·mol-1。K2取2/3,n取有机物平均值1.36,色氨酸量子产率为φ = 0.1539,求出临界距离R0为3.47 nm,由此求得色氨酸与Morin分子间平均距离r为3.09 nm。可见0.5R0< r < 1.5R0,说明BSA与Morin分子间符合荧光共振能量转移(FRET)。

表3 Morin-BSA体系的表观结合常数及结合位点数Table 3 The apparent binding constants and binding site numbers of Morin-BSA system.
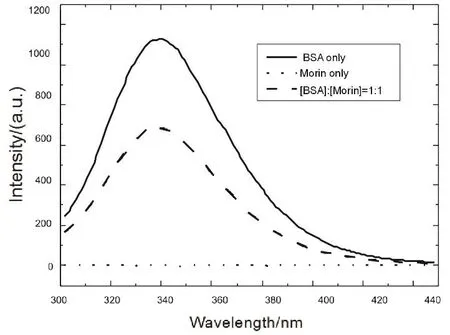
图6 BSA和Morin的荧光光谱Fig. 6 Fluorescence spectra of BSA-Morin system.[BSA] = 1.0 × 10-5 mol·L-1, [Morin] = 1.0 × 10-5 mol·L-1.
3.5 Morin对BSA构象的影响
3.5.1 同步荧光光光谱
蛋白质最大发射波长与其荧光氨基酸残基周围的微环境密切相关,因此可以通过同步荧光光谱研究蛋白质发光基团构象变化。当激发波长和发射波长的波长差固定为15和60 nm时,可以分别得到酪氨酸和色氨酸残基周围微环境改变的信息40。如图7所示,随着Morin的加入,酪氨酸残基的最大发射波长基本上保持不变(最大发射波长保持在288 nm),表明Morin的加入对酪氨酸残基所处微环境基本上没有影响;色氨酸残基的最大发射波长发生了微弱的红移(最大发射波长从281 nm红移至284 nm),表明Morin的加入对色氨酸残基所处微环境的极性有一定的增强。与戚祖德等人的报导相比,可以发现Morin与HSA和BSA的作用机制存在一定的差异:Morin在HSA上的结合位点位于亚结构域II A,与HSA唯一色氨酸残基(W214)的距离较近,导致W214所处微环境的疏水性发生明显的增强(即极性发生减弱),因此的HSA荧光发生明显的红移16。结合荧光共振能量转移数据,我们认为这可能是由于Morin在BSA中结合位点与BSA的两个色氨酸距离较远,不能直接改变色氨酸附近的蛋白质空间结构。
3.5.2 圆二色谱
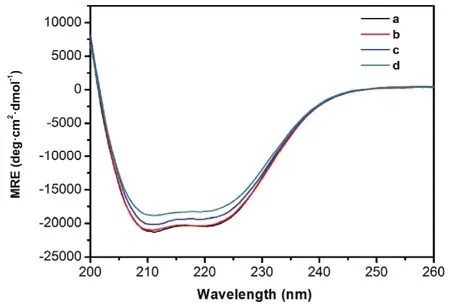
图8 BSA-Morin体系的圆二色谱图Fig. 8 CD spectra of BSA-Morin system.MRE: mean residue ellipticity. c(BSA) = 1.0 × 10-5 mol·L-1;105 c(Morin)/(mol·L-1), a-d: 0, 1.0, 2.0, 4.0, respectively.
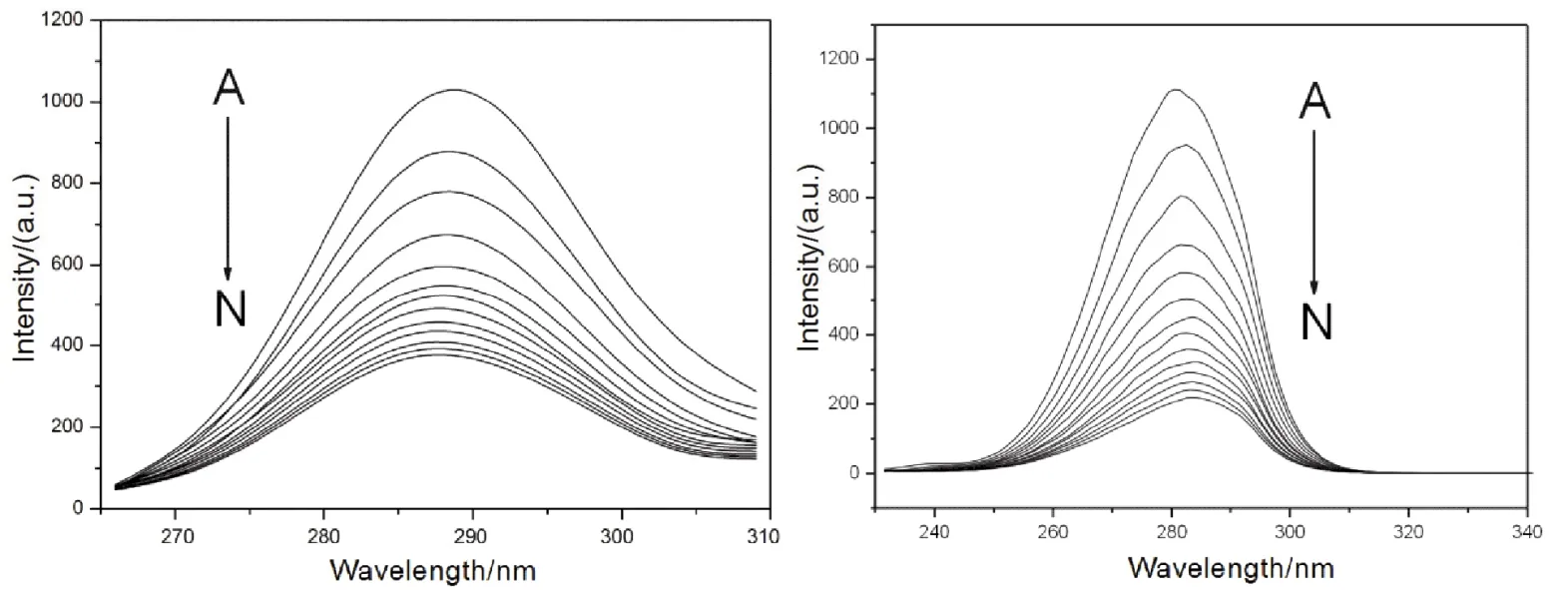
图7 Morin与BSA相互作用的同步荧光光谱Fig. 7 Synchronous fluorescent spectra of BSA-Morin system.Left, Δλ = 15 nm; right, Δλ = 60 nm. Δλ = 60 nm, c(BSA) = 1.0 × 10-5 mol·L-1;105c(Morin)/(mol·L-1), A-N: 0.0, 0.4, 0.8, 1.2, 1.6, 2.0, 2.4, 2.8, 3.2, 3.6, 4.0, 4.4, 4.8, 5.2, respectively.
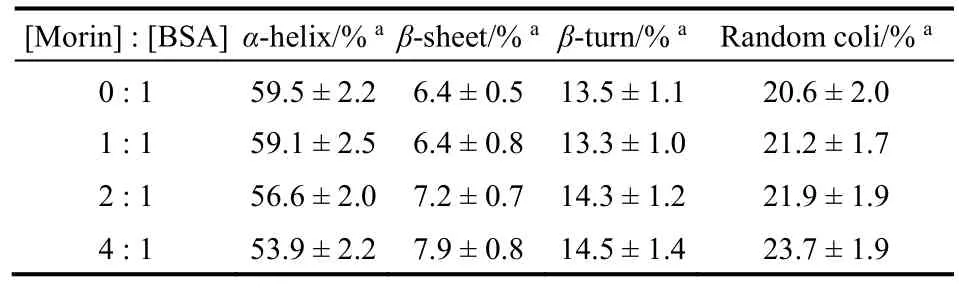
表4 Morin作用下BSA各二级结构百分比Table 4 Fractions of different secondary structures of BSA bound with Morin.
使用圆二色谱可以进一步研究Morin对BSA构象的改变(图8)。BSA在远紫外区表现出两个明显的负峰谱带(208和222 nm),为典型的蛋白质α-螺旋结构的特征峰。随着Morin浓度增加,BSA特征峰的强度显著降低,且降低幅度与Morin浓度正相关,说明Morin对BSA的二级结构产生了破坏。表4列出了SELCON 3软件分析得到的不同Morin浓度条件下BSA各二级结构的含量17。可以发现,当[Morin] : [BSA]为4 : 1时,蛋白质α-螺旋百分比从59.5%下降到53.9%,而无规结构的比例从20.6%上升到23.7%,说明BSA分子的二级结构在Morin的作用下有所破坏25。同时,加入Morin前后,BSA的CD光谱基本形状变化不大,表明Morin和BSA发生相互作用后,BSA的二级结构还是以α-螺旋为主。
3.6 分子模拟
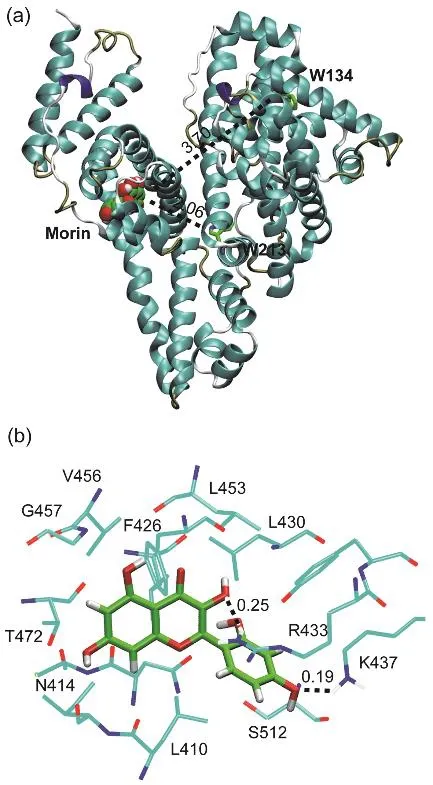
图9 (a) Morin在位点II对接构象;(b) Morin周围0.5 nm范围内的氨基酸残基Fig. 9 (a) Docking poses of Morin in site II;(b) the nearest residues around Morin within 0.5 nm.
黄酮类化合物在血清白蛋白亚结构域II A(site I)和亚结构域III A (site II)的结合均有报道41,且黄酮类化合物的官能化对结合位点的影响较大42;之前的研究则表明Morin结合在HSA的site I位点16。图9a给出了Morin-BSA体系的最低能量结构。Morin的结合区域位于Ibuprofen位点,即site II。Morin与BSA两个色氨酸残基(W134和W213)的质心距离分别为3.70和2.06 nm,这与荧光共振能量转移实验的计算出的结果相符。图9b显示了Morin附近的氨基酸残基,包括:L410、N414、L430、F426、R433、K437、L453、V456、G457、T472和S512,可以发现Morin主要与周围疏水性的氨基酸残基的支链发生接触。此外,可以观察到Morin分子上的羟基与R413、K437的侧链间氢键的产生,与热力学结果相符。
4 结论
荧光光谱和紫外-可见光谱结果表明Morin对BSA荧光的猝灭是静态猝灭过程;计算出的焓变和熵变说明Morin与BSA结合的驱动力主要是氢键和范德华力。根据荧光共振能量转移(FRET)理论和分子模拟结果,Morin在BSA上的结合位点位于亚结构域III A的位点II,且Morin分子与BSA两个色氨酸残基之间的平均距离为3.09 nm。Morin分子与BSA分子的结合会导致BSA分子结构发生了改变,其α-螺旋含量降低,无规结构比例上升。
黄酮类化合物与血清白蛋白的结合往往是自发进行的,荧光猝灭类型通常是静态猝灭,但其结合驱动力却存在一定的差异。例如,槲皮素、橙皮素、甲基橙皮素与HSA的结合驱动力为静电作用力43,而血竭总黄酮tFSD与HSA的相互作用以非静电作用为主44,这表明黄酮类化合物取代基的种类和位置对其与生物大分子的相互作用有较大的影响。
BSA的氨基酸序列与HSA非常类似,二者同源性约为80%,因此其空间结构也十分相近,然而本文获得的结合热力学参数表明Morin与HSA及BSA的相互作用类型存在一定的差异。根据戚祖德等人16的数据,Morin与HSA的结合自由能比BSA更大(298 K条件下ΔGƟ分别为-29.5和-27.1 kJ·mol-1),表明Morin与HSA之间的结合更强。同时,Morin与HSA相互的ΔHƟ和ΔSƟ均大于0,因此其相互作用力类型为疏水作用力,说明Morin与HSA和BSA之间的相互作用力类型也具有明显的差异。分子模拟结果表明:这可能是由于Morin在HSA和BSA分子上的结合位点不同导致的,即Morin倾向于结合在HSA的亚结构域II A的位点I上16;而与BSA结合时,则结合在BSA的亚结构域III A的位点II。这些研究结果为了解桑色素分子的药理提供基础知识,为设计、修饰和筛选黄酮类药物分子提供有益的启发与指导。

