腾冲红花油茶花蜜蛋白1,6-二磷酸果糖醛缩酶的鉴定、克隆与分析
卿 卓 苏 睿 赵文正 李林庶 任晓晓 董 坤,* 和绍禹,*
(1 云南农业大学动物科学技术学院,云南 昆明 650201;2 云南省农业科学院蚕桑蜜蜂研究所,云南 蒙自 661101;3 云南省腾冲市畜牧工作站,云南 腾冲 679100)
被子植物和部分裸子植物在生态演化过程中主要的繁殖方式是通过分泌花蜜吸引传粉动物以实现授粉[1-2]。花蜜主要是由植物蜜腺所分泌的一种糖溶液,是被子植物中最吸引传粉动物的中间媒介,同时也是影响传粉动物采访行为的重要物质。花蜜的化学成分主要以糖类为主[2-3],还含有微量的氨基酸、蛋白质、脂类、维生素、无机离子、生物碱、萜类等物质[3-5]。传粉动物取食花蜜时也会将自身携带的微生物带入花蜜中,微生物进入花蜜后会以花蜜中丰富的营养成分为养料进行繁殖和生长,直接影响花蜜的化学组成和含量,从而间接影响传粉动物的访花行为和植物的繁殖成功率[6-9]。但大部分植物花蜜中微生物的种类和数量并不能无限繁殖,花蜜中糖类组分的种类和含量也维持在相对稳定的状态[2,10]。
近年来,研究学者对观赏型烟草(Nicotianasp.)花蜜蛋白质组开展了大量研究,并发现了一条极其重要的抑菌途径[11-13],即通过花蜜中相应蛋白酶的催化作用使花蜜中形成高浓度的H2O2,抑制花蜜中微生物的繁殖,从而保持花蜜中主要化学组成的相对稳定,维持其对传粉动物的吸引力,增加植物的繁殖适合度[14-16]。此外,有研究学者从矮牵牛花(Petuniahybrida)和露珠杜鹃(Rhododendronirroratum)花蜜中发现了另一种花蜜抑菌途径,即通过花蜜中的病程相关蛋白(如核糖核酸酶、几丁质酶等)直接抵御微生物的入侵,如矮牵牛花蜜中检测到的核糖核酸酶能够直接抑制一些病原性真菌菌丝的生长和繁殖,露珠杜鹃花蜜中的几丁质酶通过降解几丁质的方式直接防御含有几丁质的病原菌等[17-19]。Nepi等[20]还鉴定出了一些与碳水化合物代谢相关的蛋白,如蔗糖酶、转葡糖苷酶、转果糖苷酶等,其主要功能是调控花蜜中糖类组分的比例。Heil[2]从花蜜来源的角度研究花蜜的化学组成,结果发现花蜜中糖类组分主要存在2种来源途径,即植物的韧皮部汁液作为花蜜的前体物质,经过一定修饰后形成花蜜中的糖类组分;在蜜腺组织中合成淀粉并经一系列分解酶的催化反应后形成花蜜中的糖类组分,但其功能蛋白的种类和具体调控机制尚不清楚。
腾冲红花油茶(Camelliareticulata)为山茶科(Theaceae)山茶属(Camellia)常绿灌木或小乔木异花传粉植物,是云南省特有的大型木本花卉,其种仁含油率高、不饱和脂肪酸含量丰富,食用价值较高,也是优良的木本油料树种,主要分布于滇西林地、山区等地方,其中又以腾冲分布最多[21]。云南农业大学动物科学技术学院花蜜化学课题组已对腾冲红花油茶花蜜的主要化学成分(糖类和氨基酸)进行了相关研究,发现该花蜜主要含有5种糖类物质(果糖、葡萄糖、蔗糖、棉子糖和水苏糖)和18种氨基酸(其中组氨酸含量最高,脯氨酸含量最低)[22]。已有研究表明蛋白酶会直接或间接地影响花蜜的糖类和氨基酸组分,如有些酶能够直接参与葡萄糖、果糖、蔗糖的代谢过程[20],还有一些酶能够影响花蜜中的微生物,从而间接调控花蜜中的糖类组分[8-9]。因此,腾冲红花油茶花蜜蜜腺可能会分泌某些功能蛋白来维持和调节花蜜的化学组成。截至目前,国内外有关花蜜蛋白质的研究相对较少,且主要集中于烟草、拟南芥等模式植物上。近几年分离鉴定出的花蜜蛋白主要是参与花蜜的抗菌途径,且报道的花蜜蛋白种类较少,甚至参与花蜜化学成分调节的相关蛋白尚未见报道[11-16]。1,6-二磷酸果糖醛缩酶(fructose-1, 6-bisphosphate, FBP2)主要是参与糖酵解代谢过程,且在植物体内的激素调控和抗逆性方面发挥非常重要的作用[23-27],但对于植物花蜜(作为植物与传粉动物间的中间媒介物质)中FBP2的潜在功能研究尚未见报道。
本试验通过对腾冲红花油茶花蛋白1, 6-二磷酸果糖醛缩酶(FBP2)的鉴定、编码基因的克隆以及组织表达特点的分析,以期为揭示花蜜中糖组分调控过程及作用机制奠定一定的理论基础。
1 材料与方法
1.1 试验材料
腾冲红花油茶花蜜和叶片、蜜腺及花部其他组织样品均采自云南省腾冲市沙坝林场腾冲红花油茶野生居群。
1.2 试验方法
1.2.1 花蜜采集 腾冲红花油茶单朵花期为7~10 d,开花后第2天开始分泌花蜜,最后一天基本不泌蜜,因此在腾冲红花油茶盛花期,随机选择并标记200朵即将开放的花蕾,套袋(防止花蜜被访花者取食),花朵开放5 d后开始用毛细管或者注射器(1 mL)采集花蜜。将采集的花蜜放入冰盒内,-20℃保存备用。
1.2.2 花蜜蛋白的纯化和分离 将花蜜样品置于4℃ 13 000×g条件下离心10 min,取上清液至10 kDa的超滤管中,13 000×g(4℃)离心20 min,向超滤浓缩后的花蜜中依次加入5×loading buffer(还原型)(250 mmol·L-1Tri-HCl、10%SDS、0.5%BPB、50%甘油、5%β-巯基乙醇),混匀后95℃加热10 min,然后用14% SDS-PAGE电泳进行分离。电泳结束后采用考马斯亮蓝G-250染色[28]。
1.2.3 蛋白条带的MALDI-TOF/MS质谱鉴定分析 将染色后的花蜜蛋白条带进行切胶回收,用含乙腈的染脱色液使之脱色完全,微加热使胶粒完全干燥。干燥胶粒加入0.1 μg·μL-1胰蛋白酶,待充分湿润并覆盖干燥胶粒后,37℃酶切过夜12 h,酶切完成后分别加入100 μL萃取液,萃取2次后将上清液转移至新的旋蒸管中,置于XHRE-2002旋转蒸发仪(广州予华仪器有限公司)中干燥,然后用0.1%甲酸溶解干燥后的样品,(4℃)14 000×g条件下离心15 min,吸取上清液并移至上样管中,然后置于样品槽中,每次上样体积为8 μL。采用HPLC-ESI-Q-Exactive质谱仪(Thermp Fisher Scientific,德国)和高效液相色谱(High Performance Liquid Chromatography,HPLC)进行分析。
色谱条件为色谱柱为C18;梯度洗脱的流动相:A液为含0.1%甲酸的水溶液,B液为含0.1%甲酸的乙腈溶液;梯度洗脱程序为3%~8%A(5 min),8%~20% A(80 min), 20%~30%A(20 min), 30%~90%A(5 min), 90%A(10 min);流速:300 μL·min-1;柱温:室温。
质谱检测条件:分辨率为70 000;扫描范围:350~1 600 m/z(质荷比);离析最小单位为2 m/z。质谱检测完成后,将质谱数据导入PEAKS7.0软件,进行从头测序,然后进行数据库搜索。搜库参数设置如下:母离子质量数误差范围为15 ppm;碎片离子误差范围为0.05 Da;酶为经TPCK处理的胰蛋白酶;肽段非特异性断裂数为0;每条肽段最多有2个漏切位点;固定修饰选半胱氨酸碘乙酰胺化,可变修饰选甲硫氨酸氧化;每条肽段最多有3种翻译后修饰类型。搜库结束后用假阳性率FDR<1%和鉴定到的蛋白中特有肽段(unique peptide)≥1对搜库结果进行筛选[28-29]。
1.2.4 基因全长的克隆 采用SMARTTMRACE cDNA 扩增试剂盒(日本TaKaRa公司)进行RACE cDNA扩增。根据蛋白条带质谱鉴定分析结果所获得的肽段片段,利用Primer 5.0软件分别设计扩增目的基因的5′RACE引物和3′RACE引物,引物序列为:5′-G T A A G T T C C A A G G G T T G CC T C T G A GT-3′和5′-T A T C C T T G C T G C T G A T G A G T C C A C TG -3′。引物由昆明硕擎公司合成。以提取的腾冲红花油茶蜜腺总RNA为模板,按照TaKaRa(日本)公司的RACE试剂盒说明书反转录出5′和3′cDNA,通过RACE技术分别扩增出目的基因的5′端和3′端序列。将5′RACE和3′RACE测序结果通过DNAMAN 6.0软件行序列拼接,获得cDNA全长[24]。
1.2.5 序列分析 将测序所得序列利用NCBI网站(http://www.ncbi.nlm. nih.gov/)上的BLAST工具进行基因序列的相似性及同源性查找,利用序列进行基因同源性比较,并分析序列的基本信息。根据所测得基因的cDNA序列推导其氨基酸序列, 并利用序列分析工具对其进行分析,即采用Protparam(http://web.expasy.org/protparam/)预测蛋白的基本物理化学性质; NetOGlyc1.0分析预测O糖基化位点(连接苏氨酸和丝氨酸残基氧末端)和N糖基化位点(连接天冬酰胺残基氮末端)。
1.2.6 腾冲红花油茶花蜜中FBP2酶活性检测 腾冲红花油茶林地中随机标记未开放的花蕾并套袋(隔绝昆虫采访),当花朵开放后进行记录,随后分别采集花朵开放后累积2 d和累积5 d的花蜜带至实验室备用,按照GMS70012.2 1,6-二磷酸果糖醛缩酶连续循环反应光谱法定量检测试剂盒(上海杰美基因医药有限公司)说明书对花朵开放后累积2 d和5 d的花蜜中的FBP2活性进行测定。
1.2.7 荧光定量 RT-PCR进行基因表达分析 利用实时荧光定量PCR对CRFBPase在腾冲红花油茶开花后第5天(泌蜜高峰期)的蜜腺、叶片、花瓣、雄蕊、雌蕊以及花蕾期蜜腺组织中的表达量进行检测。采用TaKaRa(日本)公司生产的RNA提取试剂盒分别提取各组织器官中的总RNA,定量后反转录合成cDNA备用。以普通油茶的actin基因作为内参,每个样品重复3次,采用delta-delta Cp方法分析数据,利用SPSS 18.0软件进行方差分析。实时荧光定量PCR所用actin引物为5′-C T C T G G T G A T G G T G T C AC-3′和5′-C T A T T CA T C G C A T A C C C TC-3′;CRFBPase引物为5′-A A T G C T A A T G G T C T G G CT-3′和5′-A A C A C G T T C T G T G A C A TC-3′,实时荧光定量PCR程序:95℃预变性1 min,95℃变性5 s,60℃退火10 s,72℃延伸15 s,共40个循环。溶解曲线分析:65℃升到95℃,每升高0.5℃停留5 s采集信号。
2 结果与分析
2.1 花蜜蛋白谱分析
通过前期花蜜蛋白提取过程,发现以10 K超滤管纯化的腾冲红花油茶花蜜蛋白效果最佳,且通过SDS-PAGE凝胶电泳分析发现,取得了较好的分离效果。由图1可知,腾冲红花油茶花蜜蛋白电泳图谱共分离出多条明显的蛋白条带,且大部分花蜜蛋白条带主要集中10~120 kD之间,其中位于38 kD分子量的蛋白条带为本试验的目的条带。
2.2 蛋白条带的MALDI-TOF/MS质谱鉴定分析
为获得目的条带的相关信息,将电泳分离后的目的条带(CRFBPase)进行切离,并采用MALDI-TOF/MS质谱法进行鉴定分析。待鉴定的蛋白条带经胰蛋白酶酶切后的肽段混合物于HPLC-MALDI-TOF/MS上分析,所获得的相关质谱数据经Mascot检索,将前4个覆盖率最高的匹配结果排序。由表1可知,CRFBPase蛋白质谱鉴定结果最具可能的是普通油茶1,6-二磷酸果糖醛缩酶(gi|432139323)(覆盖率最高,为17%)。该蛋白质谱鉴定结果初步表明,腾冲红花油茶花蜜的CRFBPase蛋白条带为1,6-二磷酸果糖醛缩酶。
2.3 CRFBPase基因全长cDNA克隆与序列分析
根据质谱鉴定分析结果所匹配到的肽段信息设计特异引物,结合RACE技术,通过测序及序列比对分析,得到CRFBPase的cDNA序列(Genbank登录号: MG764086),其cDNA 全长为1 077 bp(图2、图3),编码358个氨基酸,分子质量为38 428.13 Da,与腾冲红花油茶花蜜蛋白SDS-PAGE电泳图谱的条带一致,等电点理论值为7.56,即生理中性下该蛋白为碱性。带负电荷残基(Asp+Glu)数为38,带正电荷残基(Arg+Lys)数为39,分子式为C1710H2740N462O515S13。估算的半寿期(half-life)分别为30 h(哺乳动物网状细胞,体外)>20 h(酵母,体内)>10 h(大肠杆菌,体内);不稳定指数(instability index)为30.81,属于稳定蛋白。生物软件预测结果表明,腾冲红花油茶花蜜FBPase为亲水性蛋白,与其在花蜜中的存在特性一致,但不存在O糖基化位点和N糖基化位点。为了进一步确定该基因是否为FBP2基因,将测序所得基因序列与基因库中普通油茶FBP2基因序列进行比对分析,发现该基因序列与普通油茶FBP2基因序列同源性高达98.8%。

表1 肽段概况报告Table 1 Peptide summary report
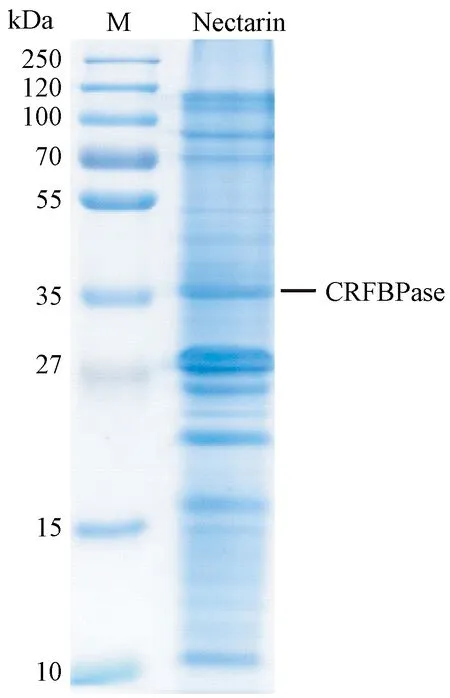
注:M: Marker, 250 kDa蛋白; Nectarin:腾冲红花油茶花蜜蛋白;CRFBPase:目的条带。Note: M: Marker, protein of 250 kDa. Nectarin: Protein in the nectar of Camellia reticulata. CRFBPase: Target band.图1 腾冲红花油茶花蜜蛋白的SDS-PAGE电泳图Fig.1 Tricine SDS-PAGE of nectar proteins in Camellia reticulata
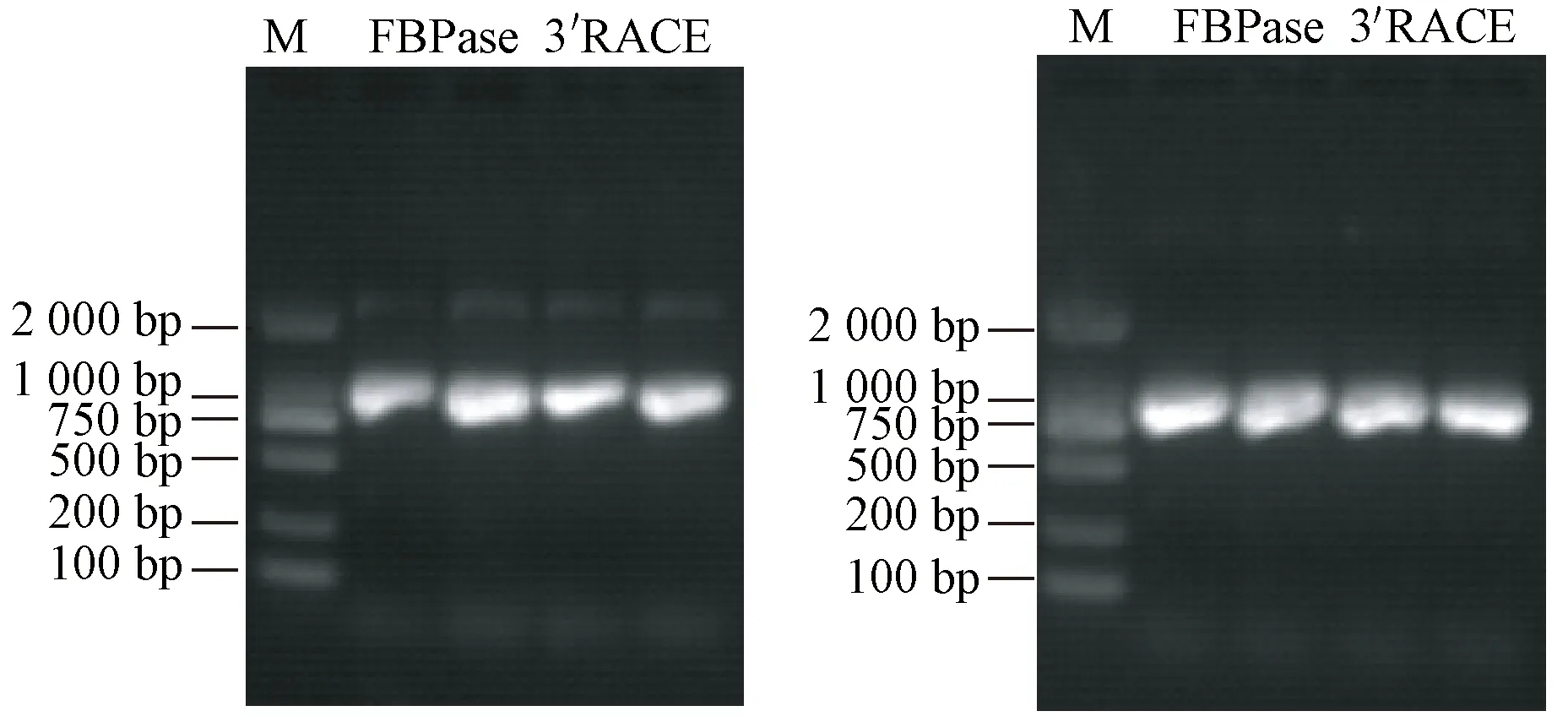
图2 CRFBPase PCR扩增产物电泳图Fig.2 Electrophoresis of PCR amplification products of CRFBPase
2.4 不同累积阶段腾冲红花油茶花蜜中FBP2酶活性检测
由图4可知,累积2 d和5 d的腾冲红花油茶花蜜中均检测到FBP2活性,油茶花蜜中的FBP2活性会随累积时间的增加呈上升趋势,酶活力分别为0.55 U·mL-1和1.68 U·mL-1,二者差异显著(P< 0.05)。
2.5 腾冲红花油茶不同组织和不同时期中CRFBPase基因表达差异分析
在腾冲红花油茶花朵泌蜜高峰期(开花后第5天)的不同组织中均检测到CRFBPase基因的表达,且CRFBPase基因在叶片、开花后第5天蜜腺中有大量表达,其中,开花后第5天的蜜腺中表达量显著高于其他组织,且花瓣、雄蕊、雌蕊中CRFBPase基因表达量均较低且不存在显著差异(图5-A)。此外,腾冲红花油茶花朵泌蜜高峰期蜜腺CRFBPase(开花后第5天)显著高于花蕾期,表明CRFBPase基因表达量会随着蜜腺不断发育而逐渐增加(图5-B)。
3 讨论
Zha等[18]从露珠杜鹃(Rhododendronirroratum)花蜜中鉴定出几丁质酶,但其蛋白表达谱较为简单,仅表现出几条主要的蛋白条带。本研究发现腾冲红花油茶花蜜蛋白表达谱条带众多,且更为复杂,这可能是由于腾冲红花油茶属于高度依赖传粉者的授粉植物,而冬季传粉者匮乏,其通过分泌更多的花蜜蛋白以响应外界环境的变化,因而表现出极为复杂的蛋白表达谱。比对腾冲红花油茶与普通油茶的FBP2基因,发现二者高度同源(同源性高达98.8%),表明腾冲红花油茶花蜜中确实含有FBP2,且与普通油茶FBP2执行类似的功能。此外,在累积不同天数条件下的花蜜中也检测到了FBP2活性,进一步证实了这一结果。


注:字体加粗区域为质谱检测出的对应肽段序列,下划线部分为5′和3′特异性引物。Note: The peptides identified by MS are indicated in bold. The 5′ and 3′ends of primers are indicated in underline.图3 CRFBPase基因编码区核酸序列及推导氨基酸序列Fig.3 Nucleotide and deduced amino acid sequences of CRFBPase coding region in Camellia reticulata

注:不同小写字母表示在0.05水上平差异显著。下同。Note:Different lowercase letters indicate significant difference at 0.05 level. The same as following.图4 不同累积天数的花蜜中1,6-二磷酸果糖醛缩酶活性Fig.4 Fructose -1,6-Bisphosphate Aldolase activity of fresh nectar in different accumulating condition

图5 不同组织(A)和不同时期(B)CRFBPase基因的相对表达量Fig.5 The CRFBPase relative expression level of different Camellia reticulata tissues (A) and different phase of nectaries(B)
目前,国内外植物花蜜蛋白的研究相对较少,仅分离鉴定出少数几种花蜜蛋白并对其调控机制进行了详细的阐述,所鉴定出的花蜜蛋白大部分为直接具有抑菌功能的蛋白或是参与某些抑菌机制的调控蛋白,其中最为经典的是从烟草花蜜中鉴定出的5种蛋白共同构成一个完整的循环过程来实现花蜜的抑菌功能[13-15]。此外,有研究者鉴定出几种参与花蜜中糖类代谢过程的相关蛋白,即蔗糖转化酶、转葡糖苷酶和转果糖苷酶,并对其功能进行了相应的探讨,发现花蜜中3种主要糖类物质(蔗糖、葡萄糖和果糖)的组成比例是由这些糖代谢酶调控的[2]。本研究从腾冲红花油茶花蜜中鉴定出的FBP2与已报道的其他花蜜蛋白存在差异。研究表明,FBP2主要参与植物体内的糖酵解途径、糖异生途径、磷酸戊糖途径和卡尔文循环,是植物体糖代谢和能量代谢过程的重要酶之一。目前大部分FBP2相关研究主要集中于FBP2在植物体内的激素调控过程和抗逆过程种所起的调控功能,并对其具体调控机制进行了详细的阐述[30-32]。但本研究在腾冲红花油茶花蜜中鉴定出的FBP2可能主要起着调节花蜜糖类组分的作用,以及为花蜜分泌过程提供能量来源,其原因可能是腾冲红花油茶授粉高度依赖传粉者,因此需要分泌更多的花蜜来吸引传粉者,从而其能量消耗也更高,故蜜腺中的FBP2可能参与有关能量代谢的过程,为植物花朵分泌花蜜提供大量的能量支持。在花蜜调控过程中起着重要功能的花蜜蛋白通常会在泌蜜高峰期的蜜腺中大量表达[16]。本研究CRFBPase基因在泌蜜高峰期(开花后第5天)的蜜腺中表达量最高,这与前人研究结果一致。究其原因,可能是开花后第5天的蜜腺会分泌大量花蜜,因而需要大量表达FBP2,参与能量代谢过程以获得分泌所需的能量,也可能是随着受精过程的完成,子房逐渐发育膨大过程也需要大量的能量支持,这也解释了开花后第5天的子房中CRFBPase基因表达量最高的现象。此外,FBP2在花蜜前体物质(prenectar)形成过程可能是先进入到花蜜前体物质,随后转运至囊泡中,囊泡经胞间连丝作用转运至共质体,最后通过胞吐作用分泌至花蜜中[2]。
FBP2也是光合器官中碳固定途径的关键酶,参与淀粉的合成途径[33]。已有研究表明,花蜜中的糖组分(蔗糖、果糖、葡萄糖)部分来源于淀粉水解[20]。因此,腾冲红花油茶花蜜中的FBP2可能对花蜜糖组分的原料物质形成过程起着重要作用,进而调控花蜜中糖组分的比例。腾冲红花油茶CRFBPase基因在盛花期蜜腺中表达量较高,进一步证实FBP2在花蜜糖组分调节过程中起到一定的作用。
4 结论
本研究从腾冲红花油茶花蜜中鉴定并克隆获得了CRFBPase基因,其cDNA全长为1 077 bp,编码358个氨基酸残基,分子质量为38 428.13 Da。CRFBPase基因序列与普通油茶FBP2基因序列同源性高达98.8%。CRFBPase基因在各种组织中均有表达,且在开花后第5天的蜜腺中表达量最高,FBP2酶活性随着花蜜分泌累积时间延长而增加。本研究结果为揭示花蜜中糖类物质的具体调控过程奠定了一定的理论基础。但FBR2蛋白在花蜜中的具体功能和作用机制,仍需进一步更深入的研究。

