谷子高效离体再生基因型和培养基的筛选
贺榆婷 卫云丰 张 洁 郭永正 叶 玲 韩渊怀王兴春,3,* 杨致荣,3,*
(1 山西农业大学生命科学学院,山西 太谷 030801;2 山西农业大学文理学院,山西 太谷 030801;3 杂粮种质资源发掘与遗传改良山西省重点实验室, 山西 太谷 030801;4 山西农业大学农学院,山西 太谷 030801)
谷子(SetariaitalicaL.Beauv)为禾本科狗尾草属一年生草本植物,原产于我国[1-3]。研究表明,谷粒中含有丰富的蛋白质、脂肪、维生素等营养元素[4]。随着人们生活水平的不断提高及食品的多样化和营养化,谷子受到了消费者的广泛青睐。此外,谷子的耐旱能力极强,需水量远低于小麦、玉米和高粱等旱生禾本科作物,培育谷子对于应对干旱威胁、保障粮食安全具有重要的意义[5-10]。近年来,已有以谷子为模式植物进行功能基因组学研究的报道,但与拟南芥、水稻等模式植物相比,谷子的离体再生困难,遗传转化效率极低,严重阻碍了谷子基因功能的研究和育种应用[11-13]。
1971年Ban等[3]首次利用谷子四分体至单核小孢子期的花药进行培养,成功诱导出胚性愈伤组织并获得完整植株。许智宏等[14]于1983年在我国首次以谷子幼穗为外植体进行愈伤的诱导,并成功获得了再生植株。此后,Xu等[15]、Rao等[16]和Osuna-Avila等[17]分别以谷子幼穗、成熟胚、茎尖等材料作为外植体进行组织培养均成功获得了再生植株。近几年大量研究者开展了谷子组织培养和遗传转化的研究[18-20],其中,Ceasar等[21]利用谷子茎尖直接再生出幼苗,并成功地应用于谷子磷转运蛋白的研究,极大地简化了谷子组织培养的操作步骤。此外,谷子的近缘野生种狗尾草(Setariaviridis)的组织培养和遗传转化也取得了成功,为谷子相关研究提供了借鉴[22-23]。
目前虽然对谷子离体再生体系和遗传转化体系的建立已有相关研究报道,但谷子离体再生和遗传转化效率仍远低于水稻和拟南芥等模式植物[13]。因此,提高谷子离体再生和遗传转化效率对谷子作为模式植物进行功能基因组学研究和遗传改良具有重要意义[24]。
植物的离体再生可以通过愈伤组织和直接再生2种途径,与其他植物类似,基因型和培养基成分是决定谷子愈伤组织诱导和离体能否成功的关键[16, 25-28]。因此,本研究选取了90份谷子种质资源进行离体再生试验,从中筛选出3份高效离体再生材料,进一步利用这3份材料进行了培养基成分的优化,旨在建立谷子高效离体再生体系,为谷子功能基因组学研究和遗传改良奠定一定的理论和技术基础。
1 材料与方法
1.1 试验材料
选取中国、印度等19个国家的90份谷子种质资源进行高效离体再生基因型的筛选。这些材料既包括豫谷1号、晋谷21等生产中大面积栽培的品种,也包括山西农业大学杂粮分子育种团队创制的xiaomi和mop1等超短生育期材料以及一些农家品种(具体种质信息详见表1)。
MS培养基购自美国PhytoTechnology Laboratories 公司,货号 M519。2,4-二氯苯氧乙酸(2,4-dichlorophenoxyacetic acid, 2,4-D)购自北京Solarbio公司,货号 D8100。激动素(kinetin, KT)购自德国Sigma-Aldrich公司,货号 K0753。 反式玉米素(trans-zeatin, ZT)购自北京Solarbio公司,货号 T8110。萘乙酸(α-naphthalene acetic acid,NAA)购自北京Solarbio公司,货号 N8010。
1.2 试验方法
1.2.1 培养基配制 愈伤诱导培养基(callus induction medium, CIM)采用已报道的谷子或狗尾草组织培养的4个配方,具体配方如下:
CIM1[29]:4.43 g·L-1MS + 30 g·L-1蔗糖 + 35 mg·L-1ZnSO4·7H2O + 0.6 mg·L-1CuSO4·5H2O + 4 g·L-1植物凝胶(phytagel)+ 2 mg·L-12,4-D+ 0.5 mg·L-1KT;
CIM2[26]:4.43 g·L-1MS + 30 g·L-1蔗糖 + 4 g·L-1phytagel + 2 mg·L-12,4-D + 1 mg·L-1ZT;
CIM3[16]:4.43 g·L-1MS + 30 g·L-1蔗糖 + 4 g·L-1phytagel + 2 mg·L-12,4-D + 0.5 mg·L-1KT;
CIM4[30]:4.43 g·L-1MS + 30 g·L-1蔗糖 + 4 g·L-1phytagel + 4.5 mg·L-1NAA + 0.1 mg·L-1KT。
生芽培养基(plant regeneration medium,PRM)和生根培养基(root medium,RM)均采用Eck等[29]的配方。其中,PRM配方为4.43 g·L-1MS + 20 g·L-1蔗糖 + 4 g·L-1phytagel + 0.5 mg·L-1KT;RM培养基的配方为2.215 g·L-1MS + 20 g·L-1蔗糖 + 4 g·L-1phytagel。
培养基于121℃高压灭菌20 min,2,4-D、KT、ZT和NAA等激素在灭菌后冷却至60℃左右时加入。
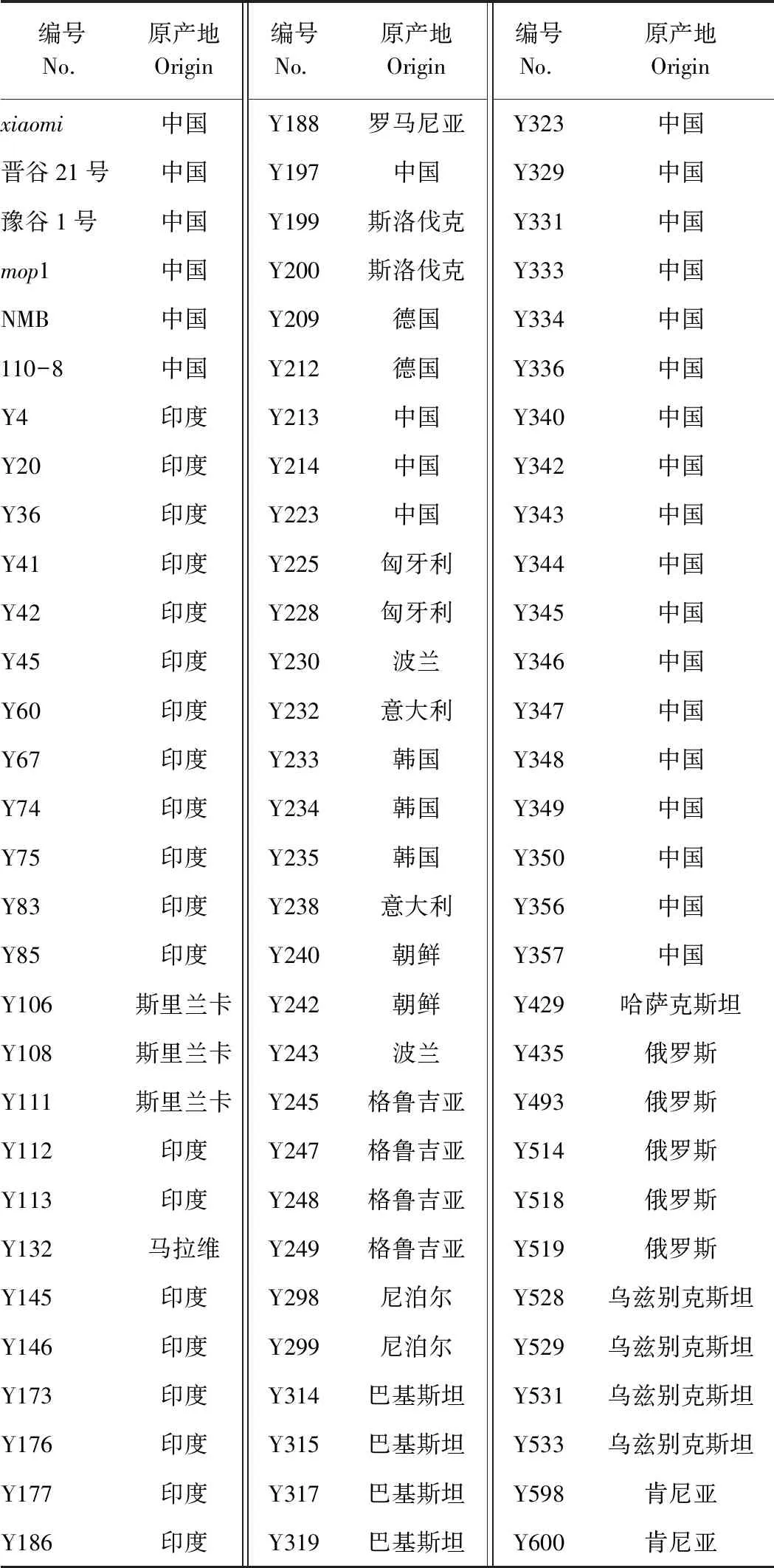
表1 90份谷子种质资源信息Table 1 The information of 90 foxtail millet germplasms
1.2.2 种子消毒及接种 用砂纸将成熟种子表面的谷壳剥去(注意力度不能太大,以免伤害种子胚)。从中挑选饱满无损伤的种子进行消毒,具体方法:先用75%乙醇浸泡5 min,再用20%次氯酸钠溶液浸泡20 min,将消毒后的种子在超净工作台中用无菌水冲洗5遍,最后将种子置于无菌滤纸上晾干。每个处理组接种5个培养皿,每个培养皿15粒种子,单粒均匀摆放在CIM培养基上,于24~26℃暗培养 20 d 左右。高效离体再生种质资源的筛选均采用CIM1进行。
1.2.3 继代培养 待愈伤诱导15~25 d后统计出愈率,然后挑选质量较好的愈伤组织转接至新的CIM进行继代培养,每2周继代1次。按照公式计算出愈率:
出愈率=诱导产生的愈伤组织块数/接种的外植体数×100%
(1)。
1.2.4 芽分化培养 将表面干燥致密,且具有一定硬度的胚性愈伤组织转接到PRM上进行芽的诱导,光周期为26℃光照16 h/24℃黑暗8 h,光照强度为10 000 Lx。2周继代1次,1周后愈伤组织的表面开始出现绿点,3至5周绿点逐渐长成绿芽,统计并计算芽分化率:
芽分化率=产生的绿芽数/接种的愈伤组织块数×100%
(2)。
1.2.5 根再生培养 当绿芽长至1~3 cm时,先将绿芽转接到RM上诱导生根,2周后长出根系。为了增加其成活率,再将其转至生根培养瓶中。苗高约6 cm时,打开培养瓶的瓶盖,炼苗1 d。最后,将其移栽到营养土中,统计并计算再生率:
再生率=诱导分化形成的植株数/接种的外植体数×100%
(3)。
1.2.6 最佳CIM培养基的筛选 筛选出再生效率较高的谷子品种后,为了提高其出愈率和愈伤的品质,需筛选出最适合该品种的培养基。从CIM1、CIM2、CIM3和CIM4这4种不同诱导愈伤的培养基中筛选出愈率较高,且愈伤组织质量好(致密有颗粒状)的培养基配方。
1.3 数据统计与分析
采用Microsoft Excel 2003和SPSS 20软件进行数据处理和分析。
2 结果与分析
2.1 谷子成熟胚离体再生
首先,挑选饱满无霉变的谷子种子,砂纸打磨脱壳(图1-A),然后利用75%乙醇和20%次氯酸钠消毒,接种到CIM培养基诱导愈伤组织。最初诱导的愈伤组织含水较多,质地较软,不适宜直接诱导芽(图1-B)。继代培养1~2次后愈伤呈淡黄色、质地较硬,且胚性愈伤率较高(图1-C)。然后将胚性愈伤组织转移到PRM培养基,培养1周左右即出现绿点,3~5周长出绿芽(图1-D)。将绿芽移栽到装有RM培养基的培养皿中诱导生根(图1-E);2周后移栽至装有RM培养基的培养瓶中,继续培养至幼苗出现大量根系,株高5~6 cm时移栽至装有土壤的盆中(图1-F、G)。

注:A:未脱壳(上)和脱壳(下)的成熟种子;B:Y41在CIM诱导15 d的愈伤;C:Y41在CIM继代2周的愈伤组织;D:Y41在PRM上诱导的再生芽;E:Y41在RM上再生出的根;F:培养瓶里的Y41幼苗;G:移栽到土里的Y41再生植株。标尺:A:2 mm; B~E:2 cm; F:5 cm; G:20 cm。Note: A: Husked (top) and dehusked (below) mature seeds. B: Callus of Y41 on CIM for 15 days. C: Callus of Y41 subcultured for two weeks on CIM. D: Buds of Y41 induced on PRM. E: Roots of Y41 induced on RM. F: Seedlings of Y41 in culture flasks. G: Regenerated plants of Y41 transplanted into the soil. Bar: A: 2 mm. B-E: 2 cm. F: 5 cm, G: 20 cm.图1 谷子成熟胚离体再生过程Fig.1 In vitro regeneration process of mature embryo of millet
2.2 不同基因型谷子的离体再生效率分析
由图2可知,所有基因型都可以形成愈伤组织,但不同基因型谷子的出愈率、芽分化率和再生率差异较大,其中出愈率在80%~90%的最多,有27个品种,占总数的30%(图2-A)。但芽分化率和再生率普遍较低,10%以下的分别占54%和68%,仅有少数种质资源芽分化率和再生率在30%以上(图2-B、C)。由表2可知,Y429出愈率最低,仅为17.67%;Y342出愈率最高,达93.67%。芽分化率介于0%~78.89%之间,其中以Y108最高,为78.89%;再生率介于0%~40.00%之间,其中以Y41最高,为40.00%。但一些种质资源(如Y329)虽然出愈率较高,但芽分化率和再生率均为0%,表明愈伤形成和芽分化之间无相关性。出愈率高于90%的有11个品种,分别为Y41、Y112、Y113、Y145、Y176、Y238、Y329、Y336、Y342、Y348、Y356;芽分化率高于50%的有6个品种,分别为Y41、Y108、Y112、Y113、Y145、Y176;再生率高于30%的有5个品种,分别为Y41、Y108、Y145、Y176、Y348,其中同时满足以上3个条件的有3个品种,分别为Y41、Y176、Y145,其出愈率分别为92.67%、90.67%、91.67%,芽分化率分别为62.92%、76.71%、60.76%,再生率分别为40.00%、37.33%、36.00%。

图2 90种不同种质资源的离体再生情况Fig.2 In vitro regeneration of 90 different germplasm resources
2.3 高效品种的培养基筛选
不同基因型的种质资源对激素的反应存在差异。为了建立Y41、Y145和Y176这3个种质资源最佳的离体再生体系,将其分别培养在CIM1、CIM2、CIM3和CIM4这4种谷子或狗尾草愈伤诱导常用的培养基,15 d后统计其愈伤形成情况。结果表明,这3个品种在4种培养基条件下的愈伤生长情况一致(图3)。虽然3个品种的出愈率在4种培养基上的差异没有达显著水平,但其愈伤品质差异较大(图4)。其中,Y41、Y145和Y176这3个种质在CIM4上的出愈率均最低,愈伤较小,芽较长,因此CIM4不适于Y41、Y145和Y176愈伤的诱导(图3-D、H、L)。在CIM1培养基上的愈伤较小,且褐化较明显(图3-A、E、Ⅰ);CIM2培养基上的愈伤个别有明显增大的现象,但整体愈伤质量不均匀(图3-B、F、J);CIM3培养基上的愈伤组织状态最佳,愈伤颜色淡黄,为致密的硬颗粒状(图3-C、G、K),因此可选择CIM3对筛选出的高效谷子品种进行大规模组织培养。
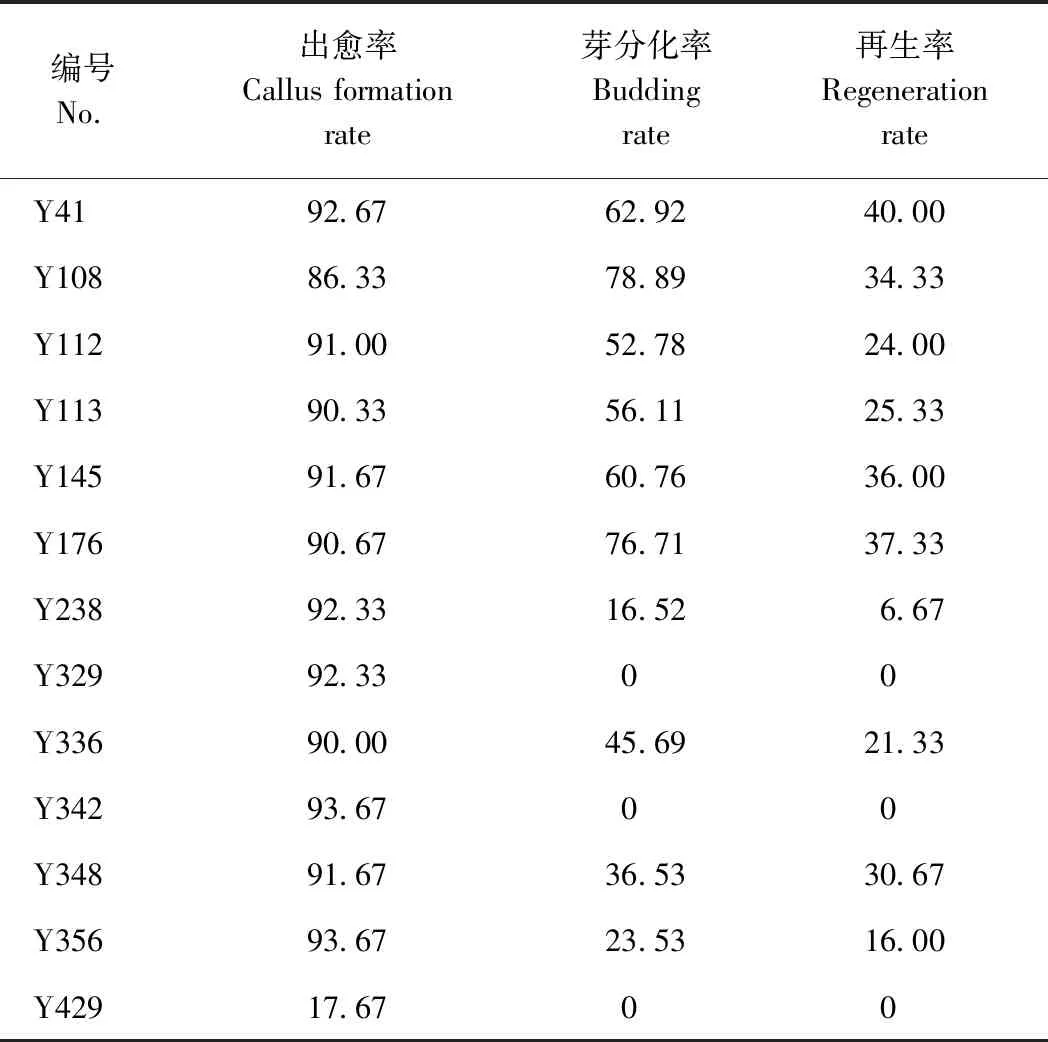
表2 代表性谷子种质资源Table 2 Millet germplasm resources with significant data /%
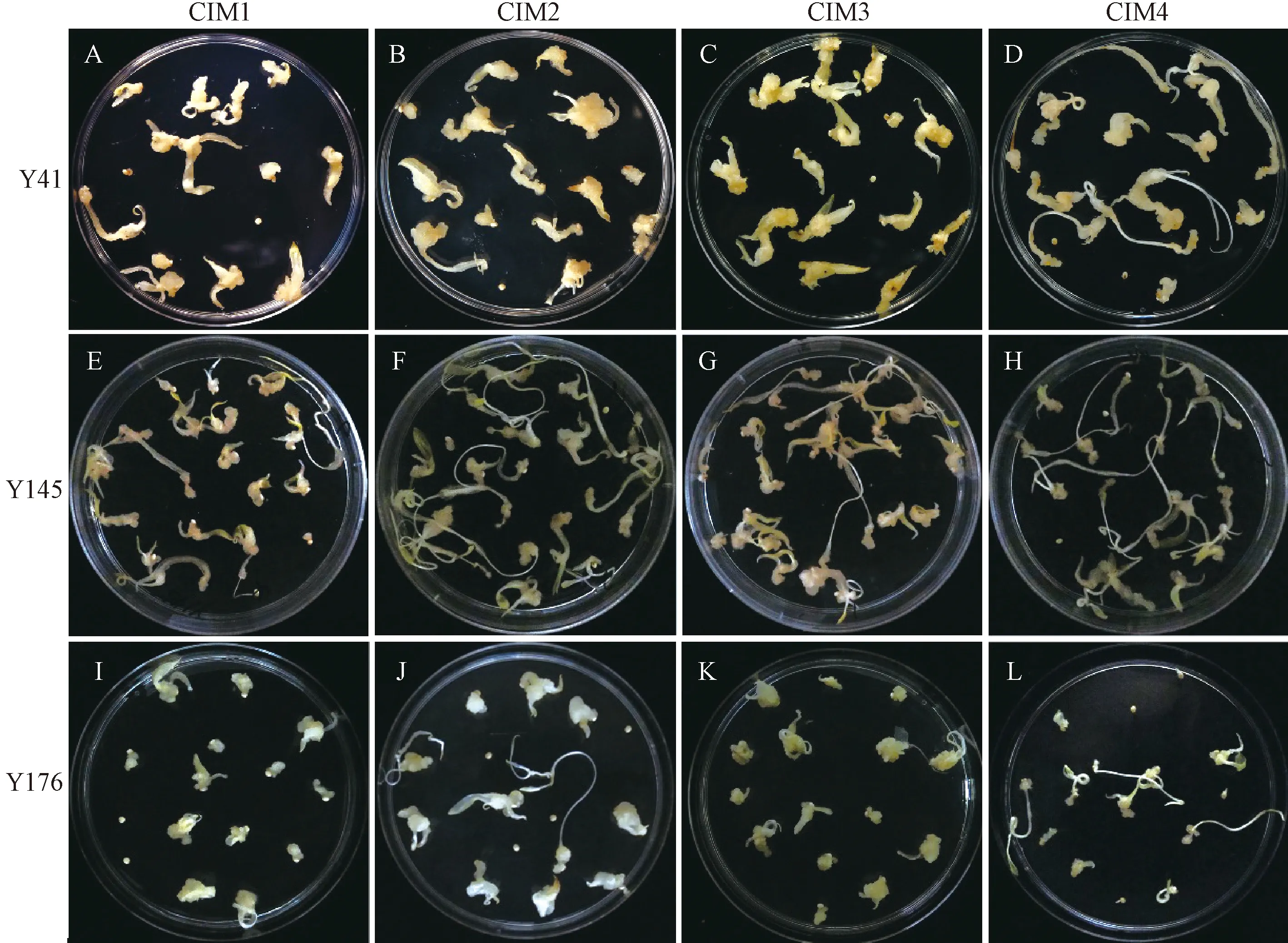
注:A~D:Y41分别在CIM1、CIM2、CIM3和CIM4培养基上15 d的愈伤情况;E~H:Y145分别在CIM1、CIM2、CIM3和CIM4培养基上15 d的愈伤情况;I~L:Y176分别在CIM1、CIM2、CIM3和CIM4培养基上15 d的愈伤情况。Note: A-D: Callus of Y41 on CIM1,CIM2,CIM3 and CIM4 for 15 days, respectively. E-H: Callus of Y145 on CIM1,CIM2,CIM3 and CIM4 for 15 days, respectively. I-L: Callus of Y176 on CIM1,CIM2,CIM3 and CIM4 for 15 days,respectively.图3 Y41、Y145和Y176在4种培养基下的愈伤情况Fig.3 The callus of Y41,Y145 and Y176 on four different callus induction media
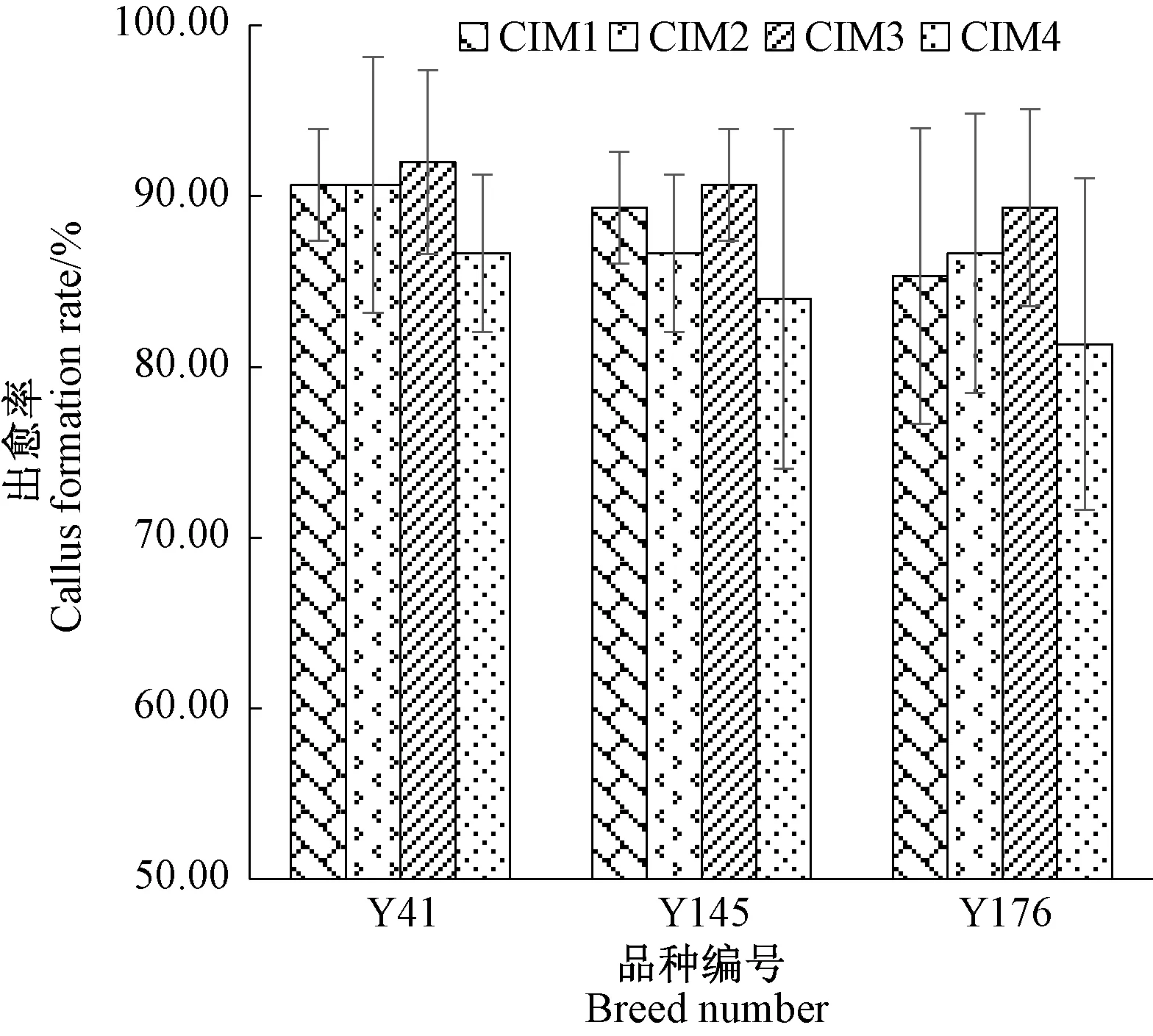
图4 Y41、Y145和Y176在不同愈伤诱导培养基上的出愈率Fig.4 The callus formation rate of Y41, Y145 and Y176 on different callus induction medium
3 讨论
谷子既是重要的杂粮作物,又是新兴的模式植物,因其独特的营养价值和耐旱性受到了人们广泛的关注[5-8, 10, 22]。但目前谷子遗传学研究面临着离体再生效率低、遗传转化困难等诸多技术挑战,极大地限制了谷子的生产[13]。本研究对90份国内外种质资源的离体再生情况进行分析,从中筛选出3份(Y41、Y145和Y176)高效离体再生的种质资源,并在此基础上,筛选了适于这3份种质资源愈伤形成的培养基(CIM3),为高效离体再生体系和遗传转化体系的建立奠定了基础。
谷子种子包裹在外稃中,组织培养时很难彻底消毒,污染极其严重,一般都需要多次灭菌步骤[31-32]。Lin等[33]利用不完全去壳的种子简化了灭菌步骤,但也需要将近7 h,因此,在组织培养前进行脱壳处理会简化灭菌步骤、减少时间。本研究利用砂纸打磨的方法去除外壳[34],尽管与直接用手剥离外壳相比胚胎损伤率略高,但极大提高了脱壳效率并降低了污染率。此外,本研究发现谷子种子成熟后及早收获,减少后期雨水浸泡,也可极大降低组织培养污染的概率,因为不良的环境会降低种子活力,更易遭受霉菌侵染[35]。CIM培养基上愈伤培养的时间和继代次数对谷子离体再生效率有较大影响。本研究结果表明,10 d内的愈伤较小,呈水浸状,不适宜进行直接诱导芽;随后,愈伤开始明显增大、质地变硬,15 d后愈伤质量较好,但超过25 d的愈伤褐化比较严重,因此要在15~25 d内视愈伤情况进行继代。但继代超过2次,愈伤褐化、老化情况严重,这与柳琳[36]和赵辉等[37]进行成熟胚诱导愈伤的情况相似。诱导生根时,可以先移至培养皿里,由于培养皿面积大,光照充足,幼苗发育较好。2周后转移至培养瓶,以利于幼苗生长发育。
研究表明,基因型是影响植物离体再生效率的首要因素[27-28]。本试验结果表明,90份谷子种质资源出愈率、芽分化率和再生率存在较大差异,出愈率最高为93.67%,最低仅为17.67%;芽分化率最高为78.89%,最低为0%;再生率最高为40.00%,最低为0%,这进一步验证了基因型是影响再生率的关键因素。此外,同一品种在不同培养基上的愈伤品质不同,这与王节之等[25]、李惠[30]和Satish等[38]的结论相似,在培养基中加入玉米素(ZT),愈伤确实有膨大现象,与袁进成等[26]的结论一致,但只是个别愈伤膨大。因此,选择高效离体再生的基因型和合适的培养基可有效提高谷子组织培养和遗传转化效率。此外,谷子高出愈率并不一定能保证高再生率,其原因可能是愈伤诱导培养基可能不适于这些出愈率较高的品种,如出愈率较高的Y342和Y329愈伤组织呈水浸状或者胶状,不易于后续的继代和再生,导致再生率较低。因此,在今后的试验中可进一步优化愈伤诱导培养基,Y342、Y329等种质资源有望获得高质量的愈伤组织,从而提高其再生率。
本研究从90份谷子种质资源中筛选出了Y41、Y145和Y176这3个高效离体再生的种质资源,为后续谷子遗传转化和遗传改良奠定了基础。但这3个种质资源农艺性状较差,种子较小且植株分蘖较多,性状类似于狗尾草,驯化程度较低。尤其是Y176千粒重仅为2.635 g,不适宜在生产中大面积推广。后续研究可将其与晋谷21、豫谷1号和冀谷11号等名优品种进行杂交,将高效离体再生基因转到名优品种中。虽然这3个高效离体再生的种质资源在CIM3培养基上出愈率最高,且愈伤质量也较好,但CIM3培养基是否适合所有的种质资源还有待进一步研究。
4 结论
本研究结果表明,基因型是影响谷子离体再生效率的重要因素,不同种质资源的出愈率介于17.67%~93.67%之间,芽分化率介于0%~78.89%之间,再生率介于0%~40.00%之间。出愈率高的种质资源不一定再生率高,但再生率高的种质资源一般具有较高的出愈率,因此在筛选高效再生种质资源时应综合考虑这2个因素。从90份国内外谷子种质资源中筛选到3份(Y41、Y145和Y176)出愈率、芽分化率和再生率均较高的种质资源,这3个种质资源在CIM3愈伤诱导培养基上具有较高的出愈率,且愈伤组织质量较高。本研究结果为谷子高效离体再生体系和遗传转化体系的建立奠定了一定的理论基础。

