雷公藤多苷通过JAK2/STAT3信号通路减轻溃疡性结肠炎大鼠肠黏膜细胞凋亡及炎症的实验研究
步楠,王烨,王瑞,孙理婷,范彦秋
溃疡性结肠炎(ulcerative colitis,UC)是累及直 肠及结肠黏膜层、黏膜下层的非特异性炎症性疾病,临床表现为腹泻、腹痛、黏液脓血便,病情迁延不愈、治疗难度大。肠黏膜Janus激酶2(JAK2)/信号转导与转录激活子3(STAT3)信号通路介导的炎症反应持续激活以及黏膜上皮细胞过度凋亡是UC重要的病理特征,抗炎和抗凋亡被认为是治疗UC的潜在靶点[1-2]。雷公藤多苷(tripterygium glycosides,TG)是从卫矛科植物雷公藤根茎中提取得到的活性成分,因其具有免疫调节作用被用于类风湿性关节炎的治疗[3]。近年来关于TG药理活性作用的研究发现,TG能够在包括肠黏膜在内的多种组织中发挥抗炎及抗凋亡作用[4-5]。本研究分析了TG通过JAK2/STAT3信号通路对UC大鼠肠黏膜凋亡及炎症的调节作用,旨在探讨TG在UC治疗中的价值。
1 材料与方法
1.1 材料
1.1.1 实验动物
40只SPF级的雄性SD大鼠购于购自黑龙江省中医药大学,许可证号SCXK(黑)2016-004,由佳木斯医学院实验动物中心饲养。
1.1.2 实验试剂
TG、三硝基苯磺酸、乙醇购自Sigma公司;TUNEL试剂盒、Western-blot所用试剂购自上海碧云天公司;Bcl-2、Bcl-xL、Caspase-9、Caspase-3的单克隆抗体购自Abcam公司;酶联免疫吸附(Elisa)试剂盒购自上海西唐公司。
1.2 方法
1.2.1 动物分组及造模
SD大鼠随机分为对照组、UC组、TG组、AG490组,每组各10只。UC组、TG组、AG490组采用三硝基苯磺酸/乙醇灌肠的方式建立UC模型:腹腔注射10%水合氯醛麻醉,按照100 mg/kg的剂量抽取三硝基苯磺酸0.25 mL与0.25 mL的50%乙醇混合,将输液导管插入肛门上段8 cm后缓慢注入三硝基苯磺酸与乙醇混合液,头向下倒置3 min后完成造模。对照组采用与UC组、TG组、AG490组相同的方法麻醉,采用0.5mL生理盐水灌肠后头向下倒置3 min,完成操作。
1.2.2 给药方法
造模后第2天开始进行药物干预,TG组按照27 mg/kg的剂量、0.02 mL/g的体积配置TG溶液灌胃给药,对照组和UC组给予生理盐水0.02 mL/g灌胃,AG490组按照8mg/kg的剂量给予AG490腹腔注射。连续干预14 d后处死大鼠,收集肠黏膜组织。
1.2.3 细胞凋亡检测
取肠黏膜组织,按照TUNEL试剂盒的说明书进行染色操作,在显微镜下观察5个随机高倍视野,对每个视野内的细胞总数及细胞凋亡数进行计数,计算细胞凋亡率。
1.2.4 基因表达的Western-blot检测
取肠黏膜组织,采用蛋白裂解液提取总蛋白,采用BCA试剂盒对总蛋白进行定量,取50μg总蛋白加入预先配置好的SDS-聚丙烯酰胺凝胶中,垂直电泳后将转膜至硝酸纤维素(NC)膜,NC膜在5%脱脂牛奶中封闭2 h后孵育1∶1 000的Bcl-2、Bcl-xL、Caspase-9、Caspase-3、p-JAK2、p-STAT3、JAK2、STAT3、β-actin单克隆抗体,4℃过夜;TBST洗涤3次后孵育辣根过氧化物酶第二抗体1 h,TBST洗涤3次并加入显影液,在天能化学发光成像系统中曝光得到Bcl-2、Bcl-xL、Caspase-9、Caspase-3、β-actin的蛋白条带,用Image-J软件扫描蛋白条带的灰度值,计算Bcl-2、Bcl-xL、Caspase-9、Caspase-3与 βactin的比值作为Bcl-2、Bcl-xL、Caspase-9、Caspase-3的表达水平,计算p-JAK2与JAK2、p-STAT3与STAT3的比值作为p-JAK2、p-STAT3的表达水平。
1.2.5 细胞因子含量的Elisa检测
取肠黏膜组织,采用蛋白裂解液提取总蛋白后按照Elisa试剂盒的说明书进行操作,检测组织总蛋白中TNF-α、IL-1β、IL-6的含量。
1.3 统计学方法
采用SPSS 23.0统计软件对研究数据进行处理。计量资料以¯±s表示,三组间比较采用单因素方差分析,两两比较采用SNK-q检验;两组间比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 TG干预对UC模型大鼠肠黏膜细胞凋亡率的调节
与对照组比较,UC组大鼠肠黏膜细胞凋亡率明显升高(P<0.05);与UC组比较,TG组大鼠肠黏膜细胞凋亡率明显下降(P<0.05),见图1。
2.2 TG干预对UC模型大鼠肠黏膜细胞凋亡基因表达的调节
与对照组比较,UC组大鼠肠黏膜Bcl-2、Bcl-xL的表达(图2)水平明显下降,Caspase-9、Caspase-3的表达水平明显升高(P<0.05);与UC组比较,TG组大鼠肠黏膜Bcl-2、Bcl-xL的表达水平明显升高,Caspase-9、Caspase-3的表达水平明显下降(P<0.05),见表1。
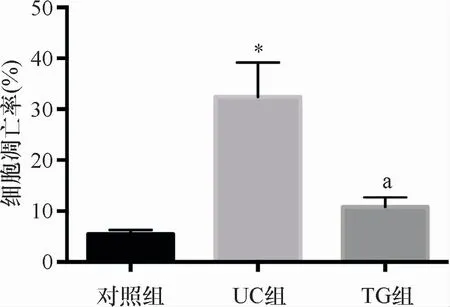
图1 三组细胞凋亡率比较 三组比较,F=121.742、P=0.000;与对照组比较,*P<0.05;与UC组比较,a P<0.05
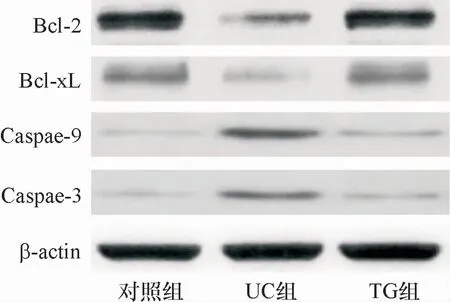
图2 三组凋亡基因表达的蛋白电泳图
表1 三组凋亡基因表达的比较(¯±s)
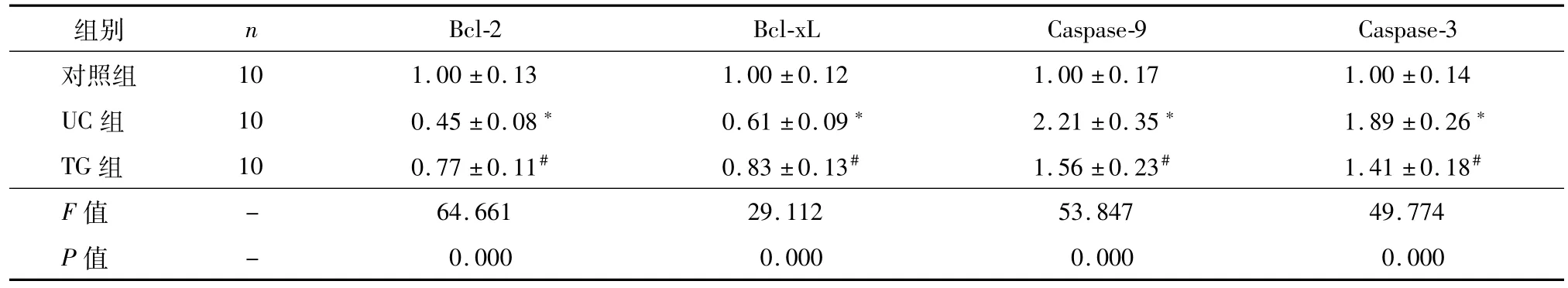
表1 三组凋亡基因表达的比较(¯±s)
注:与对照组比较,*P<0.05;与UC组比较,#P<0.05
Bcl-2 Bcl-xL Caspase-9 Caspase-3对照组组别 n 10 1.00±0.13 1.00±0.12 1.00±0.17 1.00±0.14 UC组 10 0.45±0.08* 0.61±0.09* 2.21±0.35* 1.89±0.26*TG组 10 0.77±0.11# 0.83±0.13# 1.56±0.23# 1.41±0.18#F值64.661 29.112 53.847 49.774 P值-0.000 0.000 0.000 0.000-
2.3 TG干预对UC模型大鼠肠黏膜炎症细胞因子含量的调节
与对照组比较,UC组大鼠肠黏膜TNF-α、IL-1β、IL-6的含量明显升高(P<0.05);与UC组比较,TG组大鼠肠黏膜TNF-α、IL-1β、IL-6的含量明显下降(P<0.05),见表2。
表2 三组炎症细胞因子含量的比较(¯±s,ng/mL)
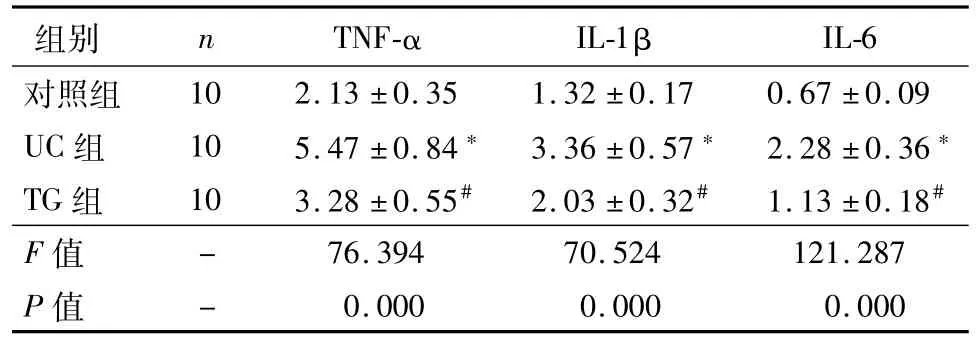
表2 三组炎症细胞因子含量的比较(¯±s,ng/mL)
注:与对照组比较,*P<0.05;与UC组比较,#P<0.05
IL-6对照组组别 n TNF-α IL-1β 10 2.13±0.35 1.32±0.17 0.67±0.09 UC组 10 5.47±0.84*3.36±0.57*2.28±0.36*TG组 10 3.28±0.55#2.03±0.32#1.13±0.18#F值- 76.394 70.524 121.287 P值- 0.000 0.000 0.000
2.4 TG干预对UC模型大鼠肠黏膜JAK2/STAT3的调节
与对照组比较,UC组大鼠肠黏膜p-JAK2、p-STAT3的表达水平明显升高(P<0.05);与UC组比较,TG组大鼠肠黏膜p-JAK2、p-STAT3的表达水平明显下降(P<0.05),见图3、表3。
2.5 JAK2/STAT3抑制剂AG490对大鼠肠黏膜细胞凋亡率、凋亡基因表达、炎症细胞因子含量的调节
与UC组比较,AG490组大鼠肠黏膜细胞凋亡率、Caspase-9及Caspase-3的表达水平、TNF-α、IL-1β、IL-6的含量均明显下降,Bcl-2、Bcl-xL的表达水平明显升高(P<0.05),见图4、图5、表4、表5。

图3 三组JAK2/STAT3表达的蛋白条带图
表3 三组JAK2/STAT3表达的比较(¯±s)
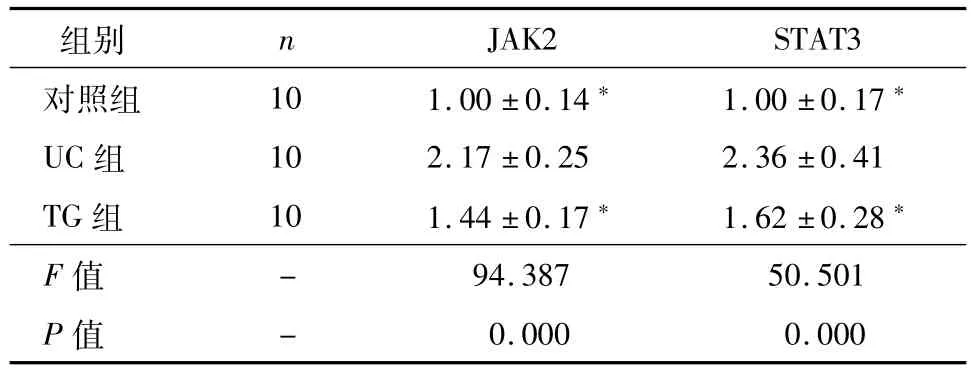
表3 三组JAK2/STAT3表达的比较(¯±s)
注:*与UC组比较,P<0.05
JAK2 STAT3对照组 10 1.00±0.14* 1.00±0.17组别 n*UC组 10 2.17±0.25 2.36±0.41 TG组 10 1.44±0.17* 1.62±0.28*F值94.387 50.501 P值-0.000 0.000-
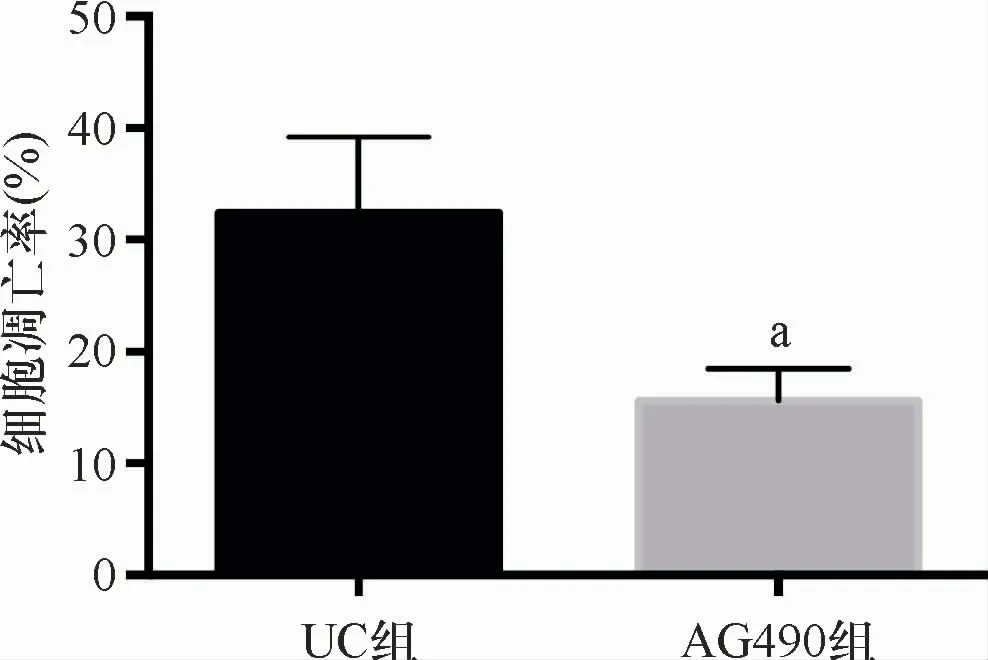
图4 AG490对细胞凋亡的调节作用 a与UC组比较,t=7.127,P=0.000
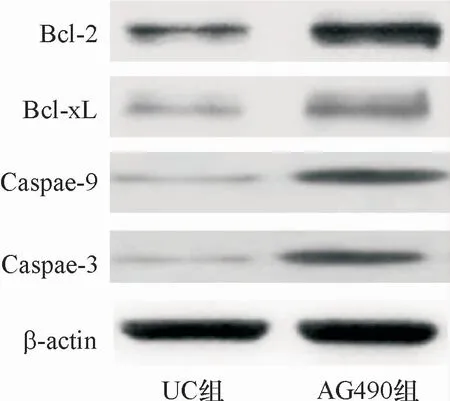
图5 AG490对凋亡基因表达调节作用的蛋白电泳图
3 讨论
UC的发病涉及多环节、多因素,自身免疫应答、炎症反应、肠道菌群、遗传等均被认为与疾病的发生有关,但具体机制仍未明确,治疗也较为棘手。TG是临床上用于自身免疫性疾病类风湿性关节炎治疗的免疫调节药物,从雷公藤的根茎中提取得到[6-7]。近年来的研究证实TG不仅具有免疫调节活性,还具有抗炎、抗凋亡的作用[4-5]。为了明确TG在UC治疗中的价值,本研究首先通过三硝基苯磺酸/乙醇灌肠的方式来建立UC大鼠模型。肠黏膜炎症反应的持续激活以及黏膜上皮细胞的过度凋亡是UC重要的病理特征[8-10],对模型大鼠肠黏膜细胞凋亡及炎症的分析显示:UC组大鼠肠黏膜细胞凋亡率、促凋亡基因Caspase-9、Caspase-3的表达、炎症细胞因子TNF-α、IL-1β、IL-6的含量均明显升高,提示三硝基苯磺酸/乙醇灌肠能够复制UC病理进程中炎症反应激活、细胞过度凋亡的特征。
表4 AG490对凋亡基因表达的调节作用(¯±s)
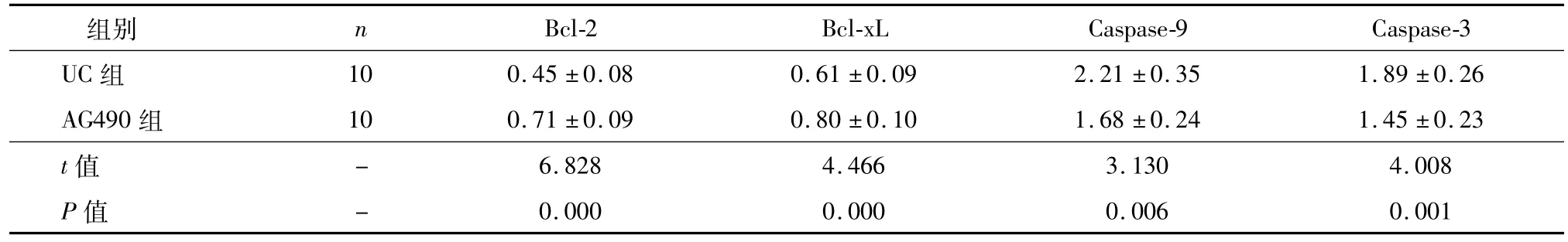
表4 AG490对凋亡基因表达的调节作用(¯±s)
注:与对照组比较,*P<0.05;与UC组比较,#P<0.05
Bcl-2 Bcl-xL Caspase-9 Caspase-3 UC组 组别 n 10 0.45±0.08 0.61±0.09 2.21±0.35 1.89±0.26 AG490组 10 0.71±0.09 0.80±0.10 1.68±0.24 1.45±0.23 t值6.828 4.466 3.130 4.008 P值-0.000 0.000 0.006 0.001-
表5 AG490对炎症细胞因子含量的调节作用(¯±s,ng/mL)
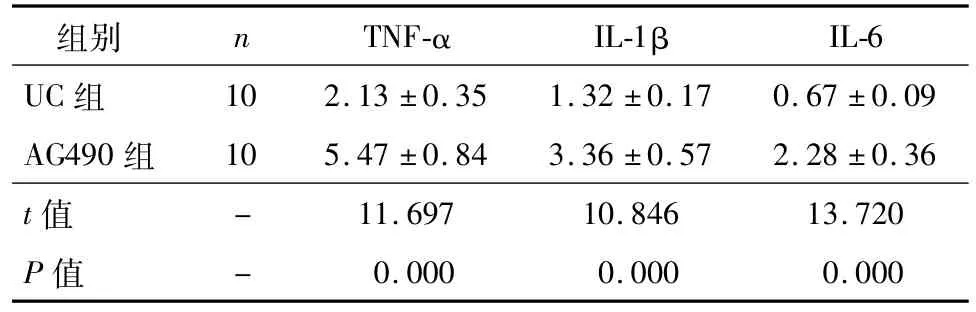
表5 AG490对炎症细胞因子含量的调节作用(¯±s,ng/mL)
组别 n TNF-α IL-1βIL-6 UC组10 2.13±0.35 1.32±0.17 0.67±0.09 AG490组 10 5.47±0.84 3.36±0.57 2.28±0.36 t值- 11.697 10.846 13.720 P值- 0.000 0.000 0.000
TG具有抗炎和抗凋亡的作用,本研究将TG用于UC模型大鼠的干预和治疗,旨在发挥该药物的抗炎和抗凋亡作用。在TG干预后14天对细胞凋亡率的观察结果如下:TG组大鼠肠黏膜细胞凋亡率明显低于UC组,提示TG能够显著抑制UC模型大鼠肠黏膜细胞凋亡。线粒体途径是调节细胞凋亡的重要机制之一,Bcl-2和Bcl-xL两种基因的编码产物定位于线粒体膜,通过抑制线粒体内细胞色素C向细胞浆的释放来抑制Caspase-9及Caspase-3级联激活所介导的细胞凋亡[11-13],本研究对线粒体途径凋亡基因表达的分析显示:TG组大鼠肠黏膜Bcl-2、Bcl-xL的表达水平明显高于UC组,Caspase-9、Caspase-3的表达水平明显低于UC组,提示TG能够调节UC模型大鼠肠黏膜细胞线粒体途径凋亡基因的表达、进而抑制线粒体途径所介导的细胞凋亡。
UC病程中肠黏膜的损害及凋亡与炎症细胞的大量浸润、炎症细胞因子的大量释放有关。TNF-α、IL-1β、IL-6是目前已知与UC发病密切相关的炎症细胞因子,TNF-α、IL-1β具有强大的促炎活性,既能促进多种炎症细胞向肠黏膜趋化浸润,又能参与肠黏膜上皮的损害过程[14-16];IL-6具有多种生物学活性,一方面在肠黏膜炎症的激活中起到级联放大作用,另一方面也参与了肠黏膜免疫应答紊乱的过程[17-18]。本研究在使用TG干预后分析了肠黏膜炎症细胞因子含量的变化,结果显示:TG组大鼠肠黏膜TNF-α、IL-1β、IL-6含量均明显低于UC组,提示TG能够抑制UC模型大鼠肠黏膜多种炎症细胞因子的释放,进而能够抑制肠黏膜炎症反应。
JAK2/STAT3是细胞内介导凋亡及炎症信号转导的重要通路,JAK2识别细胞外信号发生磷酸化激活后能够使下游STAT3发生磷酸化,p-STAT3具有转录激活活性,能够调节下游多种基因的表达并参与凋亡、炎症的调控[19-20]。本研究对肠黏膜JAK2/STAT3通路的分析显示:UC组肠黏膜p-JAK2、p-STAT3的表达明显增多,TG干预后TG组肠黏膜p-JAK2、p-STAT3的表达明显减少,提示JAK2/STAT3通路的激活参与了UC的发生、TG干预能够显著抑制UC大鼠模型肠黏膜JAK2/STAT3通路的激活。为了进一步明确JAK2/STAT3通路对肠黏膜细胞凋亡及炎症的直接调控作用,本研究使用JAK2/STAT3通路抑制剂G490对UC模型大鼠进行干预后发现:AG490组肠黏膜细胞凋亡率、Caspase-9及Caspase-3的表达水平、TNF-α、IL-1β、IL-6的含量均明显低于UC组,Bcl-2、Bcl-xL的表达水平明显高于UC组。这一结果表明JAK2/STAT3通路直接参与了UC肠黏膜细胞凋亡及炎症的调控,进而也提示TG通过该通路调节UC肠黏膜细胞的凋亡及炎症过程。
综上所述,TG对UC大鼠肠黏膜的凋亡及炎症具有显著的抑制作用,抑制JAK2/STAT3信号通路是TG发挥抗炎及抗凋亡作用的分子机制。

