评估国产利奈唑胺对葡萄球菌和肠球菌体外抗菌活性
于淑颖,肖 盟, 杨文航, 程敬伟,周梦兰,陈新飞,张 戈, 刘亚丽, 杨启文,孙宏莉, 黄 勋, 伍众文, 黄文祥, 杨 青, 俞云松, 徐英春
本研究就临床常见革兰阳性菌对中国江苏豪森公司研制生产的仿制药利奈唑胺(商品名恒捷,以下称国产利奈唑胺)的体外药物敏感性,与美国辉瑞公司生产的利奈唑胺(商品名斯沃,以下称进口利奈唑胺)进行对比,评估国产利奈唑胺的体外抗菌活性及其与进口利奈唑胺的一致 性。
1 材料与方法
1.1 材料
1.1.1 菌株来源 本研究选取2014-2017年皮肤软组织、呼吸道、血液、腹腔等感染部位分离的耐甲氧西林金黄色葡萄球菌(MRSA)、甲氧西林敏感金黄色葡萄球菌(MSSA)、耐甲氧西林凝固酶阴性葡萄球菌(MRCNS)、甲氧西林敏感凝固酶阴性葡萄球菌(MSCNS)和VRE各50株,共计250株。上述菌株收集自中国多所医学中心:北京协和医院117株、中南大学湘雅医院45株、中山大学附属第一医院25株、重庆医科大学附属第一医院27株、浙江大学附属第一医院19株和浙江大学附属邵逸夫医院17株。
1.1.2 质控菌株 金黄色葡萄球菌ATCC 29213和粪肠球菌ATCC 29212标准菌株为质控菌株。
1.1.3 试剂与仪器 本研究所用药物为国产利奈唑胺(注射液,100 mL:0.2 g),进口利奈唑胺(注射液,300 mL:0.6 g),达托霉素(阿斯利康制药有限公司,0.5 g/瓶),替加环素(惠氏制药有限公司,50 mg/瓶),左氧氟沙星[第一三共(北京)有限公司,注射液,100 mL∶0.5 g],万古霉素、替考拉宁和苯唑西林标准品从中国食品药品检定研究院购买。用于制作微量肉汤稀释法的阳离子调节(Cation-adjusted Mueller-Hinton Broth,CAMHB)干粉为美国BD公司商品,哥伦比亚血平板购自北京欣隆福医药销售有限公司。MALDI-TOF MS(简称VITEK MS)及配套的VITEK MS-CHCA基质和靶板购自法国生物梅里埃公 司。
1.2 方法
1.2.1 VITEK MS 入组菌株采用VITEK MS进行鉴定,菌落均匀涂布在靶板上,滴加1 μL基质,待干燥后放入机器采集峰图,与数据库中的峰图比对得出鉴定结果及鉴定率,具体操作遵照仪器使用说明书。可信度大于60%,认为鉴定至种水 平。
1.2.2 16S rDNA测序 对质谱鉴定未出结果或鉴定率低的菌株,补充16S rDNA的基因扩增和测序进行进一步鉴定,所有菌株均鉴定至种的水平。采用煮沸法提取DNA,将菌落挑入200 μL DNA提取液,震荡混匀,100 ℃水浴10 min后离心,将DNA产物送至北京睿博兴科生物技术有限公司进行测序,测序结果在GenBank网站上进行比对。
1.2.3 药敏试验 参照美国临床与实验室标准化协会(CLSI)M100-S26推荐的微量肉汤稀释法,平行测定国产利奈唑胺 、 进口利奈唑胺 、万古霉素、替考拉宁、达托霉素、苯唑西林、替加环素和左氧氟沙星8种药物的MIC值。在调节过阳离子的CAMHB肉汤中加入氯化钙使钙离子终浓度为500 mg/L,以满足达托霉素发挥药效的环境。
1.2.4 敏感率和耐药率计算 根据MIC值计算MIC范围、MIC50、MIC90和几何均数(GM),结果判读以CLSI M100-S26推荐折点为判断标准[4],比较国产和进口利奈唑胺药敏检测结果间的一致性及8种抗菌药物的抗菌活性。两种利奈唑胺的一致性通过分类一致率(categorical agreement, CA)(极大错误、大错误和小错误的发生率)以及基本一致率(essential agreement, EA)进行评价。CA指待测药物与参考药物判读结果的一致率,如二者均判读为敏感、中介或耐药[5]。EA指待测药物检测MIC值与参考药物完全一致或相差不超过±1个稀释倍数[6]。
1.2.5 结果分析 药敏数据分析采用WHONET 5.6版软件进行。
2 结果
2.1 菌株来源
从6所医院收集的MRSA、MSSA、MRCNS、MSCNS、VRE各50株,共计250株,其中分离自伤口组织和各类脓液标本占28.4%,血液标本占22.0%,呼吸道标本占19.6%,尿液标本占12.8%,腹水和引流液标本占6.0%,胸腔积液占2.8%,脑脊液标本占2.0%,其他标本占6.4%。72.4%的菌株分离自非重症监护病房(ICU)住院患者,14.8%的菌株分离自ICU患者,12.8%分离自门急诊患者。
2.2 国产利奈唑胺的体外抗菌活性
表1显示250株受试革兰阳性菌对包括两种利奈唑胺在内的8种抗革兰阳性菌的抗菌药物的敏感率。其中国产利奈唑胺对葡萄球菌和VRE均具有高度的抗菌活性,该药对金黄色葡萄球菌的MIC50和MIC90分别为2 mg/L和4 mg/L,对凝固酶阴性葡萄球菌的MIC50和MIC90分别为1 mg/L和2 mg/L,对VRE的MIC范围、MIC50和MIC90分别为0.5~2 mg/ L、2 mg/L和2 mg/L。总体来看,本研究纳入的全部葡萄球菌和肠球菌均对国产利奈唑胺呈现敏感。
2.3 国产利奈唑胺和进口利奈唑胺体外抗菌活性的比较
国产利奈唑胺和进口利奈唑胺对葡萄球菌和肠球菌的抗菌活性比较,结果发现国产利奈唑胺对50株MSSA的MIC50为2 mg/L,较进口利奈唑胺对MSSA(MIC50=4 mg/L)低一个稀释度。此外国产利奈唑胺对其他受试葡萄球菌属细菌和VRE菌株的MIC范围、MIC50和MIC90与进口利奈唑胺完全相同。各受试细菌对国产和进口利奈唑胺的敏感率均高达100%(表1)。
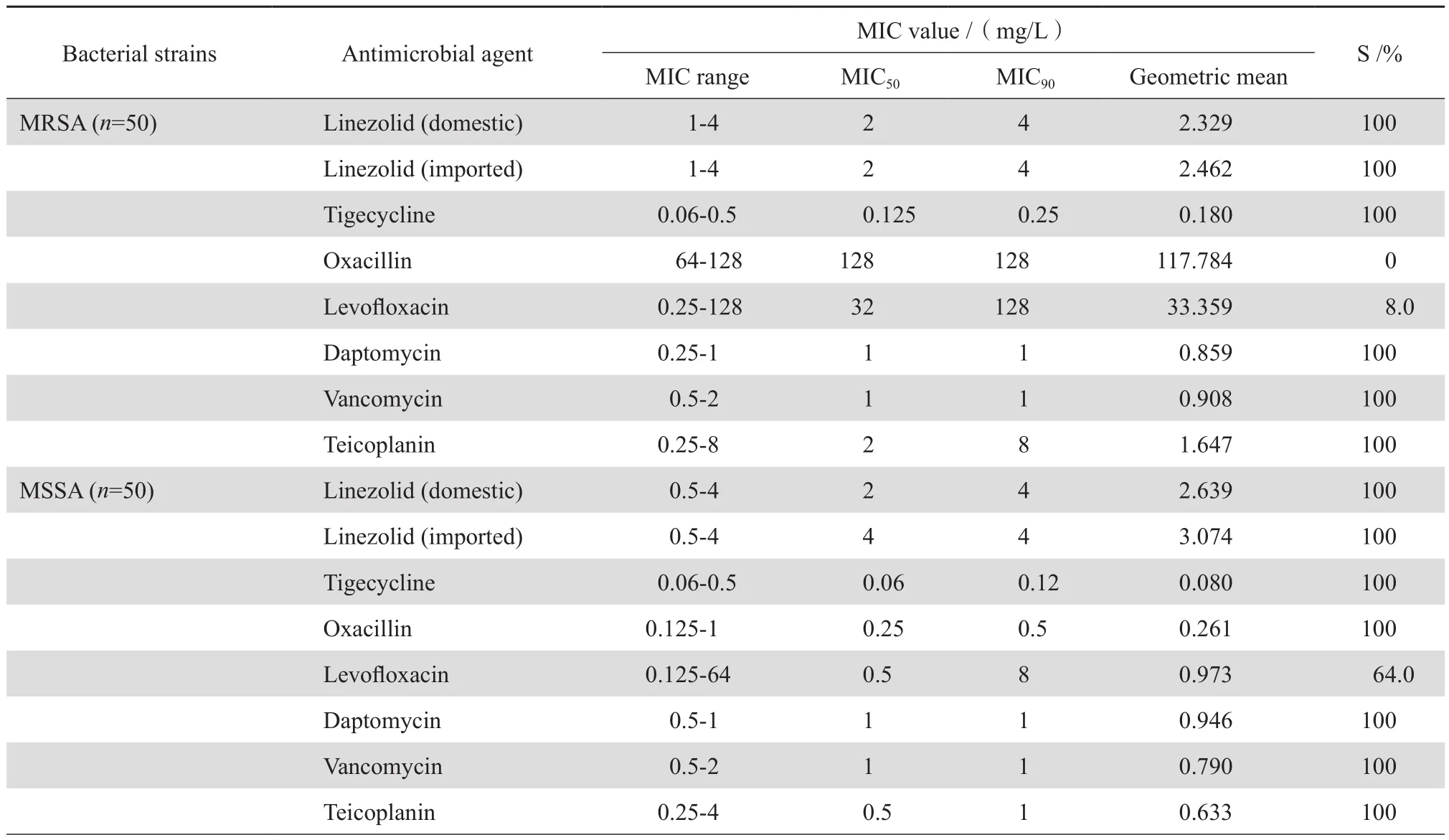
表1 两种利奈唑胺对250株革兰阳性菌的体外抗菌活性Table 1 In vitro antimicrobial activity of two linezolid products against 250 strains of gram-positive cocci
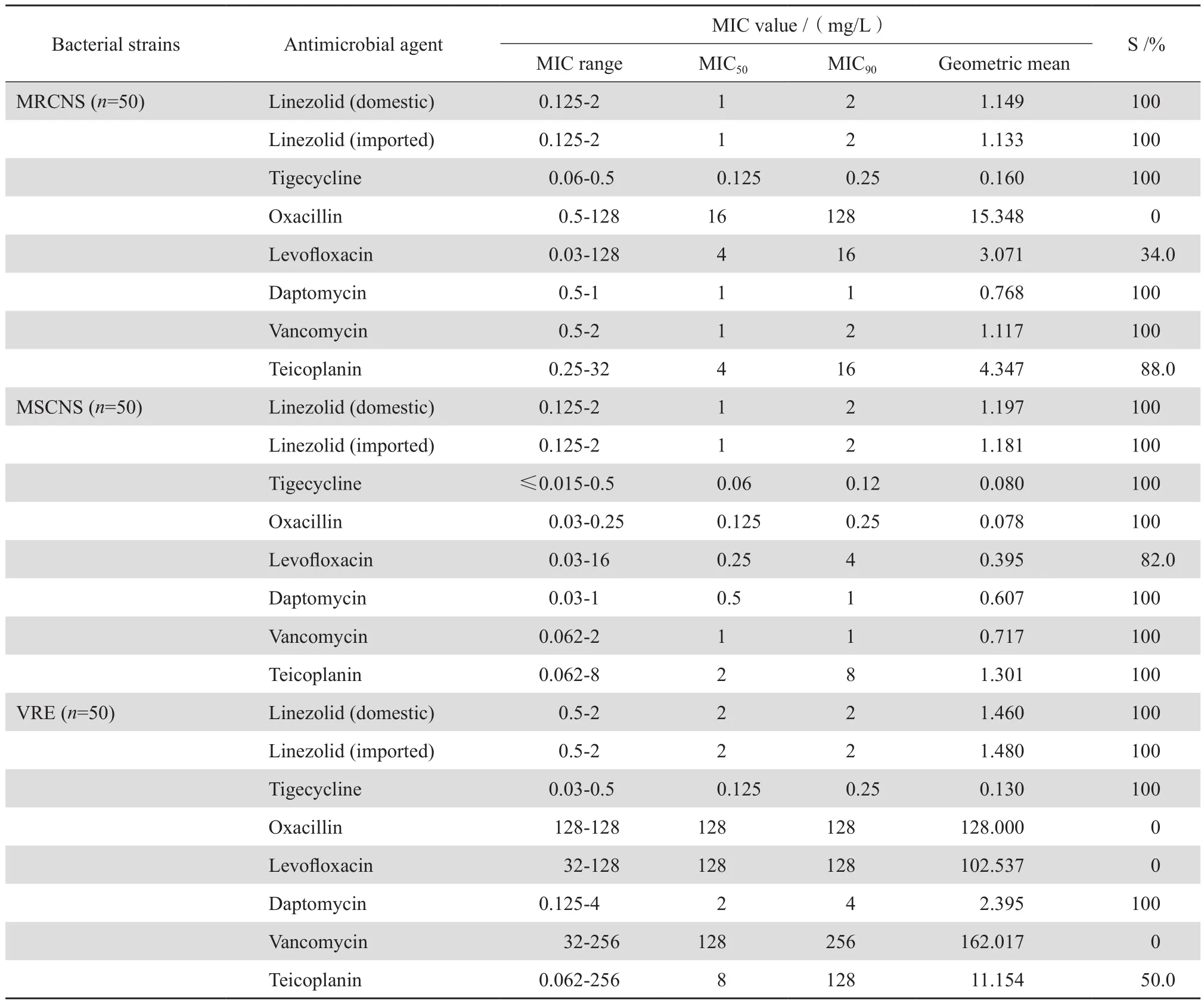
表1 (续)Table 1(continued)
2.4 两种利奈唑胺药敏测定结果的一致性分析
国产利奈唑胺和进口利奈唑胺对MRSA、MSSA、MRCNS、MSCNS和VRE的抗菌药物敏感性结果的CA和EA均高达100%。国产利奈唑胺对全部受试菌株的MIC值与进口利奈唑胺相比不超过±1个稀释梯度。两种利奈唑胺对凝固酶阴性葡萄球菌和肠球菌的MIC值基本相同。虽然金黄色葡萄球菌中,国产利奈唑胺对8.0%(4/50)的MRSA和22.0%(11/50)的MSSA的MIC值比进口利奈唑胺MIC值低1个稀释度,但是并不影响CA。总体上说,两种利奈唑胺对MRSA、MSSA、MRCNS、MSCNS和VRE的体外药敏测定结果高度一致(表2)。
2.5 其他抗菌药物的体外抗菌活性
研究结果显示,替加环素、达托霉素、万古霉素和替考拉宁对葡萄球菌具有很好的抗菌活性,除了MRCNS对替考拉宁的敏感率为88.0%,葡萄球菌对这4种抗菌药物的敏感率均高达100%。相比之下,葡萄球菌对左氧氟沙星的敏感率明显低于上述4种抗菌药物,MRSA和MRCNS对左氧氟沙星的敏感率(8.0%和34.0%)低于MSSA和MSCNS的敏感率(64.0%和82.0%)。对于VRE菌株,替加环素和达托霉素仍呈现很好的抗菌活性,VRE菌株对两药的敏感率均高达100%;而对替考拉宁的敏感率为50%,对左氧氟沙星全部耐 药。
3 讨论
利奈唑胺对多重耐药革兰阳性球菌有良好抗菌活性。朱徳妹等[2]通过测定利奈唑胺对579株临床分离菌的体外抗菌活性,并与有关抗菌药物进行比较,认为利奈唑胺对需氧革兰阳性球菌,包括多重耐药菌具有高度抗菌活性,且与其他抗菌药物间无交叉耐药。提示利奈唑胺对革兰阳性球菌,尤其是多重耐药株所致感染的控制将具有重要作用。利奈唑胺在我国已于2007年9月用于临床,目前临床所应用的利奈唑胺多以进口为主,随着我国医药自主研发的不断投入,许多进口药物相继在我国可以自主合成。
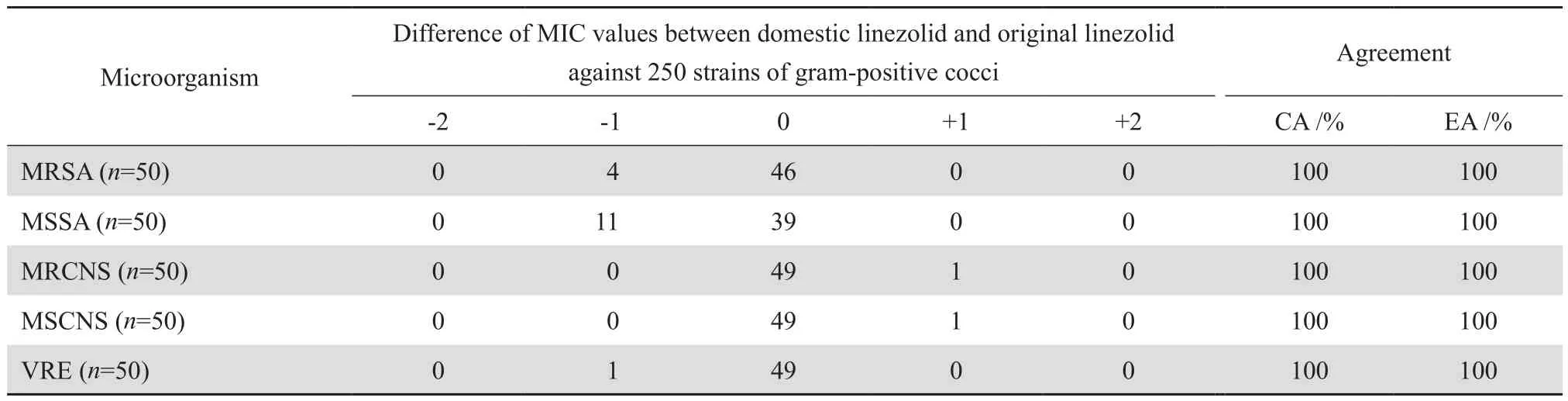
表2 两种利奈唑胺对250株革兰阳性菌的MIC值比较以及一致率评价Table 2 Consistency of MIC values against 250 strains of gram-positive cocci compared between domestic linezolid and original linezolid
本研究结果显示,国产利奈唑胺对革兰阳性菌具有极好的体外抗菌活性,250株革兰阳性菌株对国产利奈唑胺均呈现敏感状态。同时,本研究显示国产利奈唑胺与进口利奈唑胺对受试菌株的体外抗菌活性结果高度一致, 虽然有18株菌株(7.2%,18/250)的MIC值出现了不一致,但是仅相差±1个浓度梯度,且未发生极大错误、大错误和小错误。
本研究存在6株(12.0%,6/50)MRCNS菌株对替考拉宁耐药,包括5株溶血葡萄球菌和1株表皮葡萄球菌。类似的结果也出现在日本Nakamura等[7]对1992-2001年血培养分离出的凝固酶阴性葡萄球菌对多种抗真菌药物敏感性的调查,发现10.3%(61株)的凝固酶阴性葡萄球菌对替考拉宁不敏感,包括56株表皮葡萄球菌、1株头状葡萄球菌和1株溶血葡萄球菌。这也提示我们应该对凝固酶阴性葡萄球菌逐渐产生替考拉宁的耐药现象给予必要的关注。此外,本研究中对替考拉宁耐药的VRE菌株均携带vanA基因,VanA 型VRE的 VanS蛋白的组氨酸激酶活性可被万古霉素及替考拉宁激活,VanA 型VRE对万古霉素和替考拉宁均耐药[8]。本研究尚未发现对替加环素和达托霉素不敏感的菌株,替加环素和达托霉素对于多重耐药革兰阳性菌具有很好的抗菌活性。多重耐药革兰阳性菌对左氧氟沙星的敏感性很差,临床上使用该药物治疗多重耐药革兰阳性菌感染时应当予以注意。
总之,国产利奈唑胺对多重耐药葡萄球菌及肠球菌具有极强的体外抗菌活性,且与进口利奈唑胺的体外抗菌活性高度一致。

