小鼠体内长出了人类肝脏
探戈
很多人可能见过这样一张照片:一只没有体毛的裸鼠,站在一个透明的圆形培养皿中,它背上竟然长着一个“人类”的耳朵,令人惊叹不已。这是科学史上最引人注目的小鼠之一,其实也是20多年前一项组织工程学的研究成果,科学家希望利用这些裸鼠生产出可供人类利用的耳廓等组织。
时至今日,这项“人耳鼠”成果在很多科学家眼里只能算是“小儿科”了,科学家已将小鼠的一些基因、组织甚至某些器官改造得越来越接近人类,希望它们能为人类健康作出贡献。人源化肝脏嵌合小鼠正是其中的实验之一。
培育初衷
肝脏是个神奇的器官,它既是人体最大的内脏器官,能分泌胆汁、储藏糖原,调节新陈代谢,也是人体最大的解毒器官。人体代谢过程所产生的有毒产物、日常摄入的毒素或重金属、药物的代谢产物等都需要肝脏来解毒。但是,这些毒素——特别是有毒的药物、代谢产物——剂量超过肝脏的解毒能力时,会对肝脏造成致命损伤。此外,人类肝脏也容易受到一些特殊病毒,如甲肝病毒、乙肝病毒和丙肝病毒等的侵害,而且这些病毒往往特异性感染人类等灵长类动物,因此人类肝脏成为新药开发、肝脏疾病机理研究等领域的重要关注对象。显而易见,人类肝脏并不便于直接研究,用猴子、黑猩猩等灵长类动物又存在成本高、伦理争议大等问题,怎么办?借助实验动物或是一个理想的替代方案。
鉴于结构相对简单、饲养方便、成本低廉、基础研究透彻等诸多优点,小鼠已成为最常见的实验动物。科学家通过化学诱导、物理刺激、转基因和基因编辑等技术培育出的小鼠模型不计其数,这些小鼠模型也在生物学基础研究、组织工程、药物开发、人类疾病机理研究等领域发挥着突出作用,成为生命科学研究领域最受欢迎的研究工具和材料。值得一提的是,以小鼠为对象的相关研究已至少获得20项诺贝尔奖,小鼠也成为生命科学研究领域名副其实的大功臣。
不过,小鼠与人类在器官结构、代谢特点、遗传背景等方面都存在较大差异,也就是说,小鼠并不能完全模拟人类,甚至会为人类新药和疾病机理研究带来一些误导。据统计,经小鼠等实验动物验证有效和安全的候选新药,只有不到8%的药物能最终完成临床试验并获得新药证书,这显示了小鼠等实验动物预测准确性相对较低。但尽管不是完全靠谱,世界药物开发的标准程序还是离不开小鼠等实验动物。
随着转基因技术和基因编辑技术的发展,有科学家提出了人源化小鼠的设想,也就是将小鼠某些特性改造得与人类相近,这或许可以解决小鼠在药物开发、疾病模型等方面预测准确性差的难题。为了让小鼠更接近于人类,科学家利用嵌合技术、转基因技术和基因编辑技术培育出的人源化嵌合小鼠,竟然可以长出人类肝脏等组织器官,从而使这些小鼠在新药开发、人类疾病机理研究等领域发挥出越来越重要的作用。
推陈出新
2001年,加拿大阿尔伯塔大学的研究人员突发奇想,将人肝细胞移植到一种有遗传缺陷的转基因小鼠体内,这些人肝细胞居然在小鼠的肝脏上正常生长,硬生生把小鼠肝脏变成了人肝细胞的“地盘”。大家都知道,不同物种的细胞相互之间存在免疫排斥反应,一般情况下,小鼠免疫系统一旦识别出人类细胞等外来细胞,会马上将其清除,为什么这种转基因小鼠却能允许人肝细胞肆意生长呢?
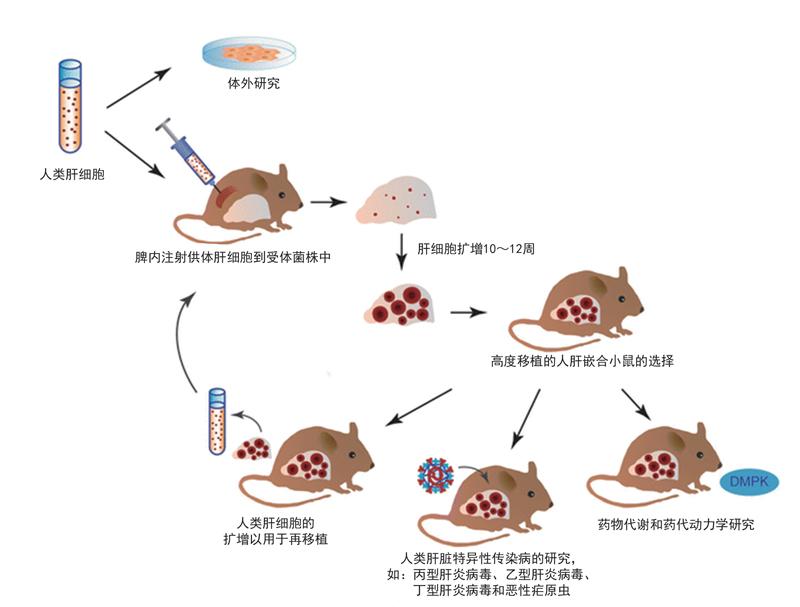
原來,这种在1990年由美国辛辛那提大学的科学家培育出来的转基因小鼠被转入了一种叫尿激酶的基因,让小鼠过量表达尿激酶而发生凝血障碍。这原本主要用于模拟一种人类新生儿凝血障碍,但过量的尿激酶却对小鼠自身的肝脏造成了损伤,使其肝细胞大量减少,导致小鼠肝脏萎缩。加拿大研究人员将这种转基因小鼠与另一种存在严重免疫缺陷的小鼠杂交,使其后代含有严重免疫缺陷和肝脏损伤这两种缺陷,再将人肝细胞移植到这些小鼠体内。由于这些小鼠本身具有免疫缺陷,其免疫系统已形同虚设,自然不会对外来的人肝细胞发起攻击,因此人肝细胞在小鼠体内得以生长发育,并填补原来小鼠自身肝脏萎缩后留下的空缺。这样,第一代嵌合人肝细胞的人源化小鼠就培育成功了。
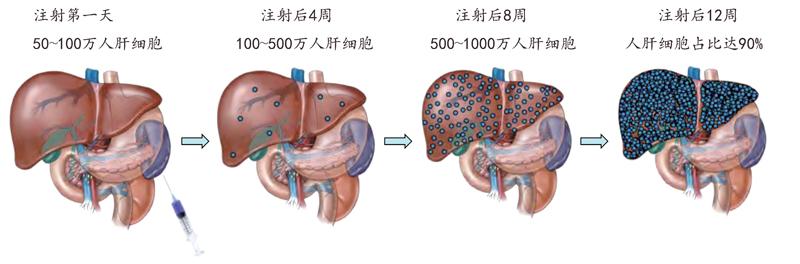
人肝细胞在嵌合小鼠肝脏中的生长过程
研究人员进一步分析发现,这种人源化小鼠的人肝细胞占整个嵌合肝脏的一半以上,而且能感染灵长类动物特异的丙肝病毒,成为第一种理想的丙肝病毒小鼠模型。不过第一代人源化小鼠模型的人肝细胞含量还是偏低,后来经过不断改进,人肝细胞含量最多也只占到整个嵌合肝脏细胞总量的70%左右。此外,第一代人源化小鼠模型还存在繁殖效率低、存活时间短等问题,限制了这种小鼠模型的应用效果和范围,于是第二代人源化嵌合小鼠便应运而生了。
2007年,美国俄勒冈健康与科学大学的研究人员开发了一种新的人源化肝脏小鼠,其基本思路与第一代相似。不过,美国科学家采取的方法并非转基因技术,而是将基因敲除。他们将1个影响小鼠肝细胞存活能力的基因和两个控制免疫细胞发育的基因都破坏掉,同样得到了含有肝脏损伤和严重免疫缺陷这两种缺陷的小鼠,然后将人肝细胞移植到这种基因敲除小鼠体内,这种人源化嵌合小鼠体内的人肝细胞含量可达到嵌合肝脏的90%以上。不仅如此,这种新的人源化嵌合小鼠还具有两项新的优势:一是可以用多种来源的人肝细胞,比如从尸体上摘取的肝细胞、冷冻肝细胞、从新鲜肝脏切除的肝细胞等;二是能进行人肝细胞连续的再植入,以将人肝细胞含量长期维持在较高水平。这一优势是其他小鼠模型所不具备的。不过,这种第二代人源化肝脏小鼠模型需要肝脏保护药物的协助。
日本中央实验动物研究所培育出了第三代人源化肝脏小鼠。研究人员先用化学药物损伤小鼠自身肝脏,再植入人肝细胞,结果人肝细胞含量也可达到嵌合肝脏的90%以上,并可以在不需要肝脏保护药物帮助的情况下,稳定维持8个月以上的存活时间。
应用广泛
科学家开发的这些人源化肝脏嵌合小鼠模型,具有与人体肝脏类似的代谢特点和功能,人源酶类和转运蛋白分泌水平也与人体肝脏相当,可主要用于评估新药安全性、药效和代谢过程等,也可模拟乙肝病毒、丙肝病毒等感染肝脏的过程,以便于有针对性地开发安全有效的药物和治疗方法。

大鼠与小鼠的嵌合体
日本研究机构在人源化肝臟小鼠模型研究领域开展的大量工作,也是2019年8月日本政府批准开展人鼠嵌合体研究的重要基础。日本凤凰生物株式会社在大力推广人源化肝脏小鼠模型的商业化应用中发挥着重要作用,不仅专门成立了人源化肝脏小鼠生产和研发机构,而且还为该公司所开发的人源化肝脏小鼠注册了商标,使其成为世界上使用最广泛的人源化肝脏嵌合小鼠模型。2019年,日本麒麟株式会社转化医学研究部的研究人员曾用改进的第一代人源化嵌合小鼠对该公司研制的一种单克隆抗体进行安全评估,结果显示,该小鼠模型能很准确地评价该抗体引发的肝毒性,包括丙氨酸转移酶升高、人源性肝细胞凋亡增加等。
研究显示,科学家通过评估一种治疗乙肝的失败药物,证明第三代人源化嵌合小鼠模型具有较高的肝毒性灵敏度。在1993年一次临床Ⅱ期试验中,15名志愿者注射了这种药物,结果有7名志愿者因肝脏衰竭不幸死亡,导致该药物的临床试验被紧急叫停。而在之前的小鼠、大鼠、狗和猴子等多项临床前动物实验中,研究人员均未发现该药具有严重的肝毒性。当使用第三代人源化肝脏小鼠对其进行重新评估时,他们发现,这一药物的确会对人类肝脏造成直接毒性。如果这种人源化肝脏小鼠能够早日培育出来并得到应用,或许可以避免临床试验志愿者死亡的悲剧。
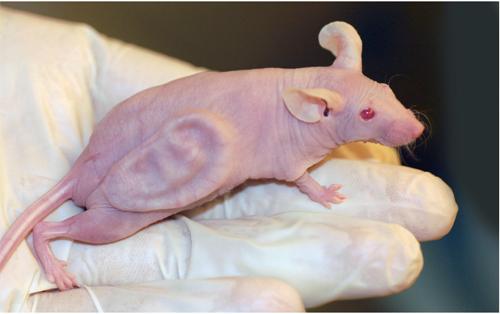
裸鼠身上长出人耳廓
利用第三代嵌合小鼠模型,研究人员还筛选到一种治疗丙肝的新药,证明该药物具有较强的抗丙肝活性,而且与另一种药物联合使用疗效更加显著。第三代人源化嵌合小鼠模型为丙型肝炎治疗性方法的发展作出了重要贡献。
人源化肝脏嵌合小鼠已成为新药安全性评价和药效学研究的理想工具,科学家利用人源化小鼠规模化生产人用细胞、组织或器官的前景也值得期待。

