九种益生菌之间的相互作用及协同共生机理
刘学云,于新,何嘉敏,郭靖,王萍,王仲芬
(仲恺农业工程学院 轻工食品学院,广东 广州,510000)
益生菌是指一类可通过改善肠道菌群平衡而对人的健康产生有利影响的活性微生物添加剂,已被广泛应用于食品生产中[1-2]。诺贝尔奖的获得者ELIE METCHNIKOFF认为,保加利亚人之所以长寿,是因为他们长期饮用发酵乳制品,其中的乳酸杆菌能改善人的肠道菌群平衡,从而降低产毒菌的活性[3]。经研究发现[4],益生菌的活性在改善人体肠道内的菌群平衡中发挥决定性作用,要获得较好的治疗效果,益生菌必需达到一定的数量。但是,由于益生菌的活菌期时间短[5],在加工和贮藏过程中保证生物活性是其产品面临的巨大挑战[6]。
目前,为了解决上述问题,提高生产效率与产品质量,开发出一种新的绿色无污染生产发酵模式——混合发酵[7-8]。利用菌种之间的优势互补,一株菌的代谢物可能刺激另一株菌生长代谢,从而产生单菌发酵无法获得的产物及高活菌数。但是,菌种之间是否会产生拮抗作用、引起拮抗作用的原因,以及哪些菌种之间有协同作用是需要关注的问题。鉴于此,本文研究的重点就是双歧杆菌属、乳酸杆菌属、链球菌属的9种常用的益生菌间的相互作用,对菌种之间的协同作用机理进行初步的探讨,为益生菌混合发酵、微生物制剂的开发提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 实验菌种
德氏乳杆菌保加利亚亚种(Lactobacillusdelbruechiisubsp.Bulgaricus,Ld)、植物乳杆菌(Lactobacillusplantarum,Lpl)、嗜热链球菌(Streptococcusthermophilus,St)、鼠李糖乳杆菌(Lactobacillusrhamnosus,Lr)、嗜酸乳杆菌(Lactobacillusacidophilus,La)、乳双歧杆菌(Bifidobacteriumlactis,Bl)、两歧双歧杆菌(Bifidobacteriumbifidum,Bb)、干酪乳杆菌(Lactobacilluscasei,Lc)、副干酪乳杆菌(Lactobacillusparacasei,Lpa),丹尼斯克(中国)有限公司。
1.1.2 试剂与设备
TU-1901型双光束紫外分光光度计,北京普析通用仪器有限公司;5810R型高速冷冻离心机,广州卓越贸易有限公司;2.5 L三菱厌氧产气袋,广州卓森科学器材有限公司;0.22 μm水系滤膜,Millipore公司。
1.1.3 试剂及培养基的配制
(1)MRS培养基
葡萄糖20 g,蛋白胨10 g,牛肉膏10 g,酵母提取粉5 g,柠檬酸二铵2 g,K2HPO42 g,乙酸钠5 g,MgSO40.58 g,MnSO40.25 g,吐温-80 1.0 mL,琼脂15 g蒸馏水1 000 mL,用1.0 mol/mL的NaOH调pH 6.2~6.4。
(2)菌液的制备
益生菌接种于MRS液体培养基中,37 ℃培养24 h,用0.9%无菌生理盐水梯度稀释后即为菌液。
(3)无细胞上清液的制备(cell-free supernatant,CFS)
益生菌接种于MRS液体培养基中,37 ℃培养24 h后,10 000 r/min,4 ℃离心10 min,收集上清液,经0.22 μm微孔滤膜过滤后即为无细胞上清液[9]。
1.2 实验方法
1.2.1 菌种活化
将冷冻保藏的菌种用接种环挑取一环接种于MRS固体培养基上划线,37 ℃培养24 h左右,直至出现明显的菌落,如此反复2次之后,挑取1环单菌落接种于MRS液体培养基中于 37 ℃培养24 h[10]。
1.2.2 活菌数的测定
采用平板菌落计数法[11]。
1.2.3 菌体浓度的测定
以未接种的MRS液体培养基为空白,取其菌液于600 nm的波长下,用紫外分光光度计测定菌液的OD600nm。
1.2.4 菌种间拮抗作用实验
采用牛津杯扩散法[12]。
1.2.5 拮抗作用验证实验
将益生菌之间抑菌圈直径10 mm实验组进行验证:指示菌液和拮抗菌无细胞上清液(CFS)按照1∶9的比例混合,以指示菌液+含1 g/L蛋白胨的0.9%无菌生理盐水作为阳性对照,以0.9%无菌生理盐水+拮抗菌CFS作为阴性对照。在37 ℃培养条件下分别于0、1.5、3、6、12、24 h取5 mL测定OD600nm。
1.2.6 菌种间协同作用实验
将活化好的菌种按1%接种量接于MRS液体培养基中进行单独培养;同时在相同的接种量情况下,按1∶1比例把无拮抗作用的菌种两两组合进行混合发酵,以不接菌的培养基为空白对照,37 ℃培养24 h,每2 h取样测定菌液OD600 nm值,并绘制出生长曲线图[13],以观察乳酸菌单独培养及混合发酵的生长变化,判断是否存在协同作用。
1.2.7 协同作用生物验证实验
将具有协同作用的一种菌的CFS与MRS液体培养基混合,按照1∶1的比例接入待检菌;再将一种菌进行高压灭菌热处理后,按1∶1的比例接入待测菌,37 ℃培养24 h,测其活菌数,比较单独培养与上述培养方式的活菌数。
2 结果与分析
2.1 菌种间拮抗实验
采用牛津杯扩散法对这9株益生菌进行体外拮抗实验,如表1所示。

表1 益生菌间的抑菌效果Table 1 Antimicrobial effects between probiotics
注:“×”代表未进行实验;“—”代表无拮抗作用;抑菌圈数据为重复3次平均值±标准差。
约1/3的益生菌之间有一定的拮抗作用,其中Ld对Lpl、La有抑制作用,但对Bl、Lr、Bb、Lc、Lpa和St无拮抗作用;Lpl对Ld、Lr、Lc有抑制作用,但对Bl、La、Bb、Lpa和St无拮抗作用;Bl对Lr、La有抑制作用,对Lpa有明显的抑制作用,但对Ld、Lpl、Bb、Lc和St无拮抗作用;Lr对La有抑制作用,对St的抑制作用显著,但对Ld、Lpl、Bl、Bb、Lc和Lpa无拮抗作用;La对Ld有抑制作用,对Lpl、Bl、Lpa有一定的抑制作用但不显著,对Lr、Bb、Lc和St无拮抗作用;Bb对Lpl、Lr、La有抑制作用,对St拮抗作用最为明显,抑菌圈高达19.3 mm,但对Ld、Bl、Lc和Lpa无拮抗作用;Lc对Lpl有抑制作用,对Ld的抑制作用显著,但对其余6株菌之间无拮抗作用;Lpa对Lpl的抑制作用明显,对La的有一定的抑制作用但不显著,但对Ld、Bl、Lr、Bb、Lc和St无拮抗作用;St对Lpa的抑制作用不显著,对其余7株菌的生长繁殖均无抑制作用。而引起益生菌之间产生拮抗作用的原因,除发酵培养最终代谢物的乳酸以外,还产生H2O2[14]、乙醇、细菌素[15]、罗伊氏素[16]、乙酸和双乙酰[17]等抑菌代谢物。
2.2 拮抗作用的验证实验
由表2可知,阴性对照组、阳性对照组和拮抗实验组在0~3 h均无明显增长,说明0~3 h为延滞期即开始缓慢生长,但从3 h后阳性对照组呈指数增长趋势,此时菌液中的代谢产物迅速积累,菌液也开始变浑浊,OD600nm值显著上升,而阴性对照组与拮抗实验组均无明显变化,这说明La的代谢产物对Lpl、Bl、Lpa有抑制作用,Lpa的代谢产物对La也有抑制作用;St的代谢产物产物对Bb有抑制作用。
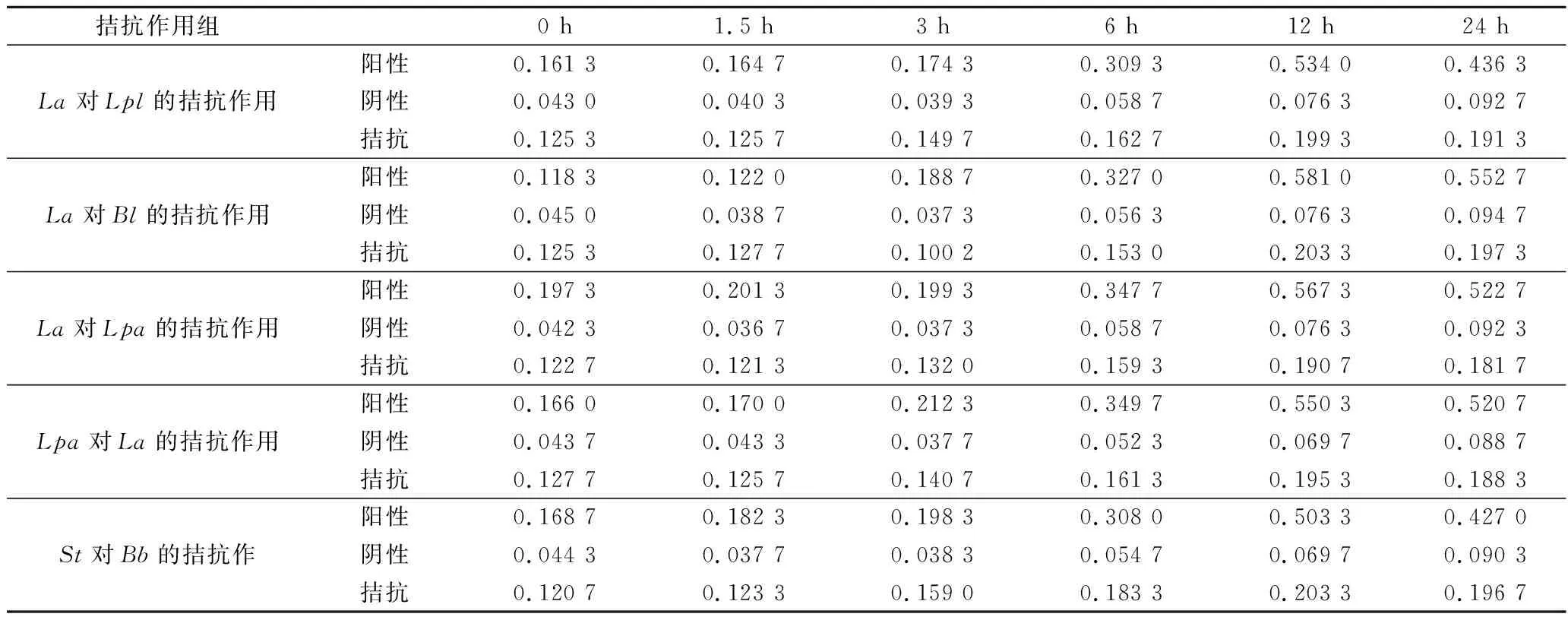
表2 拮抗菌对指示菌的拮抗作用Table 2 Antagonistic effect of antagonistic bacteria on the indicator bacterium
注:表中数据为含10%指示菌的拮抗菌无细胞上清液在不同时间下600 nm波长的吸光值。
2.3 菌种协同作用实验
由图1可知,在0~4 h为延滞迟缓期即开始缓慢生长;4 h后进入对数增长期,此时菌液中的乳酸、苹果酸、柠檬酸等[18]有机酸,迅速累积导致其pH值随之降低,溶液中的其他代谢产物也随之积累,此时菌液也开始出现浑浊;到10 h左右益生菌进入生长稳定期,此时菌株增长缓慢趋于平缓;再经过约18 h后进入生长衰退期,此时由于代谢产物增多,培养基营养物质减少,pH迅速下降,菌的生长受到抑制,并开始出现“自溶”[19]现象,大量菌体死亡。同时比较这9株益生菌在单独纯培养与两两组合共培养时菌液的OD600nm值变化发现,St分别与La、Ld、Lc共培养,Lc与La共培养在生长过程中所测得OD600nm值均明显高于单菌纯培养,从而推出Ld与St、St与La、St与Lc、Lc与La存在协同互生的关系,其余的菌种则是存在种间共存的关系。

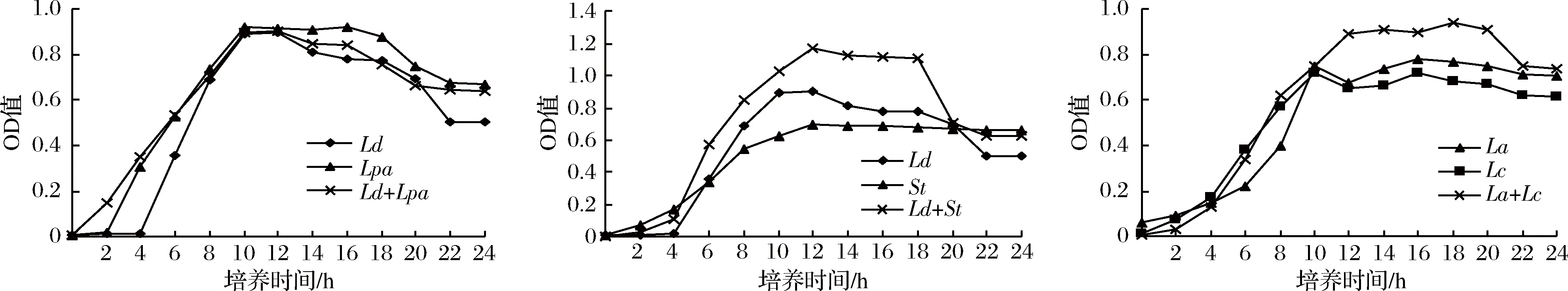
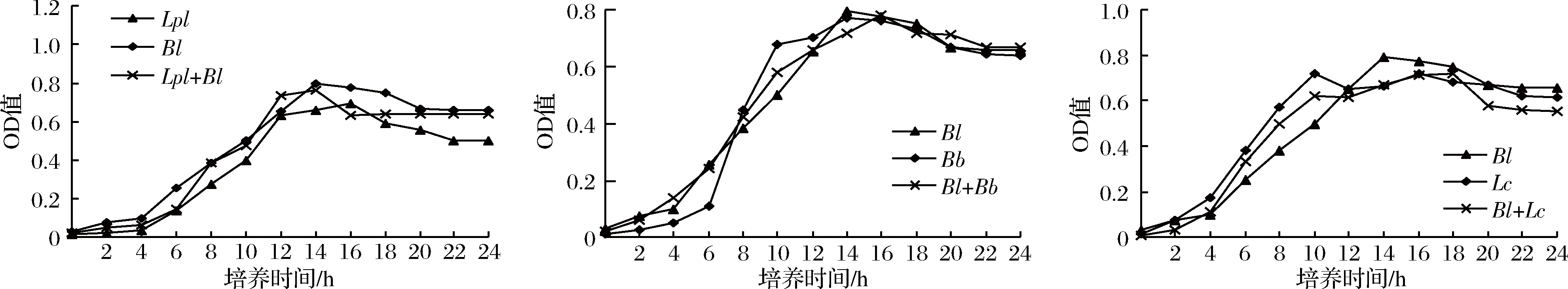


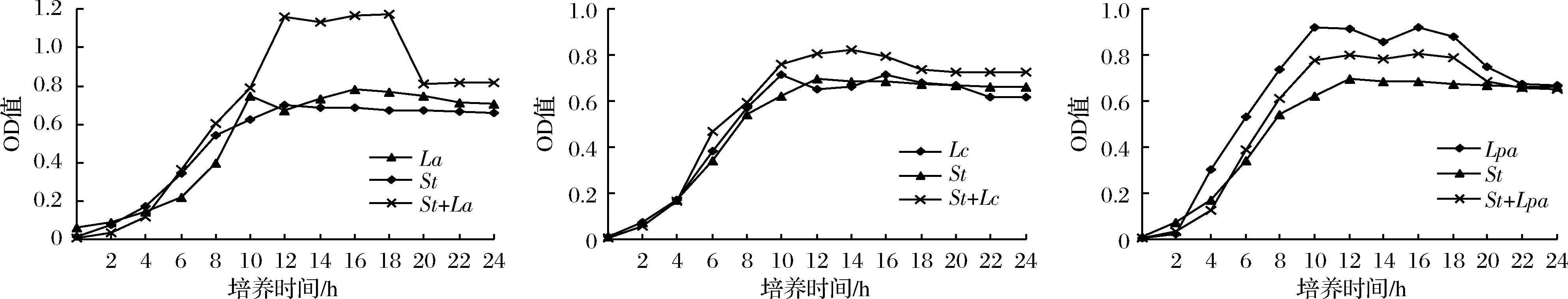
图1 益生菌单菌培养及两两组合共培养的生长曲线Fig.1 The growth curve of probiotic single bacteria culture and two-two combination co-culture
2.4 协同作用的验证实验
如图2所示,加入StCFS可使La、Ld、Lc的活菌数较单菌培养明显升高,同理,另一种菌CFS也可使具有协同作用的菌种活菌数较单菌培养显著增加。因此,上述实验结论与本实验一致,即St与Ld、St与La、La与Lc、St和Lc具有协同作用。还发现高压灭菌较过滤除菌的无细胞上清液活菌总数均小,这表明具有协同作用的代谢产物部分被热破坏,菌种之间的协同作用与代谢产物有关。如保加利亚乳杆菌因不含有叶酸[20]、丙酮酸而缺少了生长所需的嘌呤[21]和甲酸,但St在发酵过程中产生的甲酸和丙酮酸会刺激保加利亚乳杆菌生长;而保加利亚乳杆菌产生的多肽和氨基酸类也可以促进St的生长代谢。
3 讨论
通过对9种益生菌之间相互作用的研究,约1/3的益生菌之间都存在着拮抗作用,但Ld与St、St与La、St与Lc、Lc与La存在协同互生作用,且代谢产物与菌种间的协同作用有极大的关系。出现这种结果,可以从3个方面进行解释:(1)微生态环境:益生菌的生长受生存环境的酸度、温度影响,不同益生菌的产酸能力、耐酸能力及最适生长温度等构成的复杂生态关系,同时也是制约混合培养过程中各益生菌生长的重要因素;(2)营养物质:益生菌生长需要大量的营养物质,菌种之间存在营养物竞争的关系;(3) 生理生化代谢:益生菌生长繁殖过程中可产生不同的代谢物,当一种菌产生的代谢物可以被另一种菌利用刺激其生长,即为协同作用,反之,如产生细菌素、H2O2、罗伊氏素(reuteri)等抑菌物质,对另一种菌产生抑制甚至是毒害作用。

图2 益生菌之间的相互促进作用Fig.2 The mutual promoting effect between Lactic acid bacteria
SKRIVER等[22]提出将不同的益生菌进行组合可以发挥其不同的发酵性能;Lc和St混合发酵能明显增加乳品的黏性和活菌数[23- 24];舒国伟等发现Lc和St混合发酵对产酸速率、活菌数及酸羊乳的口感皆有较显著的影响[25];St刺激保加利亚乳杆菌生长的代谢产物是甲酸、丙酮酸和叶酸[26]。这些益生菌间的协同作用与本文研究结论一致,这可能是因为乳杆菌有较强的分解蛋白质的能力,能产生多种氨基酸,为St提供营养物质;同时由于杆菌产酸速率较慢,而St分解大分子的蛋白质较弱,但可以通过丙酮酸等快速代谢产生乳酸、甲酸、CO2等,这些有机酸是杆菌的生长刺激物,促进乳杆菌的生长。
本研究为益生菌发酵食品及微生物制剂的工业化应用和产业化生产提供了技术指导;为研究菌种间相互作用及益生菌菌剂组分提供理论基础。而随着益生菌被广泛的应用,相互作用研究得不断深入,发酵技术的不断革新,必将推动整个益生菌行业发展进程。但从当前的研究报道来看,微生物混合发酵研究更多地局限于工艺的优化,而对菌种与菌种之间的拮抗和协同作用机理研究较少,对于具有协同关系菌株的筛选缺乏有效的方法与理论指导。因此,多菌种培养过程中菌种间的作用机理、具体的代谢产物、如何降低拮抗作用也是今后研究工作的重点和难点。

