中医药对帕金森病的临床疗效及相关信号通路的研究进展
张琳婧,梁羽茜,胡秀华*,王媛媛
(1.北京中医药大学生命科学学院,北京 100029;2.北京中医药大学中医学院,北京 100029)
帕金森病(Parkinson's disease,PD)是一种常发生于神经系统的慢性退行性疾病[1],又可称为震颤麻痹。主要表现有静止性震颤、运动弛缓与肌肉僵直等症状,其发病率与年龄呈正相关[2]。全人群患病率为100~300/10万,65岁以上老年人患病率约为950/10万,同时关于1983—2009年报道的13项帕金森流行病学调查结果显示:我国全人群患病率为190/10万[3-5]。它不但影响人类的生存质量,也给社会带来了沉重负担[6]。原发性PD治疗尚无根治性的方法。西医临床常通过多层次、多途径来进行综合治疗[7]。但随着疾病的进展,药效逐渐减弱,常导致异动症,甚至可加重非运动症状,因而无法根治帕金森病。近年来,传统中医药临床研究发现,中药方剂在缓解PD症状,改善长期服用西药副作用方面存在明显优势。目前中医药积累了大量治疗PD的实践经验,现从中医对帕金森病因病机理解、中医药治疗及预后、中医药对帕金森的现代生物学研究等方面,总结中医药对帕金森病即颤证的影响。
1 中医对帕金森病病因病机的理解
中医学者依据帕金森病的症候,将其归属于“震颤”“颤振证”“痉病”等,近代已基本统一病名为“颤证”[8]。历代医家认为PD病机复杂,其特点属本虚标实。本虚为肝肾亏损,脏腑功能失调;标实为风、火、痰、瘀互结,蕴塞脑窍。肝主疏泄,主筋,属木。《素问·至真要大论》中曰“诸风掉眩,皆属于肝”。肝阴不足日久,则阴虚阳亢化风,出现头摇、肢颤之症;同时“阴虚而内风生”,导致阴液不能濡养筋脉出现肢体抽搐;另一方面气机升降失调,肝气郁结化火,肝阳扰动化热生风也可导致四肢颤震不已。由此可见“风气内动”是本病的病机核心,由风致颤。肾主骨、生髓,上荣于脑,属水。肾精亏虚伤神,脑神失养,出现反应迟钝,动作徐缓等症状。由于肾阴与肝阴互相资生,一方面肾精亏虚,水不涵木,则肝失疏泄生火或由火化痰,产生气滞、痰瘀等实邪,最终导致脉络瘀阻,筋脉失养,可见肢体僵直、震颤;另一方面肝气郁结,日久及肾,导致肾精不足,又会因实致虚。总之在肝肾亏虚的基础上,痰瘀内生阻络、阻滞脑脉是促使病情发展变化的重要病理环节[9]。
根据中医对颤证病因病机的认识,临床上将颤证主要分为痰热动风、阴阳两虚、肝肾不足、气血两虚、血瘀生风等证型。在治则治法上多以祛风化痰、滋养肝肾为主[10-11]。由于颤证病因病机复杂,各证型之间可相互嵌合,相互转化,故在治则上多根据其辨证以合方或经方加减使用为多,且临床报道均取得较好疗效。
2 中医药对帕金森病预后的影响
中医药治疗强调“整体观念,辨证论治”,因而有其独特的优势[12]。呙登俊等[13]运用人参归脾汤(人参叶15 g,黄芪10 g,白术15 g,当归10 g,茯神15 g,甘草10 g,远志15 g,龙眼肉10 g,合欢皮15 g,木香10 g,酸枣仁30 g,每日1剂,加水500 mL,煎取200 mL,每日分2次口服)连用4周治疗气血亏虚型老年颤证(即帕金森病)患者50例,结果,有效率为60%,对照组低于治疗组(P<0.01)。且此方可改善气血亏虚型老年颤证患者情绪和认知、心血管症状、胃肠道症状、睡眠障碍方面的非运动症状(P<0.05)。因而,加用人参归脾汤可加强患者治疗效果。吴成翰等[14]自拟镇颤汤(熟地黄24 g,淮山药12 g,枸杞15 g,山茱萸15 g,牛膝15 g,菟丝子15 g,龟板15 g,丹参15 g,红花10 g,制首乌15 g,黄芪15 g,石膏21 g,玄参15 g,芦根21 g,甘草3 g),统一制成口服液,每天1剂,8周一疗程治疗肝肾不足型颤证患者64例,结果显示帕金森综合征(VPS)治疗组疾病疗效总有效率为81.3%,证候疗效总有效率为84.4%,对照组疾病总有效率为43.3%,证候疗效总有效率为46.7%,经对比,两组差异有统计学意义(P<0.05或P<0.01)。同时,治疗组病人失眠、口干、便秘、恶心等副作用减少。因而,自拟镇颤汤对帕金森综合征有一定的疗效,明显减少多巴类制剂的副作用,减缓美多巴制剂的追加量,并对延缓病程有一定的作用。王雅娟[15]自拟温阳逐瘀定帕汤(党参、黄芪各30 g,巴戟天、天麻、鸡血藤、茯苓各15 g,白芍、木瓜、葛根、川芎各20 g,全蝎粉3 g(冲服),白术10 g,水蛭粉2 g(冲服),甘草6 g,联合西药美多巴治疗阳虚风动型血管性帕金森患者32例,此为治疗组,对照组单独服用美多芭治疗。结果显示,和对照组相比,治疗组美多巴服用量明显减少(P<0.01),而对照组治疗前后西药服用量无明显差异(P>0.05),提示温阳逐瘀定帕汤对阳虚风动型VP患者有效果,并可减少美多巴的用量。温秀新[16]利用人参养荣汤(人参15 g,当归15 g,黄芪15 g,白术10 g,熟地黄10 g,茯苓10 g,陈皮10 g,白芍10 g,桂心10 g,五味子10 g,炙甘草10 g,炒远志10 g),作为治疗组治疗气血亏虚型颤证,共68例,单纯西医治疗组为对照组,共67例,结果显示,总有效率观察组为70.6%,对照组为47.8%,两组相比,差异有统计学意义(P<0.05),提示人参养荣汤可通过益气养血、养心安神来改善气血亏虚型颤证(帕金森综合征及帕金森病)临床症状, 提高患者生存质量。张金培等[17]利用定风除颤汤,炙龟板15 g,鳖甲15 g,生龙骨、生牡蛎(打碎先煎)各30 g,白芍30 g,蝉蜕15 g,生地黄、熟地黄各20 g,僵蚕10 g,何首乌10 g,全蝎5 g,麦冬15 g,红花10 g,当归10 g,钩藤15 g,甘草5 g,每日1剂,早晚温服,每次200 mL,共42例。对照组口服西药美多芭和泰舒达,共41例。结果显示,治疗组总有效率为91%,对照组为73.33%,组间对比,两组差异有统计学意义(P<0.05);治疗组中42例中总有效率为92.86%,对照组总有效率为73.17%,两组对比,总有效率有统计学意义(P<0.05),治疗组疗效明显优于西药对照组,同时,结合患者不良反应情况反馈明显减少。提示加用定风除颤汤可提高肝肾阴虚型颤证疗效,减轻副作用。陈阳等[18]利用血府逐瘀膏(桃仁12 g,当归9 g,柴胡3 g,红花9 g,牛膝9 g,枳壳6 g,川芎5 g,生地黄9 g,桔梗5 g,赤芍6 g,甘草3 g)治疗气滞血瘀证老年颤证患者90例。患者随机分为对照组与治疗组,对照组口服多巴丝胼片,治疗组不服用抗精神病与抗癫痫药物,且一疗程为2个月时间。两组治疗前后NMSS频数积分均降低(P<0.05)。提示血府逐瘀膏联合多巴丝胼片对气滞血瘀型颤证患者非运动症状有所改善。
这些单独使用中药治疗帕金森病或运用方剂治疗帕金森病的研究有临床指导意义,并为临床治疗提供新思路。中医药可能通过减少西药剂量,推迟左旋多巴添加时间,增强抗帕金森药物疗效来缓解西药引起的异动症,缓解患者非运动症状。
3 中医药对帕金森病现代生物学研究
PD的典型病理学特征是黑质致密部多巴胺神经元变性,残存的神经元内形成嗜酸性包涵体即路易小体[19]。目前理论认为,脑内神经递质失衡导致帕金森症状的发生。纹状体多巴胺神经元的减少使与之拮抗的乙酰胆碱相对亢进,这种失衡引发皮质-基底节-丘脑-皮质神经环路紊乱,进一步引发肌强直、静止性震颤及运动迟缓。然而PD发病机制尚不明确。但目前很多研究显示中药可通过干预信号传导通路来改善患者症状,延缓帕金森病进程,如图1所示。
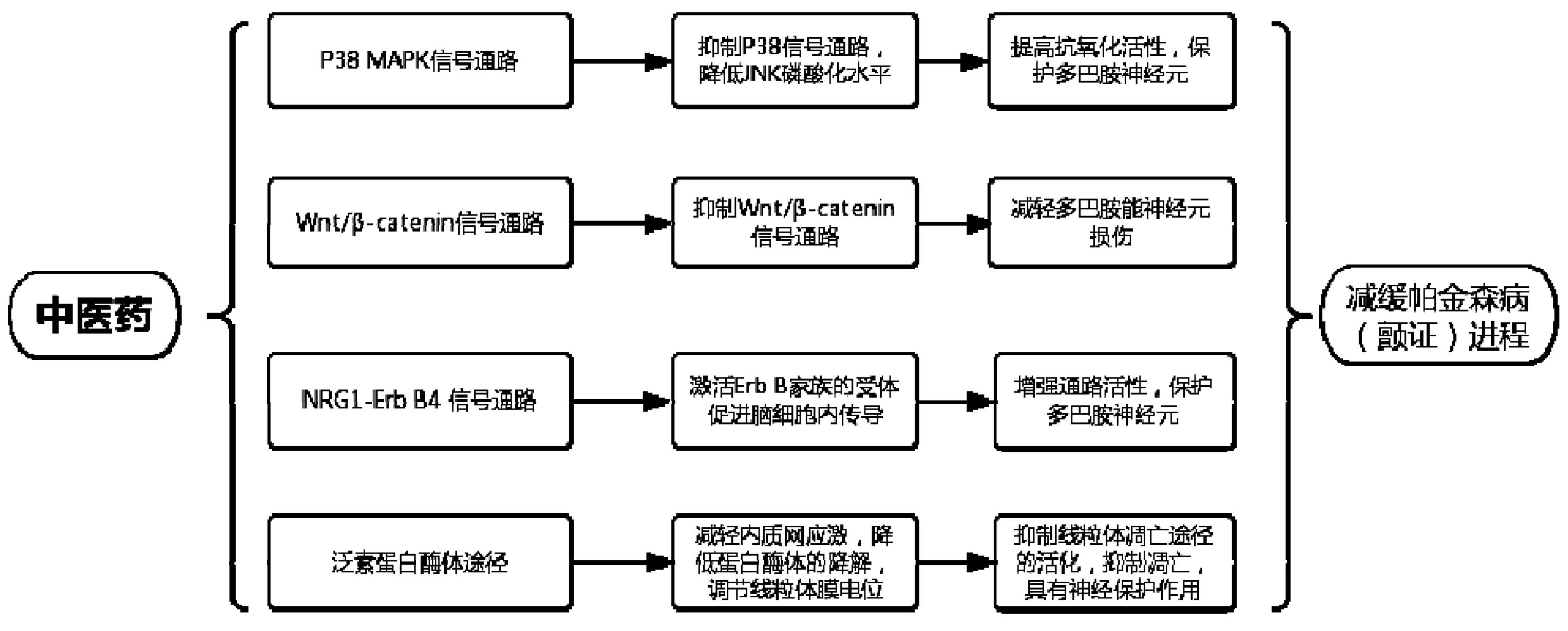
图1 中医药通过信号通路对帕金森病作用过程
3.1 P38 MAPK信号通路
P38 MAPK信号通路包括P38信号通路和JNK信号通路。以往对PD患者尸检发现,黑质致密部神经毒性产物一氧化氮(NO)大量表达,诱导型一氧化氮合酶(iNOS)高度活化[20]。王茜等[21]运用免疫组织荧光和免疫蛋白印记法观察小鼠黑质酪氨酸羟化酶(TH)、磷酸化P38(p-P38)、iNOS、NF-κB等的表达,并在此基础上给予小鼠SB203580后继续观察影响变化。结果显示,P38 MAPK通过激活NF-κB诱导模型小鼠多巴胺神经元的损伤,同时,抑制P38信号通路可在一定程度保护PD模型小鼠多巴胺神经元。 线粒体功能障碍、氧化应激、泛素蛋白酶体系统功能障碍等病理变化直接或间接促进PD发生[22-24]。同时发现,激活c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)通路可引发上述病理变化[25-27]。JNK通路在细胞周期、生长、凋亡和细胞应激中起作用。芦娟[28]将72只雄性SD大鼠分为6组,分别标记为空白组、模型组、假手术组、电针组、药物组和针刀组。结果显示,针刀干预减轻PD大鼠黑质神经元炎症反应,其可能与降低COX-2/p-c-Jun的活性有关,从而达到抑制JNK磷酸化水平的效果,同时提高TH的抗氧化活性,因此中医药可以通过此通路保护神经元细胞,针刀作用机制可能与抑制JNK信号通路有关。
3.2 Wnt/β-catenin信号通路
Wnt/β-catenin信号是中脑多巴胺能(mDA)神经元的神经发生的关键环节,可促进帕金森病(PD)和PD的MPTP小鼠模型神经退化[29]。杨青[30]发现在MPTP诱导的帕金森病小鼠腹侧中脑区域,存在经典Wnt信号通路失活,并得出结论可能通过抑制经典Wnt信号通路而减轻小鼠帕金森病模型黑质致密部多巴胺能神经元的损伤。
3.3 NRG1-Erb B4信号通路
神经调节蛋白1( neuregulin 1,NRG1) 属生长因子,可以促进神经系统的发育,同时参与神经细胞存活、增殖与分化的过程。除此之外,它还参与神经元的迁移,神经细胞内神经突起的外向性生长和神经突触的形成,并且能营养多巴胺能神经元。激活Erb B家族的受体酪氨酸激酶使生物信号在细胞内进行传导,从而调节脑内生理活动。NRG1 的主要受体包括Erb B4受体,脑内神经元中的生理效应主要依赖NRG1的调节。李苗苗等[31]运用人参皂苷Rg1对小鼠进行干预,结果提示人参皂苷可能通过保护DA,可能通过激活小鼠中脑黑质NRG1-Erb B4的通路而改善PD的症状。
3.4 泛素蛋白酶体途径
迄今为止,PD的病因及发病机制尚不完全清楚,目前研究表明无论是家族性或散发性PD,蛋白质异常积聚(泛素/蛋白酶体途径)和线粒体氧化损伤(线粒体途径)可能是导致PD患者发病的关键机制。泛素/蛋白酶体途径(ubiquitin-proteasome pathway,UPP)属于真核细胞内非溶酶体蛋白降解系统,参与蛋白质代谢与功能。当细胞内出现正常、突变、损伤与异常折叠的蛋白质时,它能选择性地降解超过80%,从而维持细胞内环境的稳定。泛素子系统包括泛素(ubiquitin,Ub)、泛素活化酶(ubiquitin-activating enzyme,E1)、泛素结合酶(ubiquitin-conjugaring enzyme,E2)、泛素连接酶(ubiquitin protein ligase,E3)和去泛素化酶(deubiquitin enzymes,DUBs)。其中,蛋白酶体(proteasome)子系统由两种蛋白酶体组成,分别为20S蛋白酶体和26S蛋白酶体。在细胞内,20S蛋白酶体可以和多个酶激活因子亚基结合形成26S蛋白酶体,其具有更高的生物活性。20S是催化中心,分别由2组14个α型亚单位(α1~α7)和两组14个β型亚单位(β1~β7)组成。β1、β2和β5亚单位分别具有半胱天冬酶样、胰岛素样和糜蛋白酶样裂解特异性。待清除的蛋白质首先要在E1、E2、E3酶的作用下最终形成多聚泛素化蛋白,再在E3酶的作用下将被泛素化的底物提交给26S蛋白酶体,进入20S核心,被水解成小片段,底物在被水解之前,去泛素化酶作用于多聚泛素链,解离并被分解为单体,得以重新利用于泛素循环中。
泛素蛋白酶体系统(ubiquitin-proteasome system,UPS)在PD发病机制中的重要作用越来越受到关注[32-34]。McNaught等在散发性PD患者尸检的黑质细胞内首先检测到与底物泛素化有关的重要酶E1、E2、E3的活性下降[35]。进一步研究显示,黑质20S蛋白酶体α2亚基、蛋白酶体激活亚基PA700、PA28也有丢失[36]。UPP功能被抑制或受损导致蛋白的聚集,同时聚集蛋白的过量表达或突变也削弱UPP的功能,形成恶性循环。PD病理学改变的两大特征:一是中脑黑质内多巴胺神经元(DA)的缺乏,二是嗜酸性小体路易小体形成于残存的多巴胺神经元内。研究表明路易小体的主要成分是泛素和α-synuclein等成分,前者是UPP的主要组成成分,后者基因突变是导致家族性PD的重要原因之一,α-synuclein基因突变可以使α-螺旋向β-片层改变,导致蛋白聚集,这也提示UPP功能损伤在PD的发病中起到关键作用。目前应用蛋白酶体抑制剂PSI (Proteasome inhibitor I)、lactacystin等构建了细胞模型最能模拟人PD的动物模型[34,37-40]。蛋白酶体抑制剂诱导的动物模型其行为学、影像学、病理学和生化特征都与PD的特征极为相似,这进一步提示PD的发病与机体内蛋白酶体的功能障碍密切相关。另外在已发现的家族性PD突变基因PINK1(PTEN-induced putative kinase 1)、DJ-1、α-synuclein、UCH-L1(Ubiquitin carboxyterminal hydrolase L1)等都与UPP功能改变有关[41-42]。这从另一方面提示泛素/蛋白酶体途径与帕金森病发病之间联系密切、相互影响。同时,UPP作为蛋白降解的主要途径,不仅在PD发病机制中的作用倍受关注,并可能成为PD治疗的靶目标。
近年来,PD研究的基本手段是外源性神经毒素诱导形成PD细胞模型,在PD发病机制研究及药物研究中发挥重要作用[43]。大鼠肾上腺嗜铬瘤细胞(pheochromocy-toma cells,PC12)细胞株,具有神经细胞特性,同时可稳定传代,其主要分泌儿茶酚胺类物质。目前,PC12细胞模型常应用于抗PD药物的体外基础研究,已成为理想的细胞模型[44],在病理、生化等方面模拟人类PD的模型是利用MPTP建立的模型,此模型稳定可靠,是探索PD发生机制、生化异常、线粒体异常及筛选神经保护药物的良好模型[45],而用蛋白酶抑制剂(PSI)作用于PC12细胞建立的PD模型,实验中模拟的包涵体在形态和结构等方面,最接近PD患者的嗜酸性小体,成功再现了PD的重要特征[46]。张磊[47]应用蛋白组学对该模型的差异表达蛋白进行了研究,质谱成功鉴定了六个,其中包括葡萄糖调节蛋白94(GRP94)。随后,Zhang Y等[48]研究发现,中药管花肉苁蓉提取物松果菊苷(ECH)可在体内和体外通过GRP94信号通路减轻6-羟基多巴胺(6-OHDA)引发的内质网应激而保护黑质纹状体神经元,从而减缓帕金森病程进展。Bcl-2家族参与神经元凋亡,调节Bcl-2/Bax比例可以调节细胞所处凋亡阶段[49-50]。王颀林[51]利用大吴风草(FJ)提纯物(FJ1)预处理能显著抑制百草枯(PQ)诱发的caspase-9的活化、caspase-3的活化、Bax/Bcl-2的比例升高及线粒体膜电势的降低程度,这些结果提示FJ1预处理能抑制线粒体凋亡途径的活化。同时,Sun R等[52]探讨芍药苷PF对谷氨酸诱导的大鼠嗜铬细胞瘤(PC12)细胞神经毒性的保护机制。 结果显示PF对PC12细胞的谷氨酸依赖性损伤具有保护作用,其神经保护作用机制与上调Bcl-2和下调Bax蛋白表达密切相关。说明PF通过调节线粒体膜电位和Bcl-2/Bax信号通路,对谷氨酸诱导PC12细胞凋亡具有神经保护作用。
4 展望
综上,诸多中医药通过信号通路对帕金森病的治疗都有一定疗效,且其中大部分已得到临床试验疗效支持。帕金森病的发病机制尚未完全被阐明,抗帕金森药物之间的相互主要机制的探索还不彻底。但中医药在治疗PD方面具有很大潜力,临床实验中,中药辅助治疗比单纯西药治疗对PD患者有更好的疗效,且副作用小。随着分子生物学的发展,相信人类将迎来帕金森治疗的新时代。

