杂交竹抗梢枯病诱导因子筛选及其持续期研究
何倩倩 刘雨欣 方馨玫 朱天辉 谯天敏 韩珊 李姝江


摘要本文利用病原毒素同源异质的特点诱导杂交竹抗病潜力,筛选出抗梢枯病的最佳诱导因子并排除其对病原菌的直接作用,经琼脂玻片萌发法测定3种诱导因子(温度灭活毒素、蛋白酶降解毒素和细胞壁成分)对杂交竹梢枯病病原茵暗孢节菱孢茵孢子萌发的抑制作用,結果显示经过60°C灭活毒素浓度为40ug/mL处理的孢子萌发效果最为理想。通过最佳诱导因子对杂交竹不同品种诱导持续期进行测定,采用针刺法先接种诱导因子后挑战接种病原菌,1~40d内观察抗感品种对诱导因子响应的差异,症状上杂交竹8#的感病程度重于3#和6#,40d时叶片和枝干变黄干枯,病情指数结果表明,3个杂交竹品种接种诱导因子后感病程度降低,诱抗效果显示杂交竹6#的诱抗指数高于3#和8#。以上结果证明诱导因子使不同杂交竹品种均产生了一定的抗性且抗性越强的品种诱导抗性越好。
关键词杂交竹梢枯病;暗孢节菱孢菌;诱导因子;抗病性;孢子萌发
中图分类号:S763.1,S 436.8文献标识码:A DOI:10.16688/j.zwbh.2018053
激发子可诱导植物自身抗性,安全性好且抗性较为稳定,持效期长,能对多种真菌、细菌和病毒病害起到抵抗作用。生物源诱导因子是来源于寄主植物或由病原物与寄主植物互作后产生的能激发寄主植物防卫反应的物质,赵继红等按生物化学结构不同将其主要分为寡聚糖、蛋白类激发子、糖蛋白。Ye等研究发现,先接种TMV或烟草霜霉病菌Peronos pora tabacina均可提高烟草对这两种病的抗性。从真菌细胞壁、微生物代谢产物以及植物细胞壁等处分离得到的激发子(elicitor)也能与活菌一样诱导植物产生抗病反应。赵继红等通过体外抑菌试验及对植物幼苗活体生物测定证明了灰霉菌菌丝体提取物的防病效果可达55.6%。胡景江等研究了杨树溃疡病菌细胞壁裂解物一低聚糖对杨树细胞相关抗病指标的诱导作用。李云锋等的研究发现,接种稻瘟菌细胞壁来源的糖蛋白稻瘟菌激发子CSBI能诱导亲和性与非亲和性互作品种与抗病相关酶的活性增加。李洪连等报道,从诱抗菌菌丝细胞壁中获取的激发子,与活的诱抗菌一样能诱导黄瓜产生对炭疽病的抗病反应。因为生物源诱导因子与自然环境相容性好,因此是研究的热点。在非生物源诱导因子方面,研究比较多的为水杨酸(SA)及其衍生物、茉莉酸(JA)及其衍生物。郭红莲等用不同非生物作为诱抗剂,结果表明水杨酸的诱抗效果最好。宾金华等用茉莉酸甲酯作为诱抗剂来处理烟草对抗炭疽病,明显提高了幼苗内过氧化氢酶、苯丙氨酸解氨酶等的含量。因此这些物质也能诱导植物产生对抗病害的能力。除此之外一些物理因素如冷冻处理、高温处理以及紫外光照射等都能够引起植保素的产生和累积,诱导植物产生抗病性。Kubo等利用非生物因素高温处理作为诱导因子使温室中黄瓜的抗病能力得到了增强。李宝聚等通过高温(40~50℃)预先对黄瓜幼苗处理1~2h,不同程度地诱导了黄瓜幼苗对黑星病Cladosporium cucumerinum的抗性。Dean等发现通过机械损伤、干冰或电磁效果等方法不同程度诱导了烟草对霜霉病的抗性。因此,诱导抗性在目前众多植物病害控制中最具有应用潜力。
撑×绿杂交竹梢枯病是严重影响杂交竹生长的重要病害,导致其枯死的病原为暗孢节菱孢菌Ar-thrinium phaeospermum(Corda)M.B.Ellis。有关竹类梢枯病的研究较多,而杂交竹梢枯病大多集中于发病规律和症状、病原菌、培养基筛选等,对诱导抗病性方面诱导因子的筛选及寄主植物分泌物特性的研究较少。仅李姝江等以杂交竹梢枯病菌一暗孢节菱孢菌为对象,对其毒素致病组分进行确定,通过毒素粗提透析与浓缩以及对致病毒素进行分离、纯化和序列分析、致病力测定等确定了纯毒素的基本性质。本研究在此纯毒素基础上从温度灭活毒素、毒素经不同蛋白酶降解及细胞壁成分对暗孢节菱孢的抑制作用这三个方面来筛选最佳诱导因子,并结合室外持续期测定病情指数及其诱抗效果,筛选出最佳诱导因子,同时也能排除灭活毒素对病原菌的直接影响。
1材料和方法
1.1供试材料
供试杂交竹品种:杂交竹3#(中抗)、杂交竹6#(抗病)、杂交竹8#(感病),栽植于四川农业大学温室大棚。
供试真菌:暗孢节菱孢菌Arthrinium phaeo-spermum(Corda)M.B.Ellis,分离于杂交竹梢枯病竹,由四川农业大学森林保护实验室提供。
该菌株纯化毒素由四川农业大学森林保护学实验室提供,将纯化后的蛋白毒素用无菌蒸馏水稀释成10、20、40、80ug/mL溶液。
1.2主要试剂和仪器
苏静安泰SW-CJ-2FD型超净工作台;LDZX-40BI立式自动电热压力蒸汽灭菌锅;BX51显微镜,奥林巴斯株式会社;BSG-800程控光照培养箱,上海博讯实业有限公司;DELTA-320pH计,北京联合科力科技有限公司;“U”形玻棒;血球计数板;载玻片;葡萄糖;琼脂。
1.3诱导因子筛选
孢子悬浮液的制作:取25℃培养5~7d的A phaeospermum活化菌株斜面,加入5mL无菌水,用接种环将分生孢子刮下,使其悬浮,将菌悬液在旋涡振荡仪上振荡10min,转入三角瓶(含玻璃珠)中,置于摇床150r/min振荡30min,用灭菌脱脂棉(或双层纱布)过滤得到孢子悬浮液,适量移入1.5mL离心管中,滤液用血球计数板计数。
1.3.1温度灭活毒素对暗孢节菱孢的抑制作用
采用玻片萌发法测定温度灭活毒素对孢子萌发的抑制作用。纯毒素分别经20、40、60、80、100℃处理15min,而后分别配制毒素终浓度为10、20、40、80ug/mL的病菌孢子悬浮液(孢子浓度数量级为107),用1mmol/L NaOH调节pH至6.8。于无菌环境中取洁净的载玻片,在灭菌并冷却至50C左右的2%水琼脂培养基中蘸一下,待凝成薄层后,去掉一面琼脂培养基,将有琼脂培养基的一面朝上,平放在培养皿的“U,形玻棒上,再将配制的病菌孢子悬浮液涂抹在培养基上,盖上盖玻片和培养皿。培养皿于25~28℃保湿培养,以无菌水为对照,分别在5、10和24h后测定孢子萌发率,每处理观测100~300个孢子。
1.3.2毒素经不同蛋白酶降解后对暗孢节菱孢的抑制作用
采用玻片萌发法测定毒素经蛋白酶降解后对孢子萌发的抑制作用。纯毒素分别经胰蛋白酶、糜蛋白酶、羧肽酶A(羧肽酶B)、蛋白酶K处理20h(最终酶浓度为1mg/mL),然后分别配制毒素终浓度为10、20、40、80ug/mL的病菌孢子悬浮液,用1mmol/L NaOH调节pH至6.8。按1.3.1方法测定孢子萌发率。
1.3.3细胞壁成分对暗孢节菱孢的抑制作用
暗孢节菱孢菌细胞壁成分提取:菌种转管活化接种在PDA培养皿中,于25℃培养箱中培养,挑取经PDA培养5d后的菌块;打孔后接种于200mL已灭菌的PD培养液中,将培养7d的培养液用4层灭菌纱布在超净台中过滤得到菌丝体,然后用50mmol/L磷酸盐缓冲液(pH7.0)洗涤3次,再悬浮于磷酸盐缓冲液(含0.5%Triton-100)中,200r/min匀浆3~5rnin,中问每隔1min问歇1次;随后4000r/min离心10min,取沉淀用乙醇洗涤,再次对其进行离心并用去离子水洗涤,最后按l g沉淀加10mL蒸馏水的比例将沉淀悬浮于去离子水中,于121℃高温水解2h,冷却后11200r/minN心20rain,上清液用0.22um微孔滤膜过滤,收集滤液即为细胞壁成分,低温保存。
配制细胞壁成分终浓度为10、20、40、80ug/mL的病菌孢子悬浮液,1mmol/L NaOH调节pH至6.8。按1.3.1方法测定孢子萌发率。
1.4最佳诱导因子的效果
根据室内试验的筛选结果,选取最佳诱导因子进行诱导抗病性持续期测定,比较最佳因子对不同品种的诱导效果。设置两组处理:一组为先接种无菌水后接种菌悬液处理(a),对照为先接种诱导因子后接种A phaeospermum菌悬液处理(b);另一组为先接种最佳诱导因子后再接种无菌水处理(c),对照为仅接种无菌水处理(d)。通过前人对诱导处理和挑战接种问隔时问对诱抗效果影响的研究,确定最佳诱导效果问隔时问为3~7d,因此选择第3天挑战接种。调节诱导因子溶液pH至6.8,加0.05%吐温80备用。选择长势均一的杂交竹上部嫩枝8条进行喷雾涂布处理,以溶液布满嫩枝不下流为宜,套袋保湿12h,第2、3天各重复处理1次,以确保诱导因子能够被植株有效吸收。以无菌水为对照。每个品种分别处理15株,于最后一次处理后的第1、3、5天针刺接种暗孢节菱孢菌(针刺部位在嫩枝顶端节叉处,不刺穿为宜),伤口处滴一滴菌液,约0.05mL;套袋保湿,于接种后1、3、5、10、15、20、25、30、35、40d调查发病情况,按照下列方法计算病情指数及其诱抗效果。病情分级标准:0级:无枯萎;1级:25%以下枝枯;2级:25%~50%(包含25%和50%)枝枯;3级:50%~75%枝枯(包含759/6);4级:75%以上枝枯。
病情指数=[∑(各病级数×病枝数)/(总枝数×发病最重的病级数)]×100;
诱抗效果=[(对照病情指数一处理病情指数)/对照病情指数]×100%。
2结果与分析
2.1杂交竹梢枯病病害症状及病原菌形态特征
暗孢节菱孢菌Arthrinium phaeospermum(Corda)M.B.Ellis为杂交竹梢枯病的病原菌,感病的杂交竹竹梢的某一节或某一枝条的节杈处出现褐色舌形或菱形病斑且在枝干上生成分生孢子器。该病原菌在PDA培养基上气生菌丝发达,棉絮状,初为白色,后逐渐变为灰白色,菌落底部可呈褐色。显微镜下该病原菌的孢子为暗褐色,分生孢子单细胞,圆形、椭圆形或透镜狀(橄榄形),以圆形为多,而透镜状(橄榄形)分生孢子中问有1条无色的发芽缝。
2.2诱导因子的筛选
通过玻片萌发法对3种诱导因子处理后的孢子萌发进行不同时问段观察,以清水作为对照,发现5h时对照和经过诱导处理的孢子萌发存在一定的差异,且24h时差异较明显。分生孢子在清水中5h已经开始萌发,且萌发力较强。萌发时孢子端略开口,从各个端口长出菌丝状的芽管甚至有3~4条芽管的,在24h已基本萌发完全。而处理组在5~10h也开始萌发但萌发较慢,24h清水中和温度灭活的孢子芽管均较长且开始分叉(图2)。
2.2.1温度灭活毒素对暗孢节菱孢菌的抑制作用
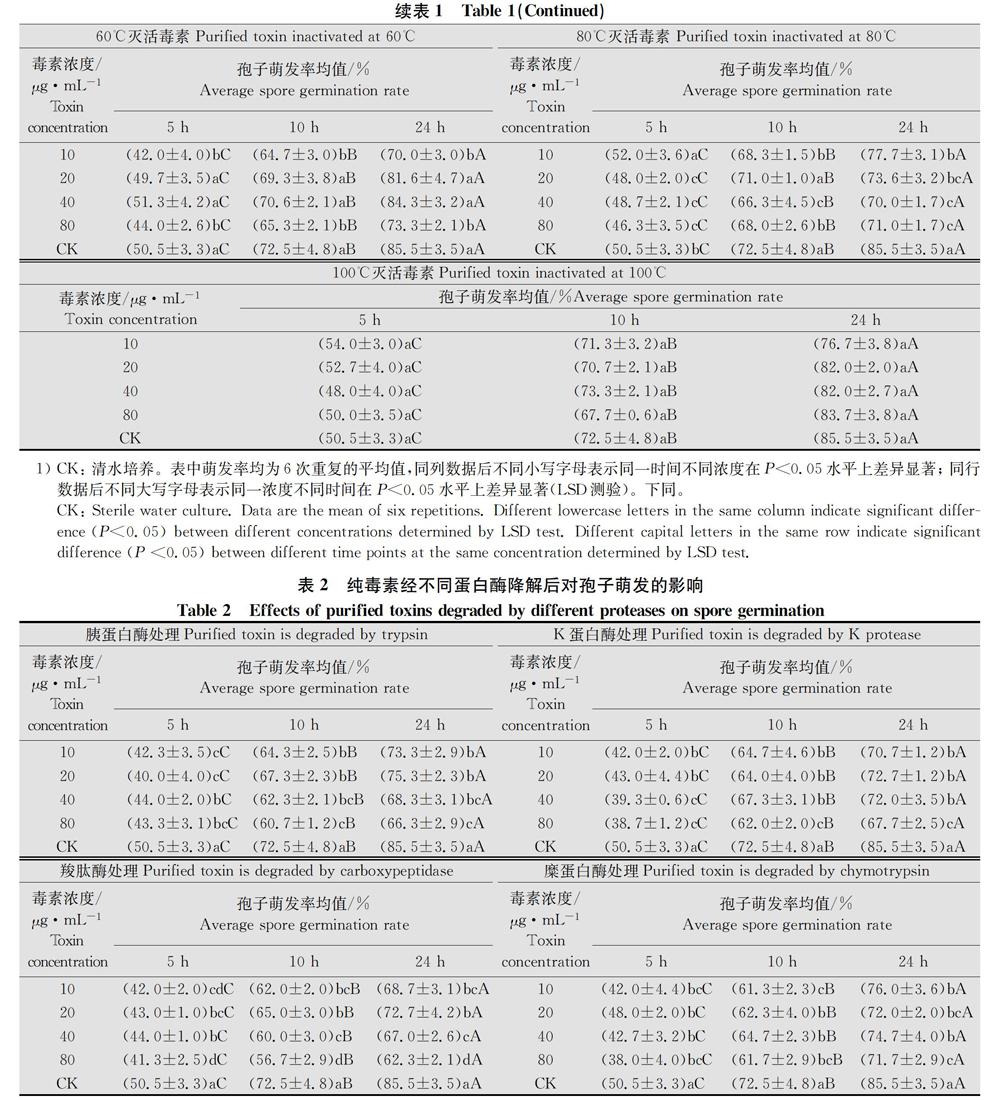
毒素经过不同温度灭活后设置梯度浓度,在5、10h和24h观察孢子萌发率。由表1可见,毒素在经过60℃及以上温度处理后,几个梯度浓度下的孢子5h时均已萌发,甚至部分处理萌发率达到了50%,10h时已经萌发约70%,24h萌发率为70%~84.3%;而毒素经过40℃及以下温度处理后,5h时仅有30%左右的孢子萌发,10h时萌发约50%~60%,24h达到56.3%~82.0%。毒素在20℃和40℃处理下不同浓度作为诱导因子对孢子萌发均有明显的抑制作用,80ug/mL的浓度抑制效果突出。毒素在100℃灭活下不同浓度作为诱导因子孢子萌发率均与对照相近,且不同处理孢子萌发率不存在显著差异。在60℃处理下20、40ug/mL均与对照萌发率接近,特别是40ug/mL的5、10h和24h孢子萌发率分别为51.3%、70.6%和84.3%与对照仅相差0.8、1.9和1.2百允点,5h时萌发率甚至高于对照。而10、80ug/mL浓度下抑制作用较大,孢子萌发率低于40ug/mL,因此选用最佳因子为毒素在60℃下灭活且浓度为40ug/mL。
2.2.2毒素经不同蛋白酶降解后对暗孢节菱孢的抑制作用
由表2可见,毒素经过4种不同蛋白酶处理后在同一时问段不同浓度处理与对照有显著差异,且随着浓度的升高抑制效果更加明显。毒素经过胰蛋白酶、K蛋白酶、羧肽酶处理作为诱导因子配制梯度浓度,均为浓度20ug/mL的孢子萌发效果较好,尤其在10h时胰蛋白酶处理的与对照仅差5.2百分点,但在24h时差距达到了10.2百分点。而糜蛋白酶处理下浓度10ug/mL的孢子萌发效果较好,24h时孢子的萌发率高于其他3种酶处理下的,但也只达到76.0%,与对照85.5%差异显著。
2.2.3细胞壁成分对暗孢节菱孢的抑制作用
从表3可以看出细胞壁成分对孢子萌发的影响,随着时问的延长孢子萌发率的差异越来越明显。20ug/mL处理相比其他浓度萌发效果较好,在10h和24h时萌发率分别达到60.0%、69.3%,与对照72.5%、85.5%相差12.5百分点和16.2百分点,且同一时问段随着浓度的提高孢子萌发率显著降低。
通过玻片萌发法观察诱导因子对病原菌暗孢节菱孢菌孢子萌发的影响,发现3种诱导因子对孢子萌发均有一定的抑制作用。在毒素经过温度灭活作为诱导因子组中,萌发效果较好的为经过60℃灭活、毒素浓度为40ug/mL处理,其24h时的萌发率为84.3%。在毒素经过4种蛋白酶降解作为诱导因子组中,萌发效果较好的为糜蛋白酶处理下毒素浓度10ug/mL,24h时的萌发率为76.0%。在细胞壁成分作为诱导因子组中20ug/mL的孢子萌发效果较好,24h时的萌发率为69.3%。
从以上结果可以看出,不同蛋白酶对毒素处理和细胞壁提取物不同浓度处理对病原菌暗孢节菱孢菌的孢子萌发均有抑制作用,温度灭活处理80C和40℃及以下温度对孢子萌发也有抑制作用,而100℃温度处理孢子萌发与对照不存在显著差异。因此,最终选择经过60℃灭活毒素,浓度为40ug/mL作为最佳诱导因子。
2.3室外持续期病情指数和诱导效果比较
2.3.1杂交竹不同品种诱导后的症状
通过图3得出,接种后,经过40d持续观察,3个不同杂交竹品种的症状表现均不同。对于3个不同杂交竹品种,杂交竹8#的感病程度高于其他两个品种。从a组来看杂交竹8#的叶片几乎全部变黄枯萎枝干也全部干枯,3#叶片大多数变黄枯萎但枝干仅干枯少部分,而6#仅有少数叶片变黄枝干未见干枯。b和c组病情指数均有降低,但8#的叶片变黄枯萎程度依然高于3#和6#。
2.3.2杂交竹不同品种不同处理诱导后的病情指数
从图4中变化动态得知,CK2组上升的趋势高于处理组1、CKl和CK3,1~10d缓慢上升,10~30d上升的幅度变大,30~40d上升的幅度又开始减缓。CK2中杂交6#的病情指数在40d时增加到了37.69,而杂交3#增加到了48.38,杂交8#增加的最高,达到了63.15。图中也看出CK28整个观察时问段折线一直处于最高。3#、6#和8#对应的折线变化趋势与CKl-3#、CKl-6#和CKl-8#相近,1~30d有缓慢的上升趋势,30~40d趋于稳定。3#、6#、8#在40d时病情指数分别为25.42、19.71和32.43,相比CK2低了17.98、22.96、30.72。CKl的3个杂交竹品种40d时与CK2相比病情指数也分别低了16.88、22.26和29.9。而CK3整个时问段变化不明显波动,幅度也不大,病情指数也最低,3#、6#和8#分别为13.46、9.08和19.49。
2.3.3杂交竹不同品种诱导后的诱抗效果
通过图5可看出10~25d期问3条直线都是升高趋势,25~40d趋于稳定,这可能是开始病原菌对寄主植物造成一定的伤害,后诱导激发了寄主植物自身的抗性,增强了对抗逆境的能力。抗性品种的诱抗指数折线图整个时问段一直高于感病品种。从6#的诱抗效果动态变化来看,1~10d折线先降低,10~20d有缓慢的上升趋势,20~40d稳定,此时的诱抗指数稳定在49.23%左右。3#诱抗指数在1~5d从46.97%降到了38.12%,5~25d又升高到了46.99%,30~40d稳定在48.53%左右。8#在1~5d诱抗指数稳定于26.92%左右,10~35d有较大幅度的上升,平均值达到了47.10%。总之,杂交6#的折线在整个时问段均高于杂交3#和杂交8#,而杂交8#相对于杂交6#、杂交3#两个品种折线波动幅度变化更大,尤其在5~25d呈直线上升趋势,杂交6#诱导处理后变化幅度最小。
通过图4病情指数比较得知,3个不同杂交竹品种在4种不同处理方式中均呈现CK3植株的病情指数最低,CK2的病情指数最高。处理组1的病情指数低于CK2,表明诱导因子使植株抗性增加。而图5诱抗效果比较得出,杂交竹6#整个时问段的诱抗平均值达到了50.16%,高于杂交竹3#和8#,说明抗性品种对诱导因子的响应更明显。
3结论与讨论
3.1不同诱导因子对病原茵孢子萌发影响不同
诱导因子又称为诱抗剂、激发子,是靠诱导物获得抗性。它与自然获得抗性具有相同的抗病谱,且诱导产生的抗性与自然产生的抗性和机理是相同的,诱导物本身对病原物没有直接杀伤作用,是能够诱发植物产生抗病防卫反应的物质。葛银林、李洪连、李开本等的研究表明,激发子是能够诱导植物产生抗病反应(或植保素)的特殊物质,而May-ama、Ehrenshaft、Moussatos、章元寿、董金皋等的研究结果说明毒素可以作为激发子增加植物体内的抗病物质,起着与受体问相互识别的作用。本试验选用温度灭活的毒素、经过不同蛋白酶处理的毒素和病原菌细胞壁成分作为3种诱导因子,对诱导因子设置不同浓度梯度,采用玻片萌发法观察其对病原菌孢子萌发的影响。经过细胞壁成分处理的孢子在5h时平均萌发率为16.25%,经过蛋白酶处理毒素后的孢子平均萌发率为18.29%,经过温度灭活处理毒素的孢子萌发率为19.09%,与对照相比孢子萌发率均低于清水中的萌发率,但经过温度灭活处理毒素的孢子萌发率更接近清水中孢子萌发率,而相比5h时细胞壁成分对病原菌有明显的抑制作用。10h同样温度灭活毒素与清水中孢子萌发率接近,因此最佳诱导因子选用温度灭活的毒素。
确定选用温度作为最佳诱导因子后,对温度设置梯度20、40、60、80、100℃分别对毒素灭活,进而观察不同温度灭活后对病原菌孢子萌发的影响。由表1可知100℃灭活毒素后观察病原菌孢子萌发率均与清水对照差异不显著,可能毒素已经全部失活,20、40、80℃灭活毒素孢子萌发率与清水存在显著差异,而60℃灭活毒素在20、40ug/mL的浓度下孢子萌发率与清水不存在显著差异,孢子萌发效果较好,毒素浓度10、80ug/mL处理孢子萌发率与清水存在显著差异,因此选用60℃作为最佳温度。
对纯毒素经过60℃灭活后设置梯度浓度10、20、40、80ug/mL观察不同浓度对病原菌孢子萌发的作用。在这4个不同浓度梯度中40ug/mL与清水对照不存在显著差异且萌发效果最好,因此40ug/mL为最佳浓度处理。
综上所述,选出的最佳诱导因子为纯毒素经过60℃灭活处理、毒素浓度为40ug/mL。3.2不同杂交竹品种诱导抗病性存在差异
Dean、Okuno、冉隆贤、蔡新忠、李红玉等的研究表明,在一定的浓度范围内诱导因子与抗性寄主植物的诱导抗病性效果存在正相关关系,抗性越强的品种诱导抗性越好。刘亚光等研究认为灰斑病菌和粗毒素对抗病品种诱导作用强于感病品种。王敬文等研究PAL在抗马铃薯晚疫病中的作用发现,无论病原菌还是病原菌毒素处理,PAL的活性大小与品种抗病性呈正相关。因此对于大多数情况而言,在最佳诱导因子的诱导作用下,抗性品种的诱导抗性要高于感病品种且在一定的时问段后,诱导效应不再增强而趋于稳定。然而对于不同的寄主植物诱导抗病性也存在差异,前人的研究大部分都是针对农作物、经济作物等的幼苗期进行诱导处理的,本试验所选定的研究对象是禾本科植物杂交竹。
本试验用室内试验筛选的最佳诱导因子作用于不同杂交竹品种,观察接种后1~40d的病情指数和诱抗效果。从不同杂交竹品种病情指数和诱抗指数的变化图(图4、5)可看出,经过最佳诱导因子诱导后,各品种病情指数和诱抗效果存在差异。3个不同抗性品种在1~40d的诱抗指数平均值分别为杂交竹6#50.16%,杂交竹3#44.77%,杂交竹8#38.64%,结果与前人的研究相似。杂交竹6#和3#在诱导后1~5d诱抗指数有降低的趋势,5d之后开始上升,25~40d趨于稳定,此时诱抗指数为48.459/6。杂交竹8#对诱导因子反应较为缓慢,1~5d没有变化,5d之后迅速呈直线上升,最终稳定时的诱抗指数为47.54%。杂交竹8#感病品种呈直线上升可能是因为诱导因子对某些生化物质的诱导速度快于抗病品种,但最终的诱抗效果依然是抗病品种高于感病品种。

