翻白草水提液对大鼠胰岛细胞脂毒性损伤的保护作用
孙 洁, 马 旗, 王 璐, 胡雪剑, 杨 扬, 李 赟, 杨 燕
(兰州大学第二医院内分泌代谢科,甘肃 兰州730030)
以高血糖为标志的糖尿病是重要慢性病之一,迄今高血糖发生机制基本环节中胰岛β 细胞衰竭仍是主要因素,而β 细胞凋亡在其功能衰竭的发生中起着决定性作用[1-2]。研究表明,β 细胞长期暴露在高游离脂肪酸环境中可激活其线粒体氧化应激途径,诱导细胞脂性凋亡,胰岛素合成和分泌减少,从而导致β 细胞功能衰退[3-4]。
翻白草为蔷薇科委陵菜属植物翻白草Potentilla discolor Bge.的带根全草,具有降糖、降脂等多种生物活性,但其具体作用机制尚不明确,目前鲜有关注它对胰岛细胞功能的直接影响。黄酮、萜类作为翻白草的主要活性成分,具有抗氧化应激作用[5],由此假设翻白草可通过抗氧化作用减轻胰岛细胞脂性凋亡,从而改善胰岛素分泌功能。本实验采用体外培养的Wistar 大鼠原代胰岛细胞,棕榈酸处理以建立脂毒性损伤细胞凋亡模型,并用翻白草水提液作为干预因素,旨在探讨该药材对胰岛细胞脂毒性损伤的影响。
1 材料
1.1 动物 2 月龄健康雄性清洁级Wistar 大鼠30只,购自兰州大学实验动物中心,实验动物生产许可证号SCXK(甘)2017-0003。
1.2 试剂 翻白草采于甘肃省定西市,经甘肃中医药大学药学院专家鉴定为正品。AnnexinV-FITC试剂盒,购自南京凯基公司;胶原酶P,购自瑞士Roche 公司;大鼠胰岛素ELISA 试剂盒,购自美国R&D 公司;Ficoll 400,购自美国Pharmacia 公司;棕榈酸、牛血清白蛋白(BSA),购自美国Sigma公司;BML-275(AMPK 选择性抑制剂),购自美国Santa Cruz 公司;兔抗AMPK(Thr-172) 抗体、鼠抗胰岛素抗体,购自美国CST 公司;qPCR 试剂盒,购自日本TaKaRa 公司; 还原型谷胱甘肽(GSH)、丙二醛(MDA) 试剂盒,购自南京建成生物研究所。
1.3 仪器 FACSCalibur 流式细胞仪(美国BD 公司);全自动激光共聚焦显微镜(日本Olympus 公司);凝胶成像系统、实时定量PCR 系统(美国Bio-Rad 公司)。
2 方法
2.1 翻白草水提液制备[5]将全草烘干粉碎,加水煎煮3 次,加水量分别为生药体积的10、10、8倍量,煎煮时间分别为1.5 h、1.5 h、40 min,过滤,合并滤液,蒸发浓缩,70 ℃真空干燥,粉碎,过80 目筛,l g 提取物相当于生药6 g。称定提取物62.5 mg,溶于5 mL DMSO 中,配制成12.5 g/L的母液,实验时吸取16 μL 母液加到2 mL 培养基中,配成10 mg/L 含药培养基。
2.2 胰岛分离和纯化 大鼠以10%水合氯醛腹腔注射麻醉,消毒后从下腹作V 型切口,胆总管插管,破心放血后,经胆总管逆行注入胶原酶P 溶液,摘除完整胰腺,37 ℃水浴消化11 min,Hank’s液终止消化,沉淀物加4 mL25%Ficoll 混匀,再加入23%、 20%、 11% Ficoll 液 和Hank’ s 液 各2 mL,1 900 r/min 离心25 min,收集23%→20%、20%→11%界面上细胞层,纯化的胰岛悬液接种于RPMI 1640 培养液, 细胞铺展贴壁后进行分组培养。
2.3 胰岛染色 将胰岛制备物与双硫腙混合后孵育10 min,倒置显微镜下计数双硫腙细胞团数(胰岛细胞为猩红色,非胰岛细胞不着色)。
2.4 分组 ①对照组, 培养在0.5% BSA 中;②棕榈酸组,剂量0.5 mmol/L;③翻白草水提液+棕榈酸组,剂量分别为10 mg/L、0.5 mmol/L,共同孵育;④BML-275 组,含0.5 mmol/L 棕榈酸+10 mg/L 翻 白 草 水 提 液+10 μmol/L BML-275,BML-275 预处理胰岛细胞1 h 后再与翻白草水提液、棕榈酸共同孵育。胰岛细胞均孵育24 h。
2.5 FDA/PI 荧光双染 双醋酸荧光素(FDA)可侵入活细胞发出绿色荧光,而活细胞对PI 染料拒染,PI 与死亡细胞的核酸结合,发出红色荧光。吸尽6 孔板中旧培养基,取适量FDA/PI 荧光染液,与胰岛制备物混合5 ~10 min,在共聚焦显微镜下检测。
2.6 细胞凋亡率检测 胰岛以0.05%胰酶-EDTA消化分散成单细胞悬液后,接种于6 孔板,待细胞贴壁生长稳定后按“2.4” 项下不同干预措施孵育24 h。 收集细胞,多次离心、 洗涤后依次加入10 μL FITC 标记的AnnexinV, 轻轻混匀, 避光15 min后再加入300 μL Binding Buffer 和5 μL 碘化丙啶(PI),避光反应5 min 后上机检测。
2.7 胰岛素分泌功能检测 计数大鼠胰岛,换算为相当于直径150 μm 的胰岛当量 (IEQ), 于15 cm培养皿中接种30 IEQ/皿。干预24 h 后,每组收集15 个胰岛,PBS 洗涤,加入含3.0 mmol/L葡萄糖KRBH 培养液缓冲30 min 后,分别在含3.0 mmol/L(低糖)、20 mmol/L(高糖) 葡萄糖的KRBH 培养液中培养1 h,上清液与-20 ℃冰箱中保存,ELISA 检测基础胰岛素分泌(BIS)、葡萄糖刺激的胰岛素分泌(GSIS),计算刺激指数(SI),公式为SI=BIS/GSIS。
2.8 免疫荧光检测 胰岛细胞接种于载玻片上,相应干预后4%多聚甲醛固定, 封闭后, 兔抗AMPK(腺苷酸激活的蛋白激酶) 抗体和鼠抗胰岛素抗体过夜孵育,DAPI 染色,封片,激光共聚焦下观察。
2.9 实时荧光定量PCR(qPCR) 检测 Trizol 裂解后抽提细胞总RNA,逆转录生成cDNA,qPCR 检测目的基因mRNA 表达水平,以β-actin 为内参,2-ΔΔCt计算其相对表达量。引物序列如表1。

表1 引物序列Tab.1 Primer sequences
2.10 蛋白免疫印迹检测 抽提总蛋白,测定蛋白量后常规SDS-PAGE 电泳转膜,5%脱脂奶粉封闭,依次加入稀释的相应一抗、二抗反应,并依次洗脱,ECL 显影曝光,Quantity One 软件进行图像灰度值分析,以条带灰度值之比计算目的蛋白相对表达量。
2.11 氧化应激指标检测 收集各处理组胰岛细胞,硫代巴比妥酸法检测丙二醛(MDA) 活性,分光光度计法检测还原型谷胱甘肽(GSH) 活性,具体操作步骤按试剂盒说明书进行。
2.12 统计分析 通过SPSS 19.0 软件进行处理,数据用() 表示,多组间比较采用单因素方差分析,两样本均数比较采用t 检验。以P<0.05 为差异有显著性意义。
3 结果
3.1 胰岛分离及胰岛β 细胞原代培养 纯化的大鼠胰岛细胞培养在含10%胎牛血清的RPMI 1640培养基中18 ~24 h,可见贴壁生长。图1 显示,DTZ 染色后大鼠胰岛呈现细胞团样结构,猩红色,圆形或椭圆形,包膜不明显,折光性较强,直径50 ~300 μm 不等,而其他外分泌细胞、成纤维细胞未见红染。本实验分离大鼠胰岛细胞纯度为(89.23±2.9)%,每只可分离(823±24) 个胰岛,细胞存活率在(93.1±3.1)%以上。

图1 大鼠胰岛DTZ 染色Fig.1 DTZ staining of rat islets
3.2 翻白草水提液对棕榈酸诱导胰岛细胞凋亡的抑制作用 FDA/PI 双染后共聚焦显微镜(图2)显示,对照组很少见到死亡细胞;棕榈酸组红色荧光的死亡细胞,明显多于对照组;翻白草水提液干预后死亡细胞明显少于棕榈酸组,细胞存活率明显更高。AnnexinV/PI 双染流式细胞术(图3) 显示,对照组细胞凋亡率为(11.35±0.80)%;棕榈酸持续作用于胰岛细胞24 h 后, 凋亡率显著升高[ (36.35±1.55)%,P<0.01];翻白草水提物+棕榈酸组细胞凋亡率显著降低[ (20.47±0.84)%,P<0.01]。
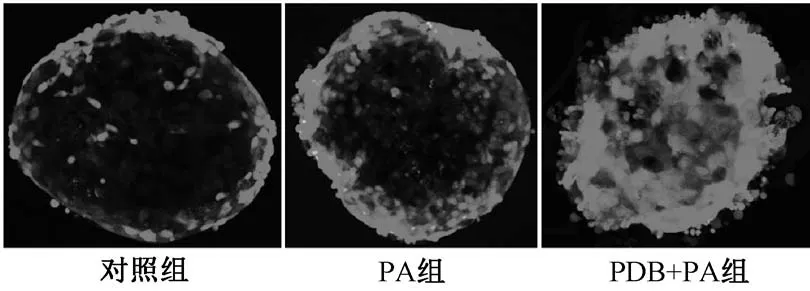
图2 大鼠胰岛细胞FDA/PI 双染Fig.2 FDA/PI double staining of rat islet cells
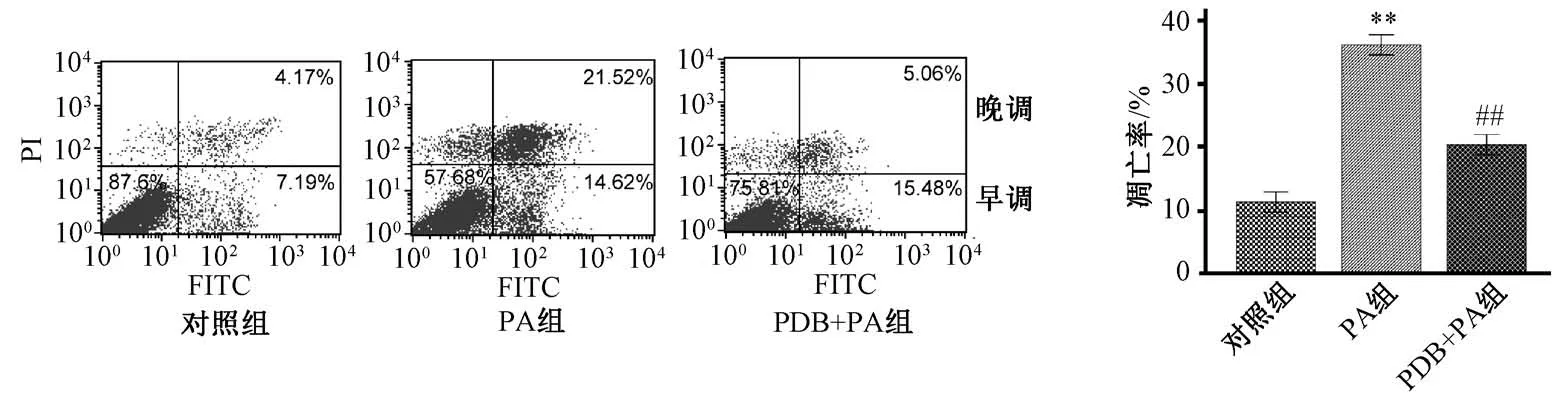
图3 翻白草水提液对大鼠胰岛细胞脂毒性凋亡的影响Fig.3 Effect of aqueous extract of Potentillae discoloris Herba on lipotoxicitic apoptosis of rat islet cells
3.3 翻白草水提液对GSIS 的影响 低糖、高糖溶液中胰岛素分泌量分别为(5.97±0.31)、(21.03±1.11) μIU/mL,SI 为3.52,表明正常情况下胰岛β 细胞分泌功能良好。图4 显示,与对照组比较,棕榈酸组胰岛细胞GSIS 显著减少 [棕榈酸组(11.62±0.58) μIU/mL,对照组(21.03±1.11)μIU/mL,P<0.01];与棕榈酸组比较,翻白草水提物+棕榈酸组GSIS 显著增加[翻白草水提物+棕榈 酸 组 (17.28±0.86) μIU/mL, 棕 榈 酸 组(11.62±0.58) μIU/mL,P<0.01]。

图4 翻白草水提液对GSIS 的影响Fig.4 Effect of aqueous extract of Potentillae discoloris Herba on GSIS
3.4 翻白草水提液对FAS、CPT-1、AMPK 表达的影响 表2、图5A 显示,与对照组比较,棕榈酸组FAS mRNA 表达显著升高, CPT-1 mRNA、 p-AMPK 蛋白表达显著降低(P<0.05);与棕榈酸组比较,翻白草水提物+棕榈酸组中FAS mRNA 表达显著下降,CPT-1 mRNA 表达、p-AMPK 表达显著升高(P <0.05)。图5B 显示,棕榈酸处理后p-AMPK 免疫荧光强度较对照组明显减弱;与棕榈酸组比较,翻白草水提物+棕榈酸组其荧光染色明显增强。
表2 翻白草水提液对FAS、CPT-1 mRNA 表达的影响(,n=30)Tab.2 Effects of aqueous extract of Potentillae discoloris Herba on FAS and CPT-1 mRNA expressions(±s,n=30)

表2 翻白草水提液对FAS、CPT-1 mRNA 表达的影响(,n=30)Tab.2 Effects of aqueous extract of Potentillae discoloris Herba on FAS and CPT-1 mRNA expressions(±s,n=30)
注:与对照组比较,∗P<0.05;与棕榈酸组比较,#P<0.05
组别 FAS CPT-1对 棕照 榈组 酸 组 12..05 01± ±00..00 05 ∗ 10..05 00± ±00..00 0 5∗翻白草水提物+棕榈酸组 1.72±0.35# 0.80±0.08#
3.5 翻白草水提液对GSH、MDA 水平的影响 表3 显示,与对照组比较,棕榈酸组GSH 水平显著降低,MDA 水平显著升高(P<0.05);与棕榈酸组比较,翻白草水提物+棕榈酸组前者水平显著升高,后者水平显著降低(P<0.05)。
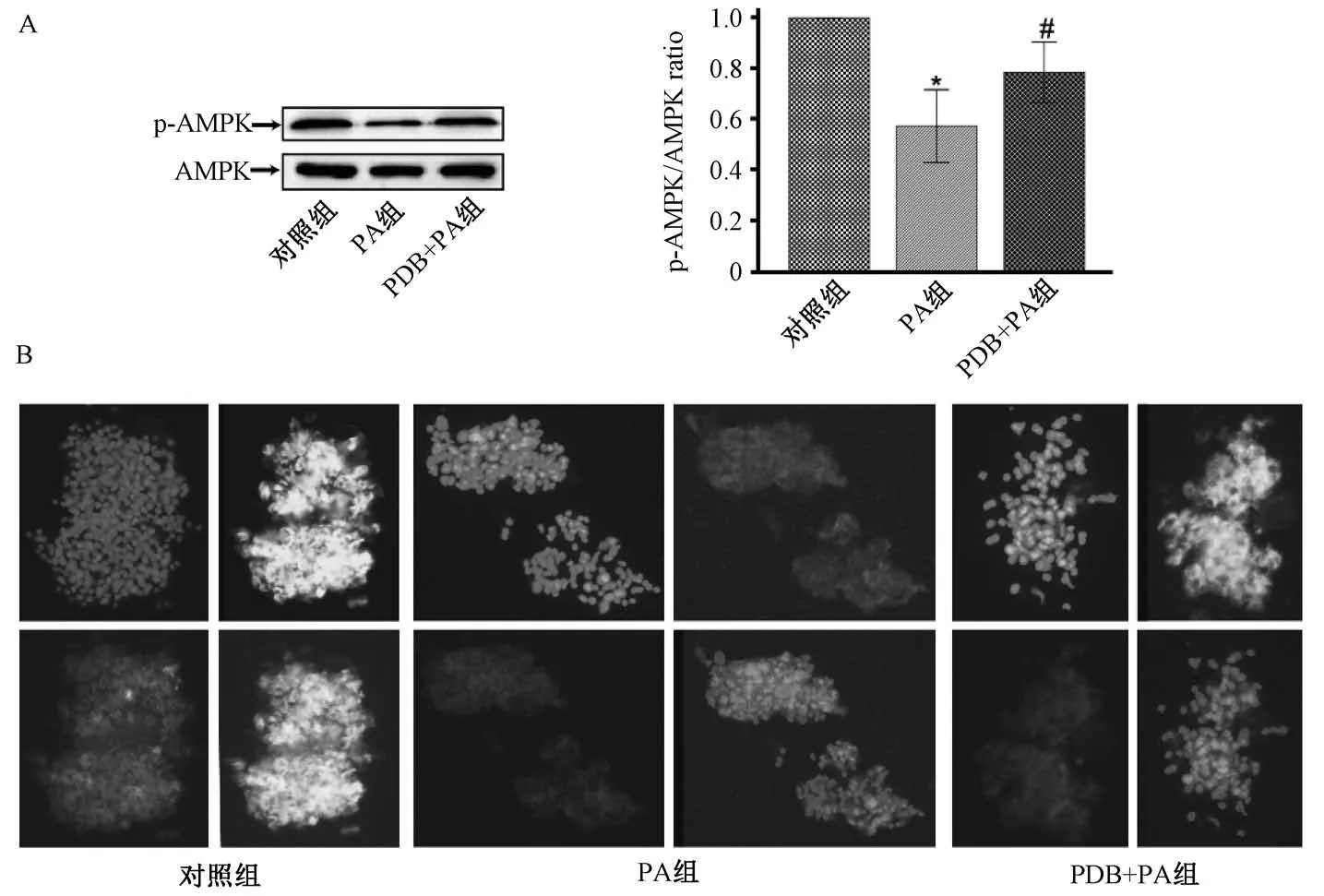
图5 翻白草水提液对p-AMPK 蛋白表达的影响Fig.5 Effect of aqueous extract of Potentillae discoloris Herba on p-AMPK protein expression
表3 翻白草水提液对GSH、MDA 水平的影响(±s,n=30)Tab.3 Effects of aqueous extract of Potentillae discoloris Herba on GSH and MDA levels(±s,n=30)

表3 翻白草水提液对GSH、MDA 水平的影响(±s,n=30)Tab.3 Effects of aqueous extract of Potentillae discoloris Herba on GSH and MDA levels(±s,n=30)
注:与对照组比较,∗P<0.05;与棕榈酸组比较,#P<0.05
GSH/MDA/组别 (μmol·L-1) (nmol·mg prot-1)对棕翻照榈白组酸草 组水 提 物+棕榈酸组211 057 819...508±±±111 001...630 393 ∗# 021...723 507±±±000...121 322∗#
3.6 BML-275 对FAS、 CPT-1、 AMPK 表 达 及GSH、MDA 水平的影响 BML-275 预处理胰岛细胞1 h 后,再加入翻白草水提液和棕榈酸共同孵育24 h,结果见表4、图6。由此可知,与翻白草水提物+棕榈酸组比较,BML-275 组CPT-1 mRNA表达、p-AMPK 蛋白表达、 GSH 水平显著降低,FAS mRNA 表 达、 MDA 水 平 显 著 升 高 (P <0.05)。
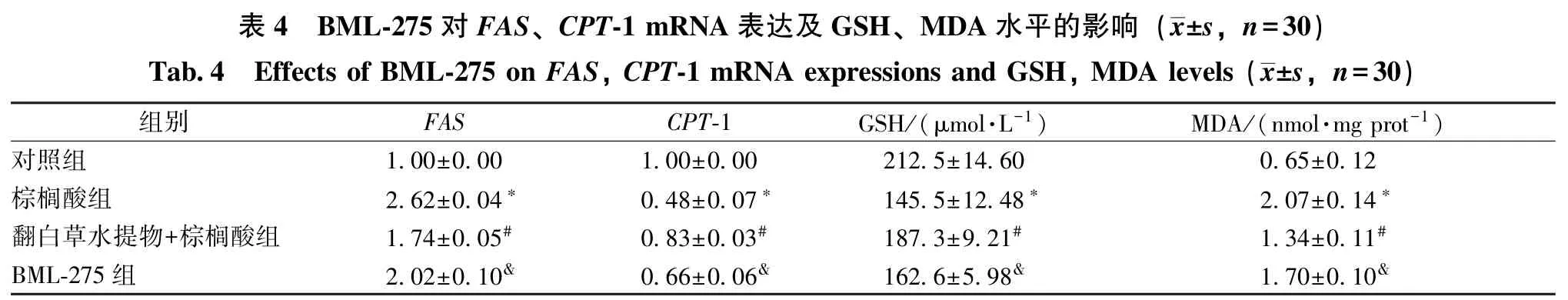
注:与对照组比较,∗P<0.05;与棕榈酸组比较,#P<0.05;与翻白草水提物+棕榈酸组比较,&P<0.05
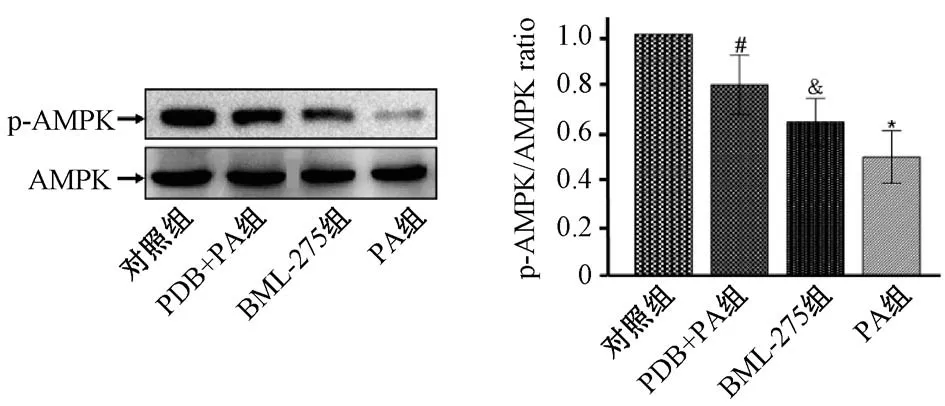
图6 BML-275 对p-AMPK 蛋白表达的影响Fig.6 Effect of BML-275 on p-AMPK protein expression
4 讨论
游离脂肪酸长期升高可使胰岛β 细胞凋亡、数量减少、功能衰竭,称为“脂性凋亡”。本实验采用胰岛原代细胞培养、FDA/PI 双染、AnnexinV/PI 双染流式定量方法,观察棕榈酸对胰岛细胞凋亡的影响,发现该成分可诱导胰岛细胞凋亡,降低细胞存活率,然后检测大鼠胰岛细胞BIS/GSIS 水平,发现它对胰岛细胞BIS 水平无显著影响,但能抑制GSIS 水平,表明它损伤了β 细胞分泌功能。GSIS 损害是2 型糖尿病早期特征之一,由于脂肪酸诱导β 细胞死亡、数量减少及其导致的胰岛素分泌功能受损,至少有一部分归因于脂毒性凋亡,故推测防止β 细胞脂性凋亡可能有益于预防或治疗T2DM。
萜类、黄酮是翻白草主要化学成分,其中后者能有效地调节糖脂代谢[6-9],但其具体降糖机制尚未阐明。韩永明等[10]报道,翻白草能有效保护胰岛β 细胞;邹志坚等[11]通过大鼠腹腔注射四氧嘧啶建立糖尿病模型,分为高、中、低3 个剂量组,连续给予黄酮提取物14 d 后发现,胸腺指数、超氧化物歧化酶活性明显上升,血清丙二醛水平明显下降,表明该成分对糖尿病大鼠有治疗作用,可能是通过提高抗氧化能力和增强免疫力来实现的;本实验发现,翻白草水提液处理后胰岛细胞凋亡率较棕榈酸明显下降,而细胞存活率、GSIS 明显升高,表明它可抑制胰岛细胞脂性凋亡,改善β 细胞已受损的分泌功能。胰岛细胞中抗氧化酶水平很低,易受氧化应激损伤,而长期暴露在高游离脂肪酸环境下可使线粒体活性氧簇生成增加,氧化应激激活,线粒体功能发生障碍,诱导细胞凋亡,从而损害β 细胞的合成与分泌功能,故氧化应激毒性是导致胰岛细胞脂性凋亡的直接原因[12]。本实验发现,棕榈酸处理后胰岛细胞内脂质过氧化产物MDA 水平明显升高,非酶性抗氧化物GSH 水平明显降低,提示游离脂肪酸的负载引起胰岛细胞氧化与抗氧化系统失衡,导致胰岛细胞氧化应激;翻白草水提液干预后可降低胰岛细胞MDA 水平,升高GSH 水平,表明它可缓解游离脂肪酸诱导的胰岛细胞氧化应激反应。
AMPK 是细胞内的能量和代谢感受器,由α、β、γ 三个亚单位构成的三聚体,前者α 亚基是AMPK 的主要催化亚基,当其(Thr172 位点) 磷酸化后可激活AMPK,从而参与调节细胞内糖、脂肪酸和能量代谢[13],而AMPK 对脂质代谢的影响是通过抑制乙酰辅酶A 羧化酶、FAS 等脂肪酶的活性抑制脂肪合成,同时增加CPT-1 活性以促进脂肪酸氧化[14]。本实验发现,棕榈酸可明显抑制胰岛细胞中p-AMPK 蛋白表达,增加其下游靶基因FAS mRNA 表达,减少CPT-1 mRNA 表达,表明它能抑制AMPK 通路激活;翻白草水提液处理后,能缓解棕榈酸对AMPK 通路的抑制作用,上调p-AMPK 蛋白表达及其靶基因CPT-1 mRNA 表达,并下调了FAS mRNA 表达,但AMPK 特异性抑制剂BML-275 则衰减了这一作用,表明翻白草水提液减轻脂毒性的作用至少有一部分依赖于其对AMPK通路的调节。
研究表明,AMPK 激活后可抑制NADPH 氧化酶的胞质内亚基p47phox、p67phox表达,从而缓解高糖诱导的血管内皮细胞的氧化应激[15],它可通过激活核因子E2 相关因子2(Nrf2)介导的抗氧化信号通路,上调肝细胞抗氧化酶(如超氧化物岐化酶,过氧化氢酶、谷胱甘肽过氧化物酶) 表达,从而减轻氧化应激反应[16];同时还能增加NADPH数量,减少NADPH 消耗,减轻成骨细胞氧化应激反应, 从而调节骨代谢平衡[17]。 本实验发现,BML-275 组胰岛细胞中MDA 水平较翻白草水提物+棕榈酸组明显升高、GSH 水平明显降低,表明AMPK 活性的抑制减缓了翻白草水提物对棕榈酸诱导胰岛细胞氧化应激反应的缓解作用。
综上所述,在脂肪酸诱导的胰岛细胞脂性损伤模型中,翻白草水提液可能通过激活AMPK 通路,抑制脂肪酸合成,促进脂肪酸β 氧化,减轻脂毒性,缓解细胞氧化应激反应,从而减轻细胞脂性凋亡,最终改善胰岛细胞结构和功能的损伤,这将为该药材及其有效成分治疗2 型糖尿病提供新的理论依据。今后,将进一步观察和探索翻白草在体内的功能和调节机制,以期更有力地证实本实验结果。

