复方脑肽节苷脂注射液对重症颅脑损伤患者治疗效果及对预后的影响
刘敏,卞玉杰,徐萍欣
(郑州市第九人民医院神经外科,河南 郑州 450053)
颅脑损伤属神经外科常见外伤性疾患,主要因高空坠落、重物砸伤、交通事故等外界暴力作用于头部而造成,重症颅脑损伤约占全部颅脑损伤20%,患者病情危重,可出现脑性肺水肿、意识障碍、头晕头痛等症状,且常伴随脑内血肿、脑挫裂伤、脑肿胀等并发症,致残与致死率均较高,预后差[1-2]。随近年来院前急救措施与急诊医疗条件不断进步,重症颅脑损伤患者病死率有所下降,但患者于康复期常会遗留神经功能损伤,如何有效提升神经康复治疗疗效、降低致残率一直为临床研究重点。复方脑肽节苷脂注射液为一种复方制剂,可加速脑组织新陈代谢,参与脑神经元生长、分化及再生,促进脑血液循环,有效减轻脑神经功能损伤[3]。此外,星形胶质源性蛋白(S100β)、降钙素基因相关肽(GFAP)、神经肽Y(NPY)等均为反映脑神经损伤的重要标志物,通过测定其表达水平可侧面评价颅脑损伤患者脑神经损伤程度,指导临床治疗及预后评价[4]。本研究选取104例重症颅脑损伤患者,分组分析复方脑肽节苷脂注射液治疗对患者血清NPY、S100β、GFAP水平及预后的影响,如下报告。
1 资料及方法
1.1 一般资料
选取2015年4月—2018年8月我院收治的重症颅脑损伤患者104例,按随机数字表法分为试验组、对照组,各52例。试验组男29例,女23例;年龄23~73岁,平均年龄(41.04±7.75)岁;受伤至入院时间3~23 h,平均时间(12.76±2.94)h;致伤原因:高处坠落12例,重物砸伤8例,交通事故32例。对照组男30例,女22例;年龄22~74岁,平均年龄(41.83±7.29)岁;受伤至入院时间3~22 h,平均时间(12.53±3.08)h;致伤原因:高处坠落14例,重物砸伤7例,交通事故31例。两组一般资料(性别、年龄、受伤至入院时间、致伤原因等)比较差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准,且符合《世界医学会赫尔辛基宣言》中有关要求。
1.2 纳入与排除标准
纳入标准:均存在明显头部外伤史,且经MRI、CT等影像学检查证实为颅脑损伤;受伤至入院时间不足24 h;无手术指征;存在意识障碍,格拉斯哥昏迷量表(GCS)评分3~8分;患者家属知晓本研究治疗方案,签订知情同意书。
排除标准:合并多发性骨折、胸腹腔出血、脊髓损伤等其他部位严重创伤者;合并肝、心、肾等重要脏器功能严重障碍者;合并凝血功能障碍、精神系统疾病、免疫系统疾病者;双侧瞳孔出现持续性散大者;对本研究应用药物过敏者。
1.3 方法
1.3.1 治疗方法对照组予以常规治疗:如抗炎、止血、利尿、脱水等,具体包括:予以5 mL/kg的20%甘露醇(四川科伦药业股份有限公司,国药准字:H20043784),30 min内静注,8 mg纳洛酮(成都天台山制药有限公司,国药准字:H20052367)+20 mL醒脑静注射液(河南天地药业股份有限公司,国药准字:Z41020665)+1 kU注射用血凝酶(瑞士Solco Basle AG.,批准文号:H20050102)+0.4 mg/kg呋塞米(广东南国药业有限公司,国药准字:H44022506),静注,qd,持续治疗4周。
试验组在常规治疗基础上予以复方脑肽节苷脂注射液(吉林步长制药有限公司,国药准字:H22026472)治疗,10 mL+250 mL氯化钠注射液,静注,qd,持续治疗4周。
1.3.2 检测方法抽取受检者5 mL清晨空腹静脉血,离心处理10 min左右(转速3 000 r/min),取血清,以酶联免疫吸附法检测血清NPY、S100β、GFAP水平,试剂盒均购自武汉博士德生物科技有限公司,相关操作均严格依据试剂盒说明书由医院专门人员执行。
1.4 观察指标
①两组治疗前、治疗4周后昏迷程度,应用GCS量表施行评估,总分3~15分,得分越高昏迷程度越轻;②两组治疗前、治疗4周后神经功能缺损程度,应用美国国立卫生研究院卒中量表(NIHSS)评价,总分0~42分,得分越高神经功能缺损程度越严重;③两组治疗前、治疗4周后认知功能,以简易精神状态评价量表(MMSE)进行评估,总分0~30分,得分越高认知功能越好;④两组治疗前、治疗4周后生活质量,以健康调查简表(SF-36)进行评定,总分0~100分,得分越高生活质量越好;⑤两组治疗前、治疗4周后血清神经损伤有关指标(NPY、S100β、GFAP)水平;⑥治疗后以入院复查、电话、邮件等形式随访3个月,采用格拉斯哥预后评分量表(GOS)评估比较两组预后情况,分值范围1~5分,分值为1分,病死判定为死亡;分值为2分,存在最小生存反应判定为植物生存;分值为3分,意识清晰,但日常生活完全需他人照料判定为重度残疾;分值为4分,神经功能轻度损伤,日常生活可部分自理判定为中度残疾;分值为5分,日常生活能力恢复正常或仅存在轻度缺陷判定为恢复良好[5]。
1.5 统计学方法
采用SPSS 23.0分析研究数据,计量资料以“±s”表示,采用t检验,计数资料以百分数(%)表示,采用卡方检验,等级资料行Ridit分析,u检验,P<0.05为差异有统计学意义。
2 结果
2.1 GCS、NIHSS评分
治疗前两组GCS、NIHSS评分比较,差异无统计学意义(P>0.05);治疗4周后两组GCS评分较治疗前提高,且试验组高于对照组,NIHSS评分较治疗前降低,且试验组低于对照组,差异有统计学意义(P<0.05)。见表1。
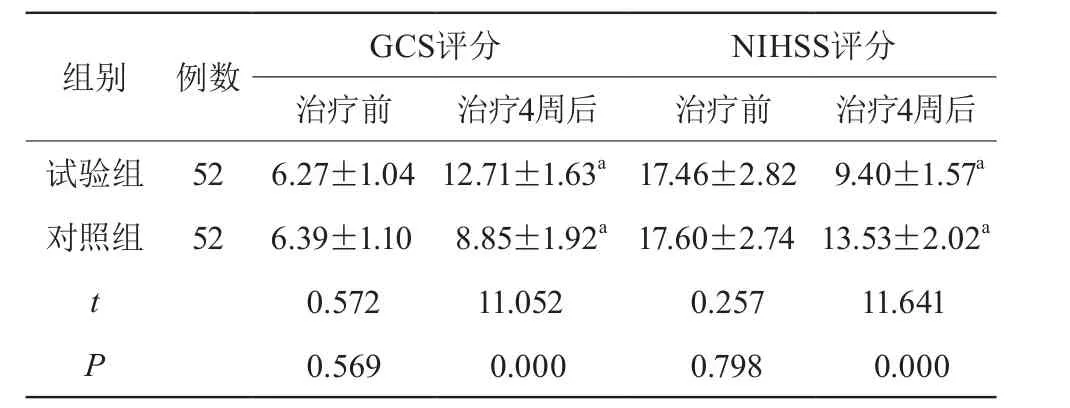
表1 两组GCS、NIHSS评分比较
2.2 MMSE、SF-36评分
治疗前两组MMSE、SF-36评分比较,差异无统计学意义(P>0.05);治疗4周后两组MMSE、SF-36评分较治疗前提高,且试验组高于对照组,差异有统计学意义(P<0.05)。见表2。
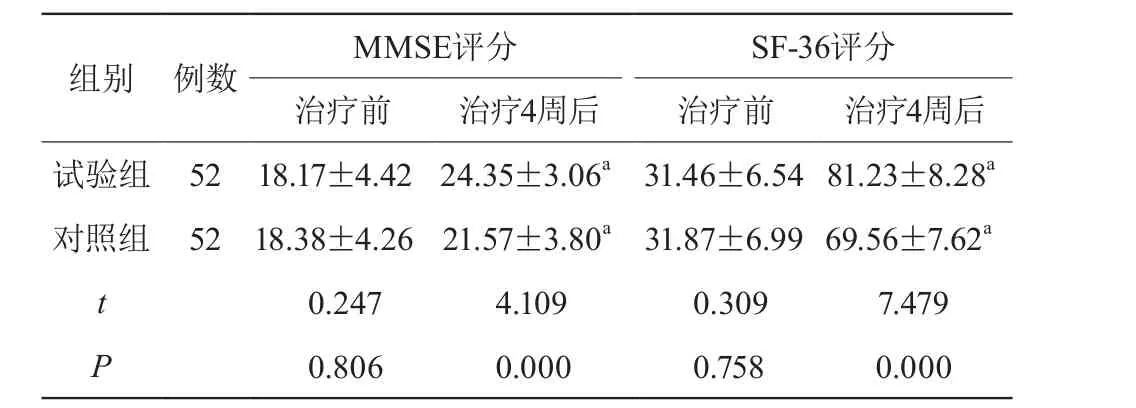
表2 两组MMSE、SF-36评分比较
2.3 血清神经损伤相关指标水平
治疗前两组血清NPY、S100β、GFAP水平比较,差异无统计学意义(P>0.05);治疗4周后两组血清NPY、S100β、GFAP水平较治疗前降低,且试验组低于对照组,差异有统计学意义(P<0.05)。见表3。
2.4 GOS预后分级情况
治疗后随访3个月,无脱落病例。试验组GOS预后分级情况较对照组良好,差异有统计学意义(P<0.05)。见表4。
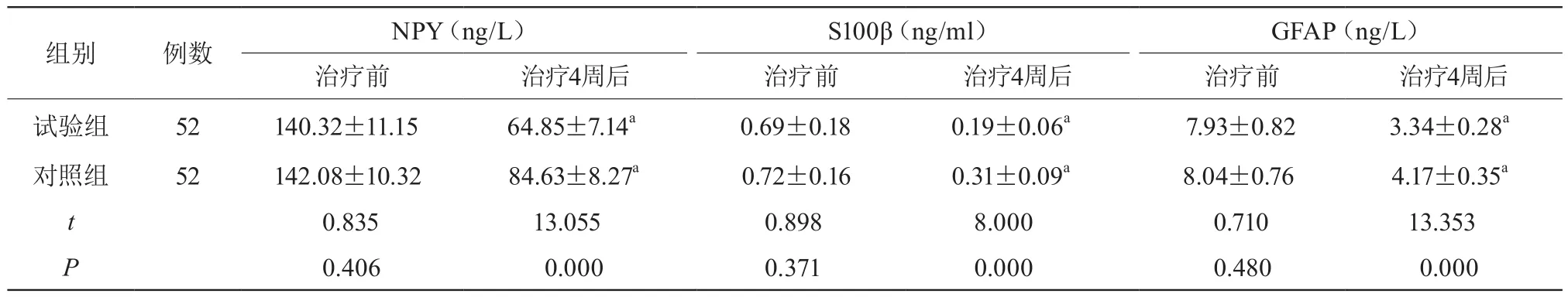
表3 两组血清神经损伤相关指标水平比较
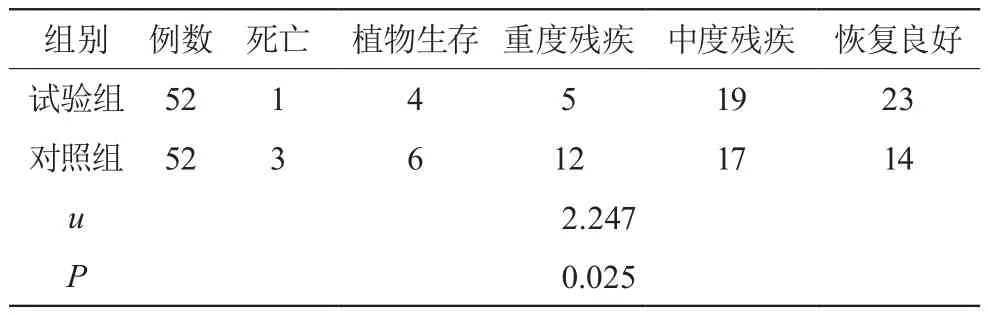
表4 两组GOS预后分级情况比较
3 讨论
临床普遍认为,治疗重症颅脑损伤关键在于加速神经功能重建及神经功能恢复。采取抗炎、止血、利尿、脱水等常规治疗虽能缓解颅内高压和毒副代谢物质对神经功能带来的持续损害,降低患者病死率,减轻临床症状,但颅脑遭受不可逆性损伤,单纯应用上述常规治疗无法彻底重建患者神经功能,故多需辅助应用其他药物以促进神经功能修复及重建[6]。
复方脑肽节苷脂注射液包含多肽、次黄嘌呤、多种神经节苷脂等成分,其中神经节苷酯为神经鞘糖脂之一,可经过血脑脊液屏障,参与上调内源性神经生长因子表达并强化其功能,促进神经分化与受损神经修复、再生,加速神经重塑,且可调节细胞膜多种酶活性度,促进细胞内外离子平衡恢复正常,保持线粒体结构的完整性,防止细胞产生水肿,改善脑局部血液循环,并能抑制氨基酸毒性,防止钙离子于细胞内聚集;同时,有研究指出,神经节苷酯还能缓解局部过氧化反应,减轻自由基损伤,调节多种炎症介质和细胞因子表达,阻止神经细胞凋亡,减轻神经功能损伤[7]。多肽、次黄嘌呤可改善脑细胞物质及能量代谢,促进受损脑细胞生理功能修复,加速神经功能恢复,最终促进神经功能修复及重建[8]。
本研究结果显示,治疗4周后试验组GCS、MMSE评分高于对照组,NIHSS评分低于对照组,治疗后3个月试验组GOS预后分级情况优于对照组(P<0.05)。表明应用复方脑肽节苷脂注射液治疗可降低昏迷与神经功能损伤程度,改善患者认知功能及GOS预后分级情况。推测原因为复方脑肽节苷脂注射液与常规药物治疗颅脑损伤的机制不同,结合使用可起到相互辅助、相互补充等协同作用,进而增强治疗效果。本研究结果显示,治疗4周后试验组SF-36评分高于对照组(P<0.05)。表明采用复方脑肽节苷脂注射液治疗可改善患者的生活质量。究其原因与应用复方脑肽节苷脂注射液治疗后患者疾病康复进程加快、身心负担减轻、生活能力提高等有关。此外,脑神经损伤血清学指标为判定颅脑损伤治疗效果及患者预后的重要依据,NPY、S100β、GFAP均为重要脑神经损伤指标,在正常生理状态下表达水平均较低,而当脑组织遭受损伤时,可通过血脑屏障侵入血液循环,导致三者表达水平显著增高,且增高幅度和脑神经损伤程度具有密切关系[9-10]。本研究结果显示,治疗4周后试验组血清NPY、S100β、GFAP水平低于对照组(P<0.05)。亦从侧面说明应用复方脑肽节苷脂注射液治疗可降低脑神经损伤程度。
综上,复方脑肽节苷脂注射液治疗重症颅脑损伤能降低昏迷与神经功能损伤程度,改善患者认知功能、生活质量及GOS预后分级情况。

