HRP标记的二抗检测heme结合蛋白造成假阳性问题的探讨
张亚男 张春晓 陈晓波
摘要:為了验证对辣根过氧化物酶(horseradish peroxidase, HRP)作为二抗标记物在检测heme结合蛋白时产生假阳性问题的推测,以菠菜细胞色素b6f复合体(Cyt b6f)和铁氧还蛋白-NADP+氧化还原酶(FNR)为检测对象(前者含有heme结合蛋白Cyt f,后者不含heme基团),采用菠菜FNR一抗、HRP和碱性磷酸酶(alkaline phosphatase,ALP)标记的二抗,设计对比实验。结果表明,在使用HRP标记的二抗体系中,Cyt f不经一抗和二抗孵育即可显色,这是明显的假阳性;而在ALP标记的二抗体系中,Cyt f条带不显色,只有FNR条带显色。在western blot实验中,如果被检测蛋白为heme结合蛋白或者混有少量heme结合蛋白,应避免采用HRP标记的二抗,建议使用ALP标记的二抗或者其他二抗产品;heme结合蛋白具有类似HRP的氧化还原酶活性,其本身可以和显色液反应,从而产生假阳性,干扰对实验结果的判断。
关键词:植物生物化学;蛋白免疫印迹杂交;辣根过氧化物酶;heme结合蛋白;假阳性
中图分类号:Q503;Q554+.6文献标志码:A
ZHANG Yanan,ZHANG Chunxiao,CHEN Xiaobo.Study on the false positive problem caused by HRP-labeled secondary antibody in detecting heme binding protein[J].Journal of Hebei University of Science and Technology,2019,40(3):273-278.Study on the false positive problem caused by HRP-labeled secondary
antibody in detecting heme binding protein
ZHANG Yanan, ZHANG Chunxiao, CHEN Xiaobo
(School of Bioscience and Boiengineering, Hebei University of Science and Technology, Shijiazhuang,Hebei 050018, China)
Abstract:In order to study the false positive problem during detecting heme binding protein with horseradish peroxidase (HRP) as secondary antibody, spinach cytochrome b6f complex (Cyt b6f) and ferredoxin-NADP+ oxidoreductase (FNR) are used as the test material (the former contains the heme binding protein Cyt f, and the latter does not contain heme group). A comparative experiment is designed through the use of the primary antibody of spinach FNR and secondary antibodies labeled with HRP and alkaline phosphatase (ALP). The results indicate that in the HRP-labeled secondary antibody system, Cyt f could be colored even without the incubation by the primary antibody and the secondary antibody, which is a significant false positive. In the ALP-labeled secondary antibody system, the Cyt f doesn't show color, and only the FNR is colored. In western blot experiments, if the protein to be detected is a heme-binding protein or contains a small amount of heme-binding protein, HRP-labeled secondary antibodies should be avoided and ALP-labeled secondary antibodies or other secondary antibodies should be recommended. It is speculated that the heme-binding protein has an HRP-like oxidoreductase activity, namely it can react with the color developing solution, thereby generating a false positive and interfering with the judgment of the experimental results.
Keywords:plant biochemistry; western blot; horseradish peroxidase; heme binding protein; false positive
蛋白质印迹或免疫印迹(western blot, WB)技术是利用抗原抗体杂交原理定性或定量检测蛋白质的一种手段[1-2]。实验室常用的WB操作流程是通过SDS-PAGE将样品蛋白质分离,再将其转移到固相载体上,一般多采用PVDF膜、尼龙膜或NC膜作为固相载体,然后把固相载体上的蛋白质或多肽作为抗原,与其对应的第一抗体(一抗)发生免疫杂交反应,特异性一抗再与和灵敏检测系统相偶联的第二抗体(二抗)反应,最终检测到能够和一抗特异结合的目的蛋白[3]。WB技术拥有电泳高分辨率和酶免疫测定的高敏感性及特异性,在分子生物学、生物化学、免疫遗传学等研究领域得到了非常广泛的应用[4-5]。
WB检测蛋白的高敏感性和特异性除了和特异性抗体有关外,还和用于检测的二级抗体的标记物有关。一般来讲,偶联到二抗上的标记物(有时也叫探针)有酶(主要包括辣根过氧化酶(horseradish peroxidase,HRP)和碱性磷酸酶(alkaline phosphatase,ALP)或其衍生物(APAAP,PAP))、荧光基团(FITC,Rhodamine,Texas Red,PE,Rhodamine,Dylight等)、生物素、金颗粒等[6]。不同WB类型实验需要使用不同的二抗标记物,但就一般实验室来讲,酶(主要是HRP和ALP)标记的二抗的使用最为广泛,因为相对于其他标记方式,酶标记的二抗成本低廉,操作简单方便,对检测设备要求也低[3]。HRP的显色原理是利用其过氧化物酶的活性,催化反应需要底物过氧化氢(H2O2)和供氢体(DH2)。实验中常用的供氢体有DAB(3,3二氨基联苯胺)、鲁米诺(luminol,5-氨基-2,3-二氢-1,4-酞嗪二)等。这些物质大多数是没有颜色的还原性染料,可以被氧化成有颜色的氧化型的染料(D)或者通过发光来检测活性[7-8]。ALP的显色机理则是利用其水解酶的活性,当ALP处于pH值为9.4的碱性环境时,在镁离子激活下,β-甘油磷酸钠水解得到磷酸,磷酸与高浓度的钙盐结合形成无色的磷酸钙,再进一步与硝酸钴发生反应形成磷酸钴,最后经硫化胺处理形成黑色的硫化钴沉淀在酶活性的位置[9]。HRP和ALP对于二抗的敏感度相同,但由于HRP成本更低,并且产生的颜色比较明显,方便观察分析,因而HRP标记的二抗更受科研人员的青睐。
河北科技大学学报2019年第3期张亚男,等:HRP标记的二抗检测heme结合蛋白造成假阳性问题的探讨WB实验虽然已经非常成熟了,但由于其步骤较多、涉及试剂的种类令人眼花缭乱,而检测的蛋白又各种各样,因而研究者在实验中经常会因遇到这样或那样的问题而苦恼。多数科研人员进行此项实验时要么参考某篇文献,要么沿用本实验室固有的方法,基本上是拿来就用,出了问题再找原因,对实验细节考虑不周,如二抗试剂与被检测蛋白之间的匹配问题。本研究使用铁氧还蛋白-NADP+氧化还原酶(FNR)的一抗、HRP标记的二抗,检测细胞色素b6f(Cyt b6f)中是否含有FNR时,发现在与Cyt b6f的亚基Cyt f(一种heme结合蛋白)几乎完全重合的位置上出现了显著的阳性条带,怀疑此条带是假阳性。为了排除疑虑,以Cyt b6f和FNR为待检样品,使用HRP和ALP标记的2种二抗,设计了对比实验,最终的实验结果证实了猜测,并解释了HRP标记的二抗检测heme结合蛋白产生假阳性的原因。目前鲜有专门针对此方面的报道,相信本研究结果会给遇到类似问题的相关人员提供有益的参考和借鉴。
1材料和方法
1.1蛋白样品的制备
菠菜类囊体膜制备参考文献\[10\],Cyt b6f粗样品提取参照文献\[11—13\]。此样品混有少量的FNR,经过一次分子筛或蔗糖密度梯度离心进一步纯化,可去除FNR,得到纯的Cyt b6f。在Cyt b6f粗样品的基础上制备FNR样品。基本步骤如下:将-20 ℃的纯丙酮800 μL加入至200 μL Cyt b6f粗制品(蛋白质量浓度约为20 mg/mL)中,混匀后于冰上静置5 min,8 000g离心5 min,去除上清液,将沉淀用-20 ℃的纯丙酮再次悬浮处理,离心得到的沉淀悬浮于1 mL TS(50 mmol/L Tris, pH值为7.5,50 mmol/L NaCl)缓冲液中,9 000g 离心5 min,去掉不溶物,收集上清液,转移到10 kD超滤管中,于5 000g离心浓缩至100 μL,即为FNR粗制品。
1.2WB实验步骤
SDS-PAGE的制备参照文献\[14\],略作修改。分离胶浓度为15%(质量分数,下同),浓缩胶浓度为4%,将蛋白样品加入到等体积的溶液(50 mmol/L Tris-HCl, pH值为8.0,4 mol/L尿素,2% SDS,5%乙醇,2.5%巯基乙醇)中,于90 ℃处理2 min,然后上样。Western blot完整流程参照文献\[15\](半干式),略有修改,基本步骤如下:将凝胶玻璃板从电泳槽中取下,切去不用的部分,剪裁成和凝胶尺寸一样大小的PVDF固相膜,放入电转移液(240 mL H2O,60 mL 甲醇,0.5 g H3BO3,1.8 mL 10% SDS)中浸泡;剪裁12张比凝胶尺寸略大的滤纸,放入转移缓冲液中泡透;按阴极→滤纸(6张)→凝胶→转移膜→滤纸(6张)→阳极的顺序放置在转膜仪上,赶压气泡;接通电源,选择恒压(CV)模式,11 V,50~60 min,电流为70~90 mA。转膜结束,可用0.1%的丽春红检测转膜效果,然后用TBST(Tris-Buffered Saline Tween-20,配置方法為将8 g NaCl和2.42 g的Tris base加入800 mL水中溶解,再加入500~1 000 μL的Tween-20,用HCl调节pH值至7.4,加水定容至1 L)溶液洗至无色。然后用TBST配置的5%脱脂奶粉封闭液于摇床上封闭1 h,封闭完毕,用TBST洗膜2次,5 min/次。1∶4 000 TBST稀释的一抗溶液,孵育 1 h,TBST洗膜2次,5 min/次; TBST稀释5 000倍的二抗溶液,孵育1 h,TBST洗2次,5 min/次,然后加入显色液进行显色。
1.3TMBZ/H2O2染色鉴定Cyt f过氧化物酶活性
TMBZ/H2O2染色鉴定过氧化物酶活性的方法参照文献\[16\]。染色液配制如下:将3份新配制的TMBZ甲醇溶液(6.3 mmol/L)和7份乙酸钠溶液 (0.25 mmol/L,pH值为5.0) 混合。将WB显色后的杂交膜浸没在染色液中,于25 ℃黑暗温育1 h后,加入H2O2到染色液中,使H2O2的最终浓度达到30 mmol/L。大约3 min后,结合heme的Cyt f的蓝色条带就会显现。
1.4主要试剂
菠菜FNR一抗,购自荷兰Agrisera公司,从兔血清中制备;HRP和ALP标记的二抗(羊抗兔),购自圣克鲁斯(上海)生物技术公司(Santa Cruz)。
2实验结果与讨论
2.1实验结果
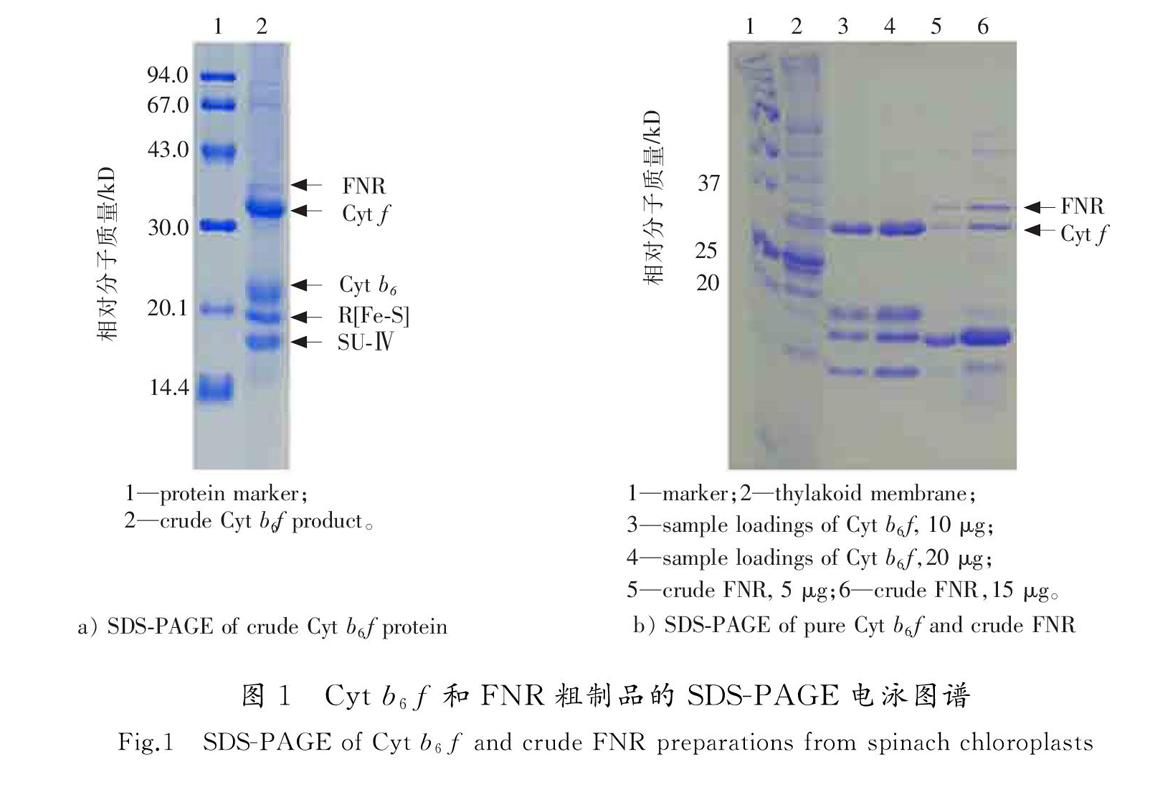
Cyt b6f是植物叶绿体类囊体膜上一个重要的膜蛋白复合物,介于光系统1和光系统2之间,参与光合作用电子传递链的组成。一般认为,Cyt b6f由4个大亚基和4个小亚基组成,其中大亚基Cyt f 结合一个c-型的heme基团[17]。图1 a)是提取的Cyt b6f粗制品的SDS-PAGE图谱,分子质量从大到小依次为Cyt f,Cyt b6,Reisk[Fe-S]蛋白和亚基Ⅳ,对应的相对分子质量分别为33,23,20和17 kD,与文献报道一致[12,15,18]。Cyt f上面的一条浅带是FNR,相对分子质量约为35 kD[15,19]。Cyt b6f粗制品经过分子筛或蔗糖密度梯度離心之后,残留的FNR完全被去除,得到进一步纯化的Cyt b6f样品(见图1 b)中的3和4)。图1Cyt b6f和FNR粗制品的SDS-PAGE电泳图谱
Fig.1SDS-PAGE of Cyt b6f and crude FNR preparations from spinach chloroplasts
以Cyt b6f粗制品为基础,进行2次丙酮沉淀,可以有效去除Cyt b6和亚基4等蛋白亚基,经过超滤浓缩,使FNR进行适当的纯化和浓缩,得到FNR的粗制品(见图1 b)中的5和6)。
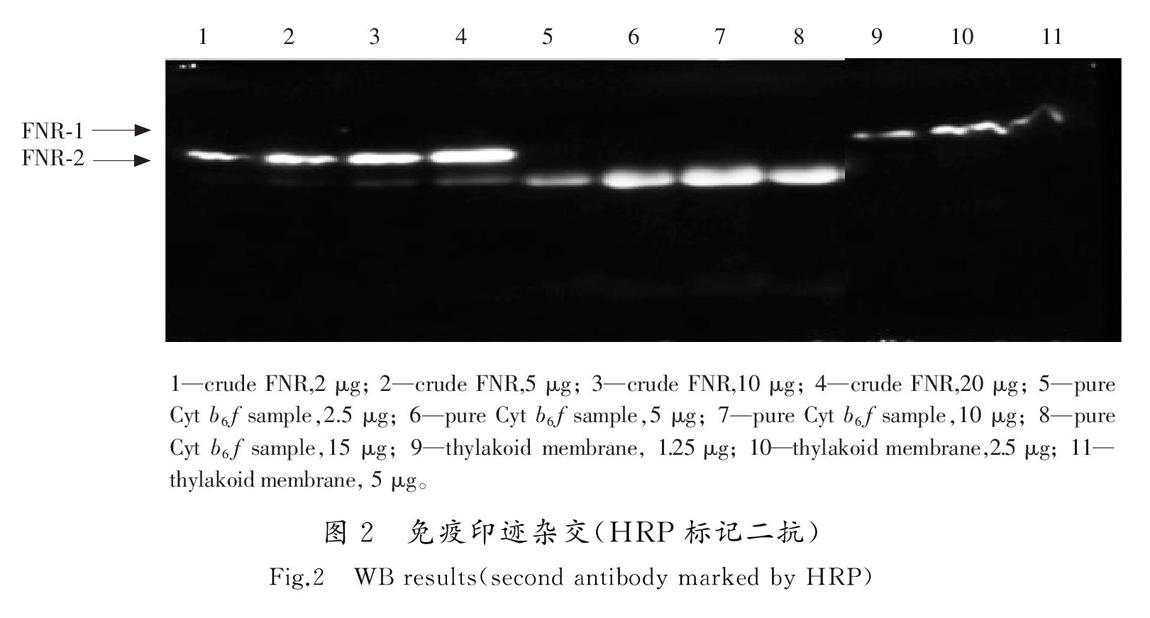
采用菠菜FNR的一抗、HRP标记的二抗,以类囊体膜、不同浓度的FNR样品和Cyt b6f样品为检测对象,结果如图2所示。FNR粗制品中,被鉴定出FNR(记作FNR-1),Cyt b6f纯制品中也被鉴定出FNR(记作FNR-2),但是这一位置与Cyt f条带几乎重合。因为这2个样品都是从类囊体膜中制备的,所以理论上类囊体膜中应该显示FNR-1和FNR-2两条带,但是结果类囊体膜中只显示一条FNR条带,并且这一条带的位置对应于FNR-1的位置,与粗制品中FNR的位置一致。当然,也可能是类囊体膜中FNR-2含量少于FNR-1,所以导致类囊体膜中的FNR-2没有被检测出来。再者,随着FNR粗样品上样浓度的增加(见图2中的1—4),与Cyt f位置重合的FNR-2条带也逐渐显现。依据图1 b)的电泳图谱可知,FNR样品中FNR和Cyt f浓度相当,一般情况下,这2条带亮度也应该相当。总之,上述结果使人怀疑FNR-2条带可能是假阳性。有文献报道,heme结合蛋白具有和HRP相似的过氧化物酶的活性[18-19]。在本实验条件下FNR-2显色的条带,不能排除是Cyt f直接和显色液反应的结果。
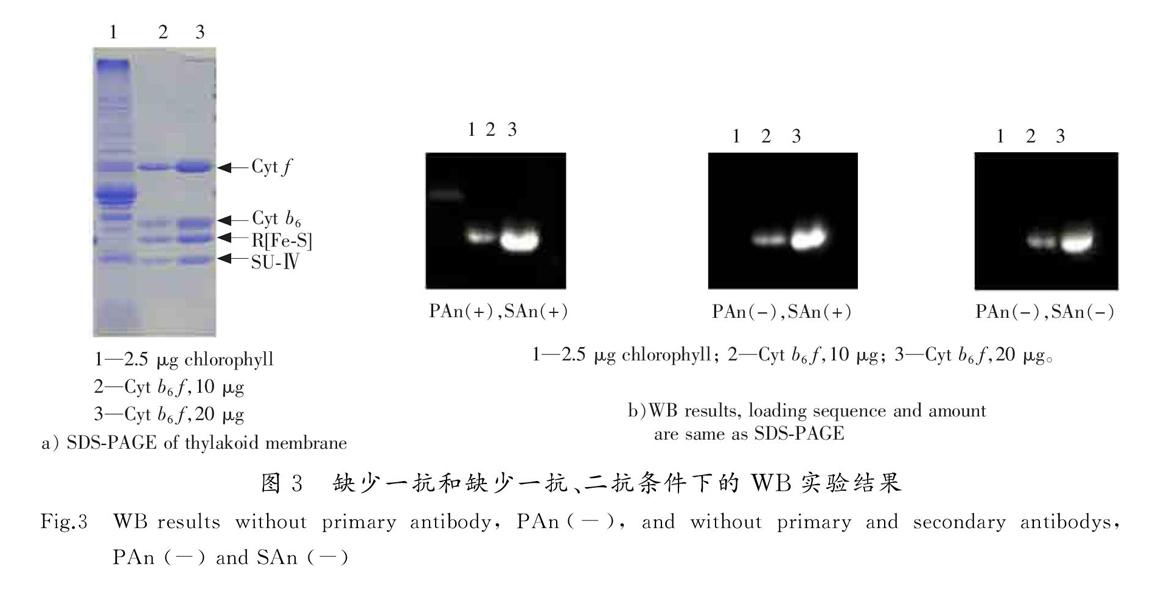
为了验证上述想法,在对Cyt b6f进行蛋白杂交实验时,设置了2个条件:一是不加一抗,二是同时不加一抗和二抗,研究在上述条件下,是否依然能够检测出FNR条带。实验结果表明,不加一抗,甚至一抗和二抗都不加,FNR-2位置的条带都可以显色,并且随上样浓度的增加显色显著增加。显然,FNR-2这一条带是假阳性,根据HRP显色的机理,产生这一假阳性的原因是经过电泳、转膜之后,Cyt f仍然具有一定的过氧化物酶活性,自身可以直接和显色液反应。实验结果如图3所示。
改用ALP标记的二抗检测类囊体膜、FNR粗制品和Cyt b6f纯制品,见图4。实验结果显示,对照条件下(即孵育一抗和二抗条件),类囊体膜和FNR粗制品中都检测到了FNR-1,而在Cyt b6f纯样品中不仅没有检测到FNR-1,也没有检测到FNR-2(见图4 b)中的Ⅰ),而在没有孵育一抗和同时不孵育一抗和二抗的条件下,类囊体膜、FNR粗制品均检测不出FNR,当然Cyt b6f样品中也检测不出FNR(见图4 b)中的Ⅱ和Ⅲ),这一结果和预期完全相符。最后,在杂交显色之后的膜上,用TMBZ/H2O2染色法检测了Cyt f的过氧化物酶活性,该方法也是利用Cyt f的氧化还原特性把无色的TMBZ氧化成了蓝色物质,因此在本实验中可以特异性检测Cyt f。图4 b)(Ⅳ,Ⅴ和Ⅵ)结果所示,分子质量略小于FNR-1的条带即为Cyt f,经比对与所谓的FNR-2条带完全重合。这一结果进一步证明了FNR-2条带为Cyt f所产生的假阳性条带,其产生的原因是选择了不合适的HRP标记的二抗。
2讨论
WB技术是目前进行蛋白质表达分析研究中应用最多的一项技术,是将传统高分辨率的SDS-PAGE电泳和灵敏度高、特异性强的免疫探测技术相结合,最有效地分析目的蛋白的表达,在分子生物学中发挥着重要作用[20]。WB的高灵敏度和二抗的标记物关系密切,特别是HRP标记物,其灵敏度甚至可以检测pg水平含量的目的蛋白,因此HRP标记的二抗在WB研究中的应用十分广泛。但是,高的灵敏度往往会产生假阳性问题,WB中产生假阳性现象的原因多种多样。在本研究中,笔者针对HRP显色机理(即利用其氧化还原酶特性,使无色的底物氧化为有色的产物),探讨了WB实验中不恰当使用二抗标记物产生的假阳性问题。本研究中的heme结合蛋白Cyt f,其经过电泳前的变性处理、SDS-PAGE和转膜之后,依然保留一定的过氧化物酶活性[13,18],本身就可以和显色液反应,从而产生显著的假阳性条带,干扰对结果的判断。例如,有文献研究报道,菠菜中提取的Cyt b6f粗制品中,WB检测出现2条FNR条带,位置和本研究中的FNR-1和FNR-2相对应[19]。根据本研究结果,这很可能是由于HRP标记的二抗导致实验结果出现了假阳性,令研究人员作出了错误的判断。
为了减少WB实验中的假阳性,某些情况下,需要考虑选择何种标记物偶联的二抗。有的研究者运用WB技术检测蛋白磷酸化情况时,往往推荐使用HRP标记的二抗,而避免使用ALP标记的二抗。这是因为ALP对磷酸酯的水解作用会使被检测的磷酸化蛋白发生变化,影响实验结果。本研究则表明,如果被检测蛋白为heme结合蛋白或者混有少量heme结合蛋白,应避免采用HRP标记的二抗,使用ALP标记的二抗或者其他二抗产品。
需要说明的是,heme有a,b,c共3种类型,Cyt f结合的heme属于c型,本研究没有检测结合a型或b型的蛋白是否也会产生假阳性结果。但是根据文献报道,结合heme基团的蛋白均会表现出一定的过氧化物酶活性[18]。在接下来的工作中,将验证结合a型和b型heme的蛋白是否也会产生假阳性。另外,还需要注意的是,不仅仅是heme结合蛋白,其他一些类型的氧化还原酶,比如结合铜离子的氧化还原蛋白,在SDS-PAGE之后仍然表现出一定的氧化还原酶活性[21]。在运用WB技术检测、分析这类蛋白时,如果使用HRP标记的二抗,很可能也会产生假阳性,影响对实验结果的判断。因此,仍需要对这类氧化还原酶进行进一步验证,以便为相关研究人员提供更有价值的参考和借鉴。
参考文献/References:
[1] 田鲲,彭敏,陈宇,等.免疫组化、明胶酶谱、Western Blot检测涎腺肿瘤中基质金属蛋白酶 MMP-2、MMP-9表达的比较与评价[J].实用医院临床杂志,2010,7(5):17-21.
TIAN Kun, PENG Min, CHEN Yu, et al. Detection of the expression of MMP-2 and MMP-9 by immunohistochemistry, gelatin zymography and Western Blot analysis ins alivary gland tumors [J].Practical Journal of Clinical Medicine,2010, 7(5): 17-21.
[2]NIEWIADOMSKA E,POLZIEN L,DESEL C,et al. Spatial patterns of senescence and development-dependent distribution of reactive oxygen species in tobacco (Nicotiana tabacum) leaves[J]. Journal of Plant Physiology, 2009, 166(10): 1057-1068.
[3] 張燕婉,叶珏,时那,等.蛋白质免疫印迹技术的实验研究[J].实验技术与管理,2008,25(10):35-37.
ZHANG Yanwan, YE Jue, SHI Na, et al. Experimental research on protein immunoblot assay[J]. Experimental Technology and Management, 2008, 25(10): 35-37.
[4] 温博贵.蛋白质印迹法[J].生理科学进展,1987,18(4):328-331.
[5] 王维,郎明林,杨学举.小麦转基因技术及转化功能基因研究进展[J].中国农学通报,2012,28(18):1-6.
WANG Wei, LANG Minglin, YANG Xueju. Advances of wheat transgenic techniques and its transferred functional genes [J]. Chinese Agricultural Science Bulletin, 2012, 28(18): 1-6.
[6] 刘奇,尹磊淼,魏颖,等.蛋白质磷酸化检测方法及原理[J].中国医药生物技术,2013,8(2):134-138.
[7] 郭春祥,郭锡琼.介绍一种简单、快速、高效的辣根过氧化物酶标记抗体的过碘酸钠法[J].上海免疫学杂志,1983,3(2):97-100.
[8] 张维敏.普鲁士蓝纳米粒子过氧化物模拟酶及其在过氧化氢和葡萄糖检测中的应用研究[D].西安:陕西师范大学,2013.
ZHANG Weimin. Prussian Blue Nanoparticles as Peroxidase Mimetic for Colorimetric Detection of H2O2 and Glucose[D]. Xian: Shaanxi Normal University, 2013.
[9] 陈熙,陈锦,张慧妍,等.阵列纸芯片比色法检测碱性磷酸酶[J]. 分析化学,2016,44 (4): 591-596.
CHEN Xi,CHEN Jin,ZHANG Huiyan,et al.Colorimetic detection of alkaline phosphatase on microfluidic paper-based analysis devices[J].Chinese Journal of Analytical Chemistry,2016,44 (4): 591-596.
[10]闫久胜.细胞色素b6f蛋白复合体的结构与功能:色素的结构与功能及膜脂的作用[D].北京:中国科学院植物研究所,2000.
YAN Jiusheng. Structure and Function of Pigments and Effects of Membrane Lipids in Cytochrome b6f Complex[D]. Beijing: Institute of Botany, Chinese Academy of Sciences, 2000.
[11]陈晓波. 细胞色素b6f蛋白复合体中叶绿素a的性质和功能研究[D]. 北京: 中国科学院植物研究所,2006.
CHEN Xiaobo.Characterization and Function of Chlorophyll a in Cytochrome b6f from Spinach[D]. Beijing: Institute of Botany, Chinese Academy of Sciences, 2006.
[13]CHEN X B, ZHAO X, ZHANG J P, et al. The effects of detergents DDM and β-OG on the singlet excited state lifetime of the chlorophyll a in cytochrome b6f complex from spinach chloroplasts[J]. Science China Ser C-Life Science, 2007, 50(4): 505-510.
[14]LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of acteriophage T4[J]. Nature, 1970, 227(5259): 680-685.
[15]ZHANG H, WHITELEGGE J P,CRAMER W A. Ferredoxin: NADP+ oxidoreductase is a subunit of the chloroplast cytochrome b6f Complex[J].Journal of Biological Chemistry,2001, 276(41): 38159-38165.
[16]THOMAS P E, RYAN D, LEVIN W. An improved staining procedure for the detection of the peroxidase activity of cytochrome p-450 on sodium dodecyl sulfate polyacylamide gels[J]. Analytical Biochemistry, 1976, 75(1): 168-176.
[17]AGARWAL R, HASAN S, JONES L M, et al. Role of domain swapping in the hetero-oligomeric cytochrome b6f lipoprotein complex[J]. Biochemistry, 2015, 54(20): 3151-3163.
[18]CHEN X B, HOU C, LI L B, et al. The peroxidase activity of cytochrome b6f complex from spinach chloroplasts[J]. Photosynthetica, 2010, 48(1): 3-8.
[19]SZYMANSKA R, DLUZEWSKA J, SLESAK I, et al. Ferredoxin: NADP+ oxidoreductase bound to cytochrome b6f complex is active in plastoquinone reduction: Implications for cyclic electron transport[J]. Physiologia Plantarum, 2011, 141(3): 289-298.
[20]侯維海,王建林,旦巴,等.西藏白菜型油菜油体特征与营养品质及油体提取物的SDS-PAGE分析[J].西北农林科技大学学报(自然科学版),2018,46(10):68-78.
HOU Weihai, WANG Jianlin, DAN Ba, et al. Oil body characteristics,nutritional quality and SDS-PAGE analysis of oil body extracts of Brassica campestris form Tibet [J]. Journal of Northwest A & F University (Natural Science Edition), 2018, 46(10): 68-78.
[21]MILLER D,NICHOLAS D J D. 3,3,5,5-tetramethylbenzidine/H2O2 staining is not specific for heme proteins separated by gel electrophoresis[J]. Analytical Biochemistry, 1984, 140 (2): 577-580. 第40卷第3期河北科技大学学报Vol.40,No.3
2019年6月Journal of Hebei University of Science and TechnologyJune 2019

