拉巴乌头碱分子印迹微球的制备及其吸附性能
张丽,缑浩,刘海霞,郑艳萍,赵国虎
(兰州城市学院化学化工学院,甘肃 兰州 730070)
拉巴乌头碱(Lappaconine),又叫高乌甲素、刺乌头碱,是从高乌头根中分离得到的二萜类生物碱,常用作镇痛药,有较强的镇痛作用[1],是普通镇痛药氨基比林的7倍,镇痛效果与杜冷丁相当,但镇痛效果维持时间更长,无成瘾性,无致畸作用,也不会发生积蓄中毒,对患者肝肾功能,造血功能无影响,另外还有局部麻酔,降温和消肿作用[2].拉巴乌头碱常从高乌头根中分离得到,高乌头(AconitumsinomontanumNakai)为毛茛科乌头属植物,是我国的特有植物,其根有毒、可药用,可消肿、止痛、祛风和活血散瘀[3].目前从高乌头根中分离提取拉巴乌头碱仍然是一项相对繁琐耗时的工作,找到一种高效低成本的分离方法已成为人们研究的焦点[4].
分子印迹就是仿照抗原-抗体的形成机理,在印迹分子周围形成高交联的刚性高分子,除去印迹分子后在聚合物的网络结构中留下具有结合能力的反应基团,对模板分子表现出高度的选择识别能力[5].近年来,由于合成药物的毒副作用使人们日益青睐天然药物和中药药材.但是中草药成分复杂,各种成分含量悬殊,且许多有效成分是微量的,因此从中分离纯化有效成分是一项费时费力的工作.而分子印迹的强特异性和高选择性可以将一些含量很低的有效成分直接从粗提物中筛选出来,该技术在中药活性成分分离上具有较好的开发利用前景.贺湘凌等[6]采用环糊精分子印迹聚合物分离纯化了银杏黄酮、葛根黄酮等;Theodoridis等[7]以芦丁和槲皮素为模板分子,通过非共价方法制备了可选择性吸附这2种类黄酮类化合物的MIP,并从红酒、白酒、橙汁和茶中富集类黄酮组分.非瑟酮是中药黄栌的主要组成成分,属于天然类黄酮物质,具有抗炎、抗菌作用.李礼等[8]以非瑟酮为模板分子,丙烯酰胺为功能单体,乙二醇二甲基丙烯酸酯为交联剂,制备了非瑟酮MIP,研究了非瑟酮在该SPE柱上的保留行为,并优化了分离条件,使非瑟酮和槲皮素类似物成功地被分离.Lai等[9]以苦参碱为模板通过悬浮聚合法合成了球状聚合物,萃取了中药苦参碱中的苦参碱和氧化苦参碱;Dong等[10]采用类似的聚合方法,合成了麻黄碱分子印迹聚合物,用于固相萃取筛选出了草药麻黄草中的L-麻黄碱.
分子印迹制备技术(MIT)作为中药活性成分提取的一种新技术[11-13],其最大特点是用已知的化合物为印迹分子,合成化合物的印迹聚合物[14-15],对中药提取液进行高通量筛选.本论文首次以拉巴乌头碱为模板分子,采用本体聚合法制备印迹聚合物[16-18],研究不同功能单体和致孔剂(溶剂)对拉巴乌头碱分子印迹聚合物分子识别能力的影响,为拉巴乌头碱印迹聚合物合成时正确选择功能单体、分散溶剂及交联剂提供理论依据.
1 材料与方法
1.1 试剂与仪器
拉巴乌头碱(LA,实验室自提);甲基丙烯酸(MAA,阿拉丁海天公司);丙烯酰胺(C3H5NO,阿拉丁海天公司);乙二醇二甲基丙烯酸(EDMA,阿拉丁海天公司);偶氮异丁腈(AIBN,阿拉丁海天公司);乙腈(分析纯,天津市凯信化学有限公司);甲苯(分析纯,北京化工厂);恒温水浴锅(DF-101S);紫外分光光度计(UV-2250,日本岛津公司);电子天平(BSA124S);KQ-500E型台式机械超声波清洗器.
1.2 分子印迹聚合微球的制备
称取2 mg拉巴乌头碱,分别将其溶于5 mL丙酮、乙腈、甲醇和甲苯/乙腈(9∶1,V/V)4种溶剂中,对其溶解速度进行观察.
将58.464 0 mg的拉巴乌头碱,10 mL乙腈,0.4 mmol功能单体甲基丙烯酸(MAA)加入50 mL圆底烧瓶中,于室温下超声振荡30 min,使拉巴乌头碱与MAA充分反应,再依次加入交联剂EDMA 2 mmol和引发剂AIBN 15 mg,振荡混合均匀后,对50 mL圆底烧瓶中的混合液充氮气5~10 min,进行去氧操作后盖上磨口玻璃塞,用封口膜密封,将圆底烧瓶置于60 ℃恒温水浴锅中进行反应,反应16 h后,观察聚合是否完全,聚合完全会形成白色粉末固体.将聚合物取出冷却至室温,将其研碎,过45 μm金属湿筛;将湿筛上的分子印迹聚合微球用滤纸包裹,置于甲醇/冰醋酸(80∶20,V/V)溶液中,进行2 h超声振荡;然后将滤纸包置于索氏提取器中,用甲醇/冰醋酸(80∶20,V/V)溶液洗脱模板分子和未聚合的功能单体及交联剂,洗脱24 h,至洗脱液中检测不到模板分子,再用纯甲醇洗脱5 h,洗去冰醋酸;于真空干燥箱中50 ℃烘干,得到印迹分子MIP聚合物.按同样的方法不加模板分子制取其空白对照聚合物非印迹分子NIP.改变功能单体,重复上述制备过程,改变溶剂分别用甲苯/乙腈(1∶1、2∶8,V/V)替换,制取得到不同的MIP及NIP聚合物.
该反应机理如图1所示,在某种适当的溶剂(致孔剂)中,拉巴乌头碱(模板分子)为生物碱,分子中含有2个羟基,3个甲氧基,1个酰胺,1个酯基,1个N桥环可分别作为氢键的供氢基团及受氢基团,与甲基丙烯酸(功能单体,或者丙烯酰胺)依靠2者之间的多重氢键的非共价键的相互作用,在拉巴乌头碱分子周围形成单体-模板分子复合物,在交联剂EDMA作用下,通过AIBN(引发剂)引发进行热聚合,使单体-模板分子复合物与交联剂在致孔剂的存在下,在模板分子周围形成高联的刚性拉巴乌头碱聚合物,将甲基丙烯酸的功能基团在模板分子上固定在特定位置,最后将聚合物中的模板分子洗脱出来.经过以上步骤,聚合物中出现大小、形态以及分子识别位点与模板分子匹配的印迹空穴,此空穴将对模板分子及其类似物具有特异性识别[19].

图1 拉巴乌头碱分子聚合微球制备过程Figure 1 The structure of preparation of Lappaconine molecularly imprinted polymer microspheres
1.3 吸附性能测定
1.3.1 拉巴乌头碱最大紫外吸收峰测定 将配制的0.1 mmol/L的拉巴乌头碱溶液进行紫外波长扫描,得其紫外吸收曲线(图2),测定其紫外最大吸收峰,最大吸收波长分别为308、 252、 212 nm.

图2 拉巴乌头碱的紫外吸收曲线Figure 2 Ultraviolet absorption curve of Lappaconine
1.3.2 标准曲线的绘制 准确称取46.8 mg的拉巴乌头碱,用甲醇溶解后将其定容至100 mL容量瓶中,得到0.8 mmol/L的拉巴乌头碱标准液,再用半倍稀释法配制0.05、0.1、0.2、0.4、0.8 mmol/L梯度的标准溶液,用紫外分光光度计在拉巴乌头碱的最大吸收波长为308 nm测0.05、0.1、0.2、0.4、0.8 mmol/L浓度下标准溶液的吸光度,绘制拉巴乌头碱溶液浓度与其吸光度的工作曲线,并进行线性回归处理[20].因在紫外吸收波长为308 nm时,线性关系较好,故所有吸附性能在308 nm下测定.以拉巴乌头碱溶液吸光度A对其浓度C进行线性回归得回归方程(图3).
1.3.3 聚合物吸附性能的测定 将25 mg拉巴乌头碱分子印迹聚合微球加入10 mL具塞试管中,加入0.1 mmol/L的拉巴乌头碱甲醇溶液,室温振荡24 h,取上清液过滤,在308 nm波长下测其吸光度,根据标准曲线计算其吸附后浓度,根据吸附前后溶液中拉巴乌头碱浓度变化计算聚合微球的吸附量,如下式:

图3 拉巴乌头碱溶液标准曲线Figure 3 Standard curve of Lappaconine
Q=2.14×(C0-Ce)×V/m
式中,Q为聚合微球吸附量(μmol/g);C0为吸附前溶液中拉巴乌头碱的浓度(mmol/L);Ce为吸附后溶液中拉巴乌头碱的浓度(mmol/L);m为称取的分子印迹聚合物的质量(g);V为振荡的拉巴乌头碱溶液体积(L).
1.3.4 MIP与NIP等温吸附测定 准确称取MIP和NIP聚合物5份,每份20 mg,置于10 mL具塞试管,分别加入0.1、0.2、0.4、0.5、0.6 mmol/L拉巴乌头碱分子甲醇溶液10 mL,于室温振荡24 h后取上清液过滤,进行紫外测定,以结合前后溶液中拉巴乌头碱的浓度变化计算分子印迹微球对拉巴乌头碱的结合量.
1.3.5 分子印迹聚合物的选择 分别称取2份MIP和NIP聚合物,每份25 mg,放入10 mL具塞比色管中,分别加入0.1 mmol/L拉巴乌头碱甲醇溶液10 mL和0.1 mmol/L的β-谷甾醇甲醇溶液10 mL密封,于室温下振荡 24 h,使印迹聚合物微球充分吸附溶液中目标分子.取出后过滤,进行紫外测定,根据结合前后溶液中拉巴乌头碱的浓度变化计算分子印迹微球对目标底物的结合量.
2 结果与分析
2.1 溶剂的选择
因拉巴乌头碱为生物碱分子,极性大,呈弱碱性,不易溶于常见的有机溶剂,需测试好溶解性.统一溶剂量为5 mL,溶解模板分子2 mg,所以根据溶解速度快慢来确定选取何种溶剂作致孔剂.反应溶剂对印迹聚合物的吸附特性具有很重要的作用[21],首先,作为溶剂,能够使模板分子与功能单体进入1个均相体系,利于二者形成较稳定的复合物;其次是作为致孔剂,可以使印迹聚合物中具有一定的孔结构,这样对印迹识别过程十分有利;最后,除了前2个作用外,还需尽量降低溶剂的极性和质子化,因为在非极性溶剂体系中模板分子和功能单体更易于形成主客体复合物.乙腈溶解性最好,但是极性大,所以选择加入小极性的非质子溶剂甲苯作混合体系.试验结果如表1所示,乙腈和甲苯/乙腈(1∶1,2∶8,V/V)混合体系溶解拉巴乌头碱的速度非常快,考虑使用乙腈或甲苯/乙腈体系作为致孔剂,而丙酮的溶解性不好,挥发性大,不选用其作致孔剂.

表1 拉巴乌头碱溶解性试验结果
2.2 吸附性能测定
2.2.1 不同功能单体对吸附量的影响 配制拉巴乌头碱甲醇溶液,浓度为0.1 mmol/L,分别称取一定量的以甲基丙烯酸、丙烯酰胺为功能单体的分子印迹微球聚合物和非分子印迹微球聚合物,进行吸光度测定并计算其饱和吸附量(表2,表3).
多次试验表明,通过本体聚合法直接聚合得到的分子印迹聚合物MIP和NIP都吸附拉巴乌头碱分子,吸附量数值差别不大,但是将MIP和NIP分别研磨过筛,孔径大小为45 μm,MIP1和MIP2分别为粒径大于45 μm和小于45 μm的微球.由表2可知,大颗粒的MIP1和NIP1的吸附量没有明显差别,说明没有吸附选择性;而小颗粒MIP2的吸附量为11.5 μmol/g,远大于其空白对照NIP2的吸附量0.4 μmol/g,表明以乙腈为溶剂、甲基丙烯酸为功能单体时制备的聚合物微球粒径小于45 μm,所获得的微球粒径分布较单一,平均粒径在45 μm左右,对拉巴乌头碱具有比较显著的识别效应,而NIP2对它们主要是通过非特异性吸附起作用.结果也进一步表明,在 MIP2中存在固定排列的结合基团的立体空穴,空穴的大小决定于模板分子的大小,空穴内的结合基团的位置决定于模板分子结合基团的位置,而非印迹聚合物NIP2中则没有这种孔穴.

表2 以乙腈为溶剂、 甲基丙烯酸为功能单体聚合物吸附量
MIP1(NIP1):(非)印迹分子大颗粒;MIP2(NIP2):(非)印迹分子小颗粒;C0:吸附前溶液中LA的浓度;Ce:吸附后溶液中LA的浓度;m:称取的分子印迹聚合物的质量;V:LA溶液的体积;Q:聚合物的吸附量.
MIP1(NIP1): (Non)imprinted molecular large particles;MIP2(NIP2):(Non)imprinted molecular small particles;C0:Concentration of LA in the solution before adsorption;Ce:Concentration of LA in the solution after adsorption;m:Mass of molecularly imprinted polymer weighed;V:Volume of LA solution;Q:Amount of adsorbed polymer.

表3 以乙腈为溶剂、丙烯酰胺为功能单体聚合物吸附量
从表3可看出,将印迹微球过45 μm金属筛后,大颗粒MIP1吸附量为3.5 μmol/g,NIP1吸附量为3.9 μmol/g;小颗粒MIP2吸附量为6.0 μmol/g,NIP2吸附量为4.8 μmol/g;大小颗粒MIP和NIP吸附量相近,表明以乙腈为溶剂、丙烯酰胺为功能单体时制备的聚合物微球MIP选择性不好,没有形成特异性识别的空穴位点.
对比表2与表3可知,试用2种功能单体,甲基丙烯酸与模板分子的选择识别性优于丙烯酰胺,分析其结构,推测拉巴乌头碱分子中的酰胺基、羟基与甲基丙烯酸中的羧基能够形成多种氢键,而氢键具有方向性和饱和性[22],因而制备出来的分子印迹聚合物选择性往往会较高,而拉巴乌头碱分子中的酰胺基与丙烯酰胺中的酰胺基只能形成1种氢键,与模板分子的结合性不强.分子印迹聚合物的选择性与模板和功能单体之间相互作用的情况以及模板分子的三维结构和刚性有关,有诸多报道的例子都显示,制备分子印迹聚合物时,使用多种非共价作用类型制得的分子印迹聚合物往往比只用1种作用类型制得的分子印迹聚合物在选择性和分离能力上具有优势[23-24].
2.2.2 改变溶剂(致孔剂)对吸附量的影响 由表4可知,分子印迹微球浓度为0.1 mmol/L时,MIP吸附量为12.3 μmol/g,NIP吸附量为13.6 μmol/g,表明以甲苯乙腈为溶剂、甲基丙烯酸为功能单体时制备的聚合物微球选择性不好,同时说明甲苯乙腈为溶剂致孔效果不好,没有形成固定排列的结合拉巴乌头碱分子的立体空穴.
由表5可知,分子印迹微球浓度为0.1 mmol/L时,MIP吸附量为10.2 μmol/g,NIP吸附量为9.9 μmol/g, MIP和NIP吸附量均相近,表明以甲苯/乙腈(1∶1,V/V)为溶剂、丙烯酰胺为功能单体制备的聚合物微球选择性不好.

表4 以甲苯/乙腈为溶剂、甲基丙烯酸为功能单体聚合物吸附量

表5 以甲苯/乙腈为溶剂、丙烯酰胺为功能单体聚合物吸附量
比较表4和表5,发现将溶剂换为甲苯/乙腈体系,不管是甲基丙烯酸还是丙烯酰胺,聚合物微球的吸咐选择性都不好.说明溶剂对聚合物选择识别性的影响很重要.溶剂对聚合物的影响主要表现在,控制非共价键结合的强度,同时影响最后形成的聚合物的形态,而非共价作用的强弱[22].
本试验采用甲苯-乙腈混合溶剂作为聚合试验的溶剂,所得印迹微球吸附选择性不好的原因可能是甲苯极性低,对模板分子溶解度小,对聚合物溶解度大,聚合物微球无法达到足够大的粒径便从溶液中析出,对底物的吸附性也随之降低[25];另外由于聚合物的形态也会受溶剂的影响,有的溶剂会使聚合物发生程度不等的溶胀,从而改变其结合部位的三维结构,导致其对底物的吸附性降低[22].
饱和吸附量的测定结果表明:以拉巴乌头碱为模板分子,分别以乙腈为致孔剂,以甲基丙烯酸(MAA)为功能单体,乙二醇二甲基丙烯酸酯(EDMA)作交联剂,偶氮异丁腈(AIBN)作引发剂,反应24 h,拉巴乌头碱、MAA、EDMA摩尔比为1∶4∶20,制备得到印迹微球,洗脱完过45 μm金属筛后,粒径小于45 μm的小颗粒MIP2的吸附量远大于其空白对照NIP2吸附量.
2.3 MIP与NIP等温吸附测定
以乙腈为溶剂、甲基丙烯酸为功能单体制备的聚合物有相对较好的吸附量,故以此聚合物来测定MIP与NIP的等温吸附量(表6,表7).
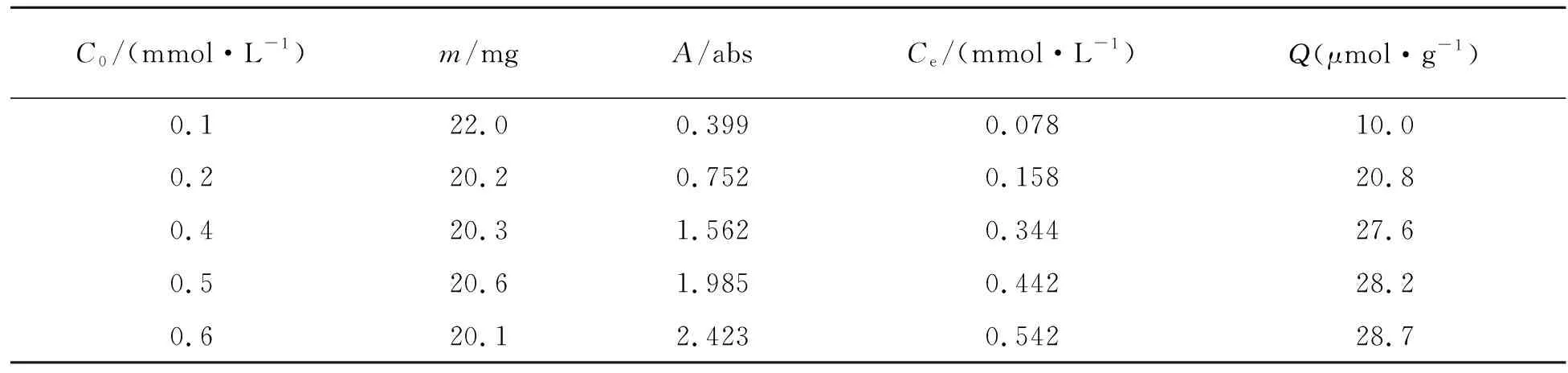
表6 MIP的等温吸附量
由图4可知,在100~600 μmol/L范围内,吸附量与溶液成正相关性,随着拉巴乌头碱溶液浓度的增大,其分子印迹聚合物的吸附量也随之增大;当溶液浓度达到一定程度时,吸附量不再升高,达到饱和,这说明分子印迹聚合物通过氢键和空间匹配的识别作用对拉巴乌头碱具有一定的吸附能力,但随着拉巴乌头碱溶液浓度的增大,分子印迹聚合物吸附量增大趋势逐渐减缓,这说明印迹聚合物的结合位点是有限的,其吸附性能具有饱和性.分子印迹聚合物微球MIP的饱和吸附量明显高于对应的空白对照聚合物微球NIP的饱和吸附量,表明制备的分子印迹微球对模板具有一定的吸附能力,而其空白对照聚合微球对模板分子无特异吸附[26].

表7 NIP的等温吸附量

图4 MIP与NIP对拉巴乌头碱分子的等温吸附曲线Figure 4 Adsorption isotherm of theophylline of MIP and NIP on Lappaconine
2.4 Scatchard分析
Scatchard模型被广泛用于评价分子印迹聚合物的结合特性及识别机理[24],其表达式为
Q/C=(Qmax-Q)/Kd

图5 MIP与NIP的Scatchard分析图Figure 5 Scatchard analysis structure of MIP and NIP
式中,C为拉巴乌头碱分子的平衡浓度(mmol·L-1);
Qmax为结合位点的最大表观吸附量(μmol/g);Kd为结合位点的平衡解离常数(mmol/L).
根据表8中数据,以Q/C对Q作图所得的Scatchard曲线(图5).由图5可知,这些点分布在2个线性区域,表明分子印迹微球对印迹模板分子存在2种结合位点,对这2部分分别线性回归得到Scatchard图.在试验范围内,拉巴乌头碱在分子印迹微球中产生2类不同的结合位点,根据直线的斜率和截距计算2类吸附位点的最大吸附量和平衡离解常数,得到高亲和性结合位点的离解常数和最大表观吸附量分别为0.194 mmol/L和41.006 μmol/g;低亲和性结合位点解离常数和最大表观吸附量分别为0.058 mmol/L和31.079 μmol/g.分析印迹分子聚合物微球中存在2种结合位点主要原因为模板分子有供氢基团(酰氨基、羟基)和受氢基团(骨架 N、羟基氧,甲氧基氧),而功能单体甲基丙烯酸也是既有供氢基团(羧羟基)和受氢基团(羰基氧),二者通过氢键和空间相互作用力形成分子识别位点,在分子识别位点所形成的特异性吸附和表面吸附,推测拉巴乌头碱分子的酰胺基、羟基为分子识别位点.

表8 以乙腈为溶剂、甲基丙烯酸为功能单体制备的聚合物相关数据计算
C为拉巴乌头碱溶液浓度;Q1、(Q/C)1为MIP数据;Q2、(Q/C)2为NIP数据.
Cis concentration of Lappaconine solution;Q1,(Q/C)1is MIP data;Q2,(Q/C)2is NIP data.
2.5 分子印迹聚合物的选择性
为研究印迹聚合物对拉巴乌头碱的选择性,选择了与拉巴乌头碱结构大小接近且含有羟基作为分子识别位点的β-谷甾醇作为底物竞争吸附物质,进行竞争吸附试验,来考察的吸附选择性即考察其是否具有专一性吸附.二者的结构式如图6所示,左图为拉巴乌头碱的分子结构式,右图为β-谷甾醇的分子结构式.

图6 拉巴乌头碱和β-谷甾醇分子结构图Figure 6 The structure of Lappaconine and β-sitosterol

表9 分子印迹微球的选择性
分离因子α=聚合物对模板的吸附量/印迹聚合物对其他底物的吸附量;
印迹效率β=印迹聚合物分离因子/空白聚合物分离因子.
印迹微球对目标底物的选择性能如表9所示,印迹微球对拉巴乌头碱的吸附量为 7.2 μmol/g,明显高于对β-谷甾醇的吸附量(3.3 μmol/g),而空白印迹物对拉巴乌头碱和β-谷甾醇的吸附量相近,此分子印迹微球对拉巴乌头碱与β-谷甾醇的选择性分离因子α为2.18,印迹效率为1.73,表明此分子印迹聚合物微球对拉巴乌头碱分子具有特异性识别和吸附作用.
2.6 电镜扫描分析
对以乙腈为溶剂、甲基丙烯酸为功能单体制备的聚合物进行扫描电子显微镜(SEM)分析,分别观测2种微球的形貌,在不同分辨率下扫描结果如图7~8所示.
由图7~8可知,MIP与NIP颗粒分布均匀,但MIP微球呈片状,使其吸附量减少,与吸附性能测定结果一致;NIP颗粒呈球状.究其原因在于通过本体聚合法制备得到的MIP与NIP微球是将模板分子,功能单体、交联剂、引发剂等按照一定的比例溶解于溶液中,除氧密封后聚合,得到致密的块状聚合物,等到干燥之后将其研磨,破碎,过筛之后得到一定粒径的介质,最后洗脱除去模板分子[22].模板分子拉巴乌头碱的存在会减弱聚合反应的活性,减慢聚合物成核速率,减少了低聚物核的数量,导致MIP微球呈片状,粒径大于NIP;也可能是模板分子的存在改变了聚合物的空间结构.

图7 不同分辨率下MIP扫描电镜图Figure 7 SEM photographs of MIP

图8 不同分辨率下NIP扫描电镜图Figure 8 SEM photographs of NIP
3 结论
本试验首次采用本体聚合法,以乙腈为溶剂、甲基丙烯酸为功能单体成功制备出了对拉巴乌头碱有较好选择吸附性的印迹聚合物,并对其制备方法进行了初步优化.筛选了与模板分子结合最好的功能单体、溶剂种类及溶剂用量,按最佳比例合成的MIPs对模板分子表现较强的特异性吸附能力,该微球的形貌、吸附性能和选择性最好.静态吸附试验和Scatchard分析表明,合成的聚合物具有良好的选择性和较高的吸附容量,为拉巴乌头碱的富集和天然产物中拉巴乌头碱的分离提供了新的固相萃取或色谱柱填料.该方法简单易行,为开发天然产物中拉巴乌头碱的分离提纯新工艺提供了理论基础.

