绵羊痘病毒甘肃古浪株RING finger基因的克隆表达及序列分析
陈晓倩,吴国华,郭小腊,杨静,吴金恩,颜鲁军,周雪雁,郑亚东,陈轶霞
(1.西北民族大学生命科学与工程学院,甘肃 兰州 730030;2.中国农业科学院兰州兽医研究所,家畜疫病病原生物学国家重点实验室,甘肃省动物寄生虫病重点实验室,甘肃 兰州 730046)
羊痘是由羊痘病毒属(Capripoxvirus)的绵羊痘病毒(sheeppox virus,SPPV)或山羊痘病毒(goatpox virus,GTPV)引起的羊的一种急性、热性、接触性传染病,是所有动物痘病毒中最严重的一种[1],广泛分布于亚洲、欧洲、北美和非洲的许多国家.世界动物卫生组(OIE)将该病列为法定通报传染病,我国将其列为Ⅰ类动物疾病.此外,SPPV还可作为生物武器,威胁国防安全,被划归到Ⅱ类危险战剂[4-5].近年来我国的一些省份均有本病的流行.由于感染羔羊有较高的病死率,因此阻碍了我国畜牧业的健康发展[2-3].
RING (really interesting new gene) finger 蛋白是一类含有环指结构域的蛋白,是一个庞大的蛋白家族,广泛存在于动物和酵母等所有的真核生物中[6],在拟南芥、辣椒、水稻等植物中都成功分离并鉴定了RING finger蛋白[7-9].RING结构域的氨基酸序列为Cys-X2-Cys-Xn(9-39)-Cys-X1~3-His-X2~3-Cys-X2-Cys-Xn (4-48)-Cys-X2-Cys,其中X可以代表任意1种氨基酸残基,数字代表氨基酸数量[10-11],根据与锌离子结合的第5个氨基酸是半胱氨酸还是组氨酸可以将其分为C3H2C3( RING-H2)或C3H1C4 ( RING-HC)构型[12].近年来,越来越多的RING finger蛋白被证明能作为E3泛素连接酶来介导底物特异性泛素化[13].
许多病毒可以通过编码它们自己的E3连接酶或宿主的E3连接酶来操纵泛素-蛋白酶体系,促进其感染.正痘病毒属成员编码1个高度保守的28 ku的毒力因子(p28),其C末端有1个典型的RING finger基序(C3HC4),N末端包含1个KilA-N DNA结合域,是一个RING finger蛋白.研究表明,p28受到蛋白酶体降解和泛素化的高度调控,还可通过自身泛素化进行自我调节[14-15].在鼠痘病毒感染的过程中,p28参与抑制病毒感染诱导的细胞凋亡,从而促进病毒复制,且其具有E3泛素连接酶活性[16-17];禽痘病毒在感染过程中也编码2个具有E3泛素连接酶活性的p28样蛋白[18].
羊痘病毒的基因组为线性、双链DNA,共有147个开放阅读框(open reading frame,ORF), 其中第140个ORF编码1个RING finger蛋白[19],其生物功能还未见报道.因此,本研究以绵羊痘病毒甘肃古浪株(sheeppox virus gansu gulang strain,SPPV GS-GL)DNA为模板,扩增并表达绵羊痘病毒RING finger蛋白(sheeppox virus RING finger protein,SPPVRFP),为进一步研究SPPVRFP的功能奠定基础.
1 材料与方法
1.1 试验材料
绵羊痘病毒古浪株基因组DNA、绵羊痘病毒阳性血清、pGEX-4T-1表达载体由中国农业科学院兰州兽医研究所提供;pEASY-T1载体购自北京全式金生物技术有限公司;新西兰大白兔购于中国农业科学院兰州兽医研究所动物场.
1.2 试验试剂
PrimeSTAR HS DNA 聚合酶、DL2000 DNA Marker、限制性内切酶BamHⅠ和XhoⅠ、Agarose gel DNA Fragment Purification Kit、MiniBEST Plasmid Purification Kit均购自Takara公司.Trans5α、Trans1-T1、BL21(DE3)感受态细胞均购自北京全式金生物技术有限公司.T4 DNA连接酶、蛋白预染Marker购自Thermo Scientifc公司.4x蛋白上样缓冲液购自Salarbio公司.Glutathione Sepharose 4B蛋白纯化试剂盒购自美国GE公司.弗氏佐剂购自Sigma公司.HRP酶标山羊抗家兔IgG购自SeraCare Life Sciences公司.HRP酶标驴抗绵羊IgG购自Abcam公司.ECL发光试剂盒购自Invitrogen公司.X光底片、显影液和定影液均购自Carestream公司.
1.3 试验方法
1.3.1 引物的设计与合成 根据NCBI数据库中收录的绵羊痘病毒TU株的RINGfinger基因(GenBank登录号:AY077832.1)序列,利用DNAMAN分别设计上下游引物,并插入BamHⅠ和XhoⅠ酶切位点(下划线处).上游引物的序列为:5′-CGCGGATCCATGGATTCTAATAGTCGAAACGG-3′,下游引物的序列为5′-CCGCTCGAGCGGTTATGGAAAAAATCTACTTTTTATAAC-3′.引物由苏州金唯智生物技术有限公司合成.
1.3.2 SPPVRFP基因的克隆及序列分析 以SPPV GS-GL DNA为模板,用合成的SPPVRFP基因上、下游引物进行PCR扩增.98 ℃ 10 s ,55 ℃ 5 s,72 ℃ 1 min,35个循环扩增.PCR产物经琼脂糖凝胶电泳纯化后回收,将回收产物与pEASY-T1载体进行连接并转入Trans1-T1大肠杆菌感受态细胞,经培养鉴定后,提取阳性质粒进行测序.阳性克隆质粒命名为pEASY-SPPVRFP.
利用Pfam数据库(http://pfam.xfam.org/)预测分析其结构域.利用DNAStar对测序结果进行序列分析,并与不同羊痘病毒株的(表1)RINGfinger基因进行核苷酸和氨基酸序列同源性分析,绘制系统发育树.
1.3.3 不同RING finger蛋白间的氨基酸序列比对 利用DNAMAN软件对鼠痘病毒RING finger蛋白p28、牛痘病毒p28样蛋白、禽痘病毒FWPV150 、FWPV157 、粘液瘤病毒M143R、大肠杆菌N1R p28样蛋白及SPPV GS-GL株SPPVRFP的氨基酸序列进行比对.
1.3.4SPPVRFP原核表达质粒的构建 用BamHⅠ和XhoⅠ双酶切pGEX-4T-1和pEASY-SPPVRFP质粒,回收目的片段.用T4 DNA连接酶于16 ℃过夜连接SPPVRFP基因片段和线性化的pGEX-4T-1,转入大肠杆菌感受态细胞Trans5α中,涂于(含100 μg/mL氨苄青霉素)LB琼脂平板,挑取单克隆菌落提取质粒经PCR以及双酶切鉴定后进行测序,将鉴定为阳性的重组表达质粒命名为pGEX-SPPVRFP.
1.3.5 SPPVRFP重组蛋白的表达及纯化 将构建正确的重组质粒pGEX-SPPVRFP和pGEX-4T-1空载体分别转入BL21(DE3)感受态细胞,挑选单克隆,过夜培养,培养物以1∶100的体积比接种于20 mL LB液体培养基(含100 μg/mL氨苄青霉素)中,37 ℃,220 r/min培养至D600为0.6~1.0时加入终浓度0.5 mmol/mL IPTG,16 ℃诱导培养14 h,同时设立相同条件下未做诱导的对照组,收集菌液进行SDS-PAGE电泳分析,检测重组蛋白表达情况.
取pGEX-4T-1空载体诱导表达菌液和pGEX-SPPVRFP诱导表达菌液8 000 r/min,4 ℃条件下离心10 min,弃上清.沉淀分别用PBS洗涤3次后用Buffer进行重悬.重悬后的菌体悬液于冰上超声裂解后,4 ℃ 10 000 r/min离心10 min,收集上清,采用Glutathione Sepharose 4B蛋白纯化试剂盒纯化目的蛋白.
1.3.6 SPPVRFP重组蛋白兔阳性血清的制备及Western-blot鉴定 SPPVRFP重组蛋白采用背部皮下多点注射法免疫新西兰大白兔,设未免疫对照组.间隔2周免疫1次,共免疫4次.首次免疫时,将纯化的蛋白与弗氏完全佐剂混合,每只注射1 mg.其后与弗氏不完全佐剂混合,每次免疫蛋白量减半.每次免疫前对试验组和对照组进行耳缘静脉采血,分离血清,检测其抗体水平,收集阳性血清备用.将纯化后的SPPVRFP重组蛋白进行SDS-PAGE电泳,用湿转电转仪将蛋白质转移到PVDF膜上,以上述制备的重组蛋白兔阳性血清和绵羊痘病毒阳性血清作为一抗(1∶1 000稀释),同时设置阴性血清对照组,4 ℃过夜,然后分别加入辣根过氧化物酶标记的山羊抗兔IgG抗体(1∶10 000稀释)和驴抗绵羊IgG抗体(1∶10 000稀释),室温孵育1 h,用ECL显色液显色后于暗室曝光.
2 结果与分析
2.1 SPPVRFP基因序列扩增
以绵羊痘病毒古浪株病毒DNA为模板,PCR扩增SPPVRFP基因,产物经琼脂糖凝胶电泳分析,出现1条大小约723 bp的特异条带,如图1所示.
2.2 SPPVRFP基因的序列及遗传进化分析
Pfam数据库预测分析发现其含有2个结构域,分别为KIlA-N结构域和RING finger结构域(图2).利用DNAStar软件对SPPVRFP基因序列进行分析,发现其由723个核苷酸组成,编码240个氨基酸,分子量约为28.5 ku.同源性分析显示,SPPVRFP基因同其他羊痘病毒毒株的RINGfinger基因核苷酸的同源性为95.5%~99.2%,氨基酸序列的同源性为92.9%~98.3%(表2).系统进化树分为2个分枝,绵羊痘病毒和山羊痘病毒在不同的分枝上,SPPV GS-GL 株的RINGfinger基因与其它3株绵羊痘病毒处在同一分支上(图3).
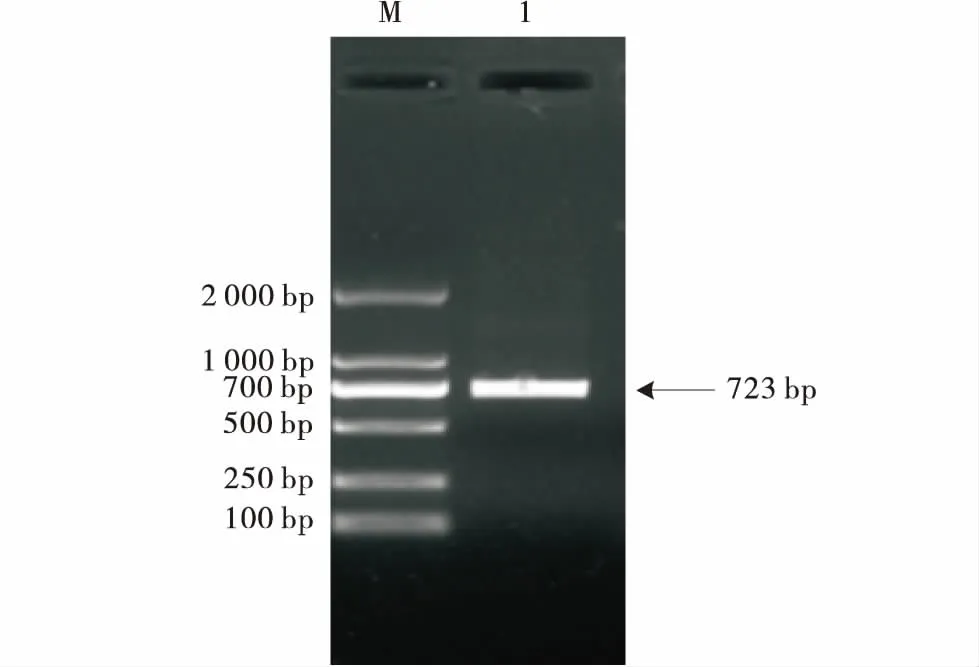
M:DNA分子质量标准;1:SPPVRFP 基因PCR产物.M:DNA Marker;1:PCR product of SPPVRFP.图1 SPPVRFP基因的PCR扩增Figure 1 PCR amplification of SPPVRFP

图2 SPPVRFP结构域预测Figure 2 SPPVRFP domain prediction
右上角为核苷酸同源性;左下角为氨基酸同源性.
Nucleotide homology in the upper right corner;amino acid homology in the lower left corner.

图3 CPV不同毒株RING finger基因系统进化树Figure 3 Phylogenetic tree of RING finger of different CPV strains
2.3 不同RING finger蛋白间的氨基酸序列比对
利用DNAMAN软件对不同RING finger蛋白(表3)进行氨基酸序列比对,发现它们都含有8个高度保守的半胱氨酸和组氨酸,且都具有RING finger结构域(图4).

表3 毒株信息
2.4 SPPVRFP重组表达质粒的鉴定
利用限制性内切酶BamHⅠ和XhoⅠ同时对pGEX-SPPVRFP重组质粒进行双酶切鉴定,分别获得了约723、4 900 bp的2条条带(图5),与理论值一致,测序结果也表明pGEX-SPPVRFP重组质粒构建成功.

M:DNA分子质量标准;1:重组质粒pGEX-SPPVRFP的BamHⅠ和XhoⅠ双酶切产物.M:DNA marker;1:The product from recombinant plasmid pGEX-SPPVRFP digested by BamHⅠ and XhoⅠ图5 重组质粒pGEX-SPPVRFP的鉴定Figure 5 Identification of recombinant pGEX-SPPVRFP plasmid
2.5 SPPVRFP重组蛋白的表达及纯化
对pGEX-SPPVRFP和pGEX-4T-1空载体分别进行诱导表达,菌液的SDS-PAGE电泳检测结果表明,pGEX-SPPVRFP诱导组在55 ku处出现明显的蛋白条带(图6-A),pGEX-4T-1空载体诱导组在26 ku处出现明显的蛋白条带(图6-B).对SPPVRFP重组蛋白和pGEX-4T-1空载体诱导表达蛋白进行纯化,SDS-PAGE电泳检测显示,在26、55 ku处分别出现单一条带(图6-C).
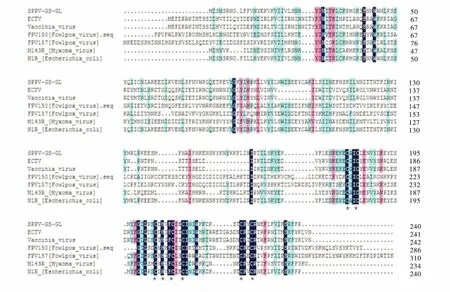
图4 不同RING finger蛋白氨基酸序列比对Figure 4 Comparison of amino acid sequence for different RING finger proteins
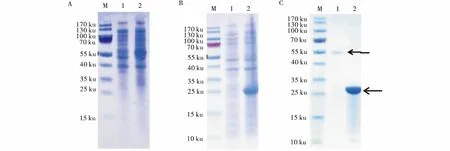
M:蛋白质分子质量标准;A(1):未诱导的pGEX-SPPVRFP;A(2):诱导的pGEX-SPPVRFP;B(1):未诱导的pGEX-4T-1;B(2):诱导的pGEX-4T-1;C(1):SPPVRFP纯化;C(2):pGEX-4T-1标签蛋白纯化.M:Protein molecular weight Marker;A(1):Uninducd pGEX-SPPVRFP;2(A):Inducd pGEX-SPPVRFP;B(1):Uninducd pGEX-4T-1;B(2):Inducd pGEX-4T-1;C(1):Purification of SPPVRFP;C(2):Purification of PGEX-4T-1.图6 SPPVRFP的表达及纯化Figure 6 Expression and purification of recombinant SPPVRFP
2.6 SPPVRFP重组蛋白的Western-blot鉴定
将纯化后的SPPVRFP重组蛋白进行Western-blot鉴定,结果如图7所示,SPPVRFP重组蛋白能够与其纯化蛋白制备的兔阳性血清发生反应,在55 ku处出现明显特异性条带,而与绵羊痘病毒阳性血清和兔阴性血清不发生反应.

M:蛋白质分子质量标准;1:重组蛋白兔阳性血清;2:阴性血清;3:绵羊痘病毒阳性血清.M:Protein marker;1:Rabbit polyclonal serum;2:Negative control serum;3:SPPV polyclonal serum.图7 SPPVRFP重组蛋白Western-blot分析Figure 7 Western-blot analysis of recombinant SPPVRFP
3 讨论
痘病毒可编码操纵泛素-蛋白酶体系统的蛋白,包括细胞泛素同源物、充当泛素连接酶底物连接蛋白的蛋白,以及编码具有内源性泛素连接酶活性的蛋白;痘病毒也可直接抑制细胞E3连接酶的功能以利于病毒的感染、致病.RING finger结构域蛋白在痘病毒中高度保守,越来越多的RING finger蛋白被鉴定为E3泛素连接酶[20-21].对绵羊痘病毒古浪分离株进行结构域预测,发现其具有RING finger结构域.将其与其他6株羊痘病毒分离株的RINGfinger基因进行同源性分析,发现它们的核苷酸序列同源性高达99.2%,氨基酸序列同源性高达98.3%,进一步证实了RINGfinger基因在痘病毒间的保守性.将SPPVRFP与不同的RING finger蛋白氨基酸序列进行比对,发现它们都含有8个高度保守的半胱氨酸和组氨酸残基,且它们都具有RING finger结构域,我们推测SPPV GS-GL株RING finger蛋白可能也具有E3泛素连接酶活性.
本试验构建的原核表达载体pGEX-SPPVRFP诱导表达出分子量约为55 ku的重组蛋白,该蛋白含有GST标签以融合方式表达,GST标签大小约为26 ku,故重组SPPVRFP的大小约为55 ku.Western-blot分析显示,重组SPPVRFP能够与其纯化蛋白制备的兔阳性血清发生反应,但该蛋白不与绵羊痘病毒阳性血清反应,其原因有可能是在绵羊痘病毒感染宿主的过程中,RING finger蛋白不能被宿主的免疫系统识别,不产生免疫应答反应,不刺激抗体的产生,详细机制有待进一步深入研究.
4 结论
本研究成功克隆、表达了绵羊痘病毒甘肃古浪株RINGfinger基因,并纯化了RING finger蛋白.生物信息学分析发现SPPVRINGfinger基因具有RING finger结构域,且其在羊痘病毒间的保守性良好,与不同的RING finger蛋白氨基酸序列进行比对,发现它们都含有8个高度保守的半胱氨酸和组氨酸残基;Western-blot分析显示,重组SPPVRFP不与绵羊痘病毒阳性血清发生反应.

