参麦注射液抗氧化活性体外实验研究*
肖文海,杨政伟,李 远
(1.重庆市大足区中医院,重庆 402360;2.重庆医科大学附属永川医院中心实验室,重庆 402160)
大量研究证实机体内过量自由基形成及其诱发的“瀑布式”自由基连锁反应将造成生物膜损伤、蛋白质变性、DNA错误复制及酶失活等,进而引发生物体内各种疾病产生[1]。在生理状态下,由系列酶和非酶复合物组成的体内抗氧化防御体系能够在氧自由基产生后即时清除以维持体内平衡。然而,在严重氧化应激条件下,单独的机体内抗氧化体系不能完全消除过量自由基,进而造成机体氧化损伤。另一方面,大量研究显示一些源于天然植物的物质具有抗氧化效应,可作为的潜在药物有效地抑制和清除机体内的过量自由基,进而阻断自由基参与的一系列不良氧化反应[2]。参麦注射液是由人参、麦门冬为组分制成的中药复方注射液,中医理论上具有“益气固脱、养阴生津,生脉”功效[3]。此外,一些体内和临床实验还显示参麦注射液具有减轻氧自由基对细胞损伤和降低细胞膜脂质过氧化的效果,进而用于缺血性脑卒中的临床治疗和改善脑缺血-再灌注导致的肺损伤[4-5]。然而,参麦注射液相关的体外抗氧化性能却鲜见文献报道[6]。因此。本研究将系统评价参麦注射液的体外抗氧化活性,为参麦注射液体内临床抗氧化应激药理学机制提供实验。
1 试剂和仪器
1.1 主要试剂 2,6-二叔丁基对甲酚(BHT)、柠檬酸、过氧化氢、氯化亚铁(FeCl2)、菲啰嗪、硝普钠均为分析纯,购于上海麦克林生化科技有限公司;参麦注射液(批号:1703101)由正大青春宝药业有限公司提供,根据临床用法用量用生理盐水分别稀释10、20、40、60、80 和 100 倍后进行测试;总抗氧化能力(TAC)比色法定量检测试剂盒(DPPH法)由赫澎(上海)公司提供;总抗氧化能力检测试剂盒(FRAP法)、一氧化氮(NO)检测试剂盒由碧云天生物技术有限公司提供。
1.2 主要仪器 Varioskan Flash多功能酶标仪(美国热电)、震荡恒温孵育箱(上海智诚)。
2 方法
2.1 总抗氧化能力 参麦注射液总抗氧化能力通过总抗氧化能力检测试剂盒(FRAP法)进行检测,流程按试剂盒说明书操作。流程如下:首先在96孔板每个检测孔中加入180 μL FRAP工作液,在样品孔中加入5 μL不同浓度待测样品;空白对照孔中加入5 μL生理盐水;标准曲线孔中加入5 μL不同浓度的FeSO4标准溶液。轻轻混匀,37℃孵育5 min,测试溶液在593 nm波长处的吸光度值。吸光度值越大代表样品具有越高总抗氧化能力。根据标准曲线计算参麦注射液的总抗氧化能力,并用FeSO4标准溶液浓度来表示。实验以0.1 mg/mL BHT、10 mmol/L水溶性维生素E(Trolox)、10%柠檬酸作为对照进行比较。
2.2 DPPH自由基(DPPH·)清除活性 参麦注射液DPPH·清除活性采用总抗氧化能力(TAC)比色法(DPPH法)定量检测试剂盒进行测量,按试剂盒说明书操作。流程如下:取20 μL不同浓度待测样品加入96孔板中,加入试剂盒提供的205 μL缓冲液,25 μL染色工作液,轻摇96孔板混匀,室温孵育15 min后,测试混合液在515nm波长处吸光度值,吸光度值越低代表样品具有越高的DPPH·清除活性。DHHP·清除活性(%)=(Ac-As)/Ac×100,Ac 为空白组吸光度值、As为含不同样品的混合液吸光度值。实验以 0.1mg/mL BHT、10mmol/L Trolox、10%柠檬酸作为对照进行比较。
2.3 一氧化氮自由基(NO·)清除能力 参麦注射液NO·清除能力通过Griess法反应进行量化[7],按NO检测试剂盒说明书操作。流程如下:将1 mL不同浓度待测样品与1 mL浓度为10 mmol/L的硝普钠溶液中混合,25℃孵育150 min。取50 μL混合液加入到96孔板中,依次加入剂盒中提供的50 μL Griess Reagent I、50 μL Griess Reagent II溶液,充分混合后室温反应10 min,测试溶液在540 nm波长吸光度值,吸光度值越低表示样品具有越高的NO·清除活性。NO·清除活性(%)=(Ac-As)/Ac×100,Ac为空白组吸光度值,As为含不同样品的混合液吸光度值。实验以 0.1 mg/mL BHT、10 mmol/L Trolox、10%柠檬酸作为对照进行比较。
2.4 过氧化氢(H2O2)清除能力 参麦注射液H2O2清除能力测试参考文献[8]。流程如下:用生理盐水配置40 mmol/L过氧化氢溶液;取100 μL不同浓度待测样品加入到600 μL过氧化氢溶液中,用生理盐水定容到3 mL,室温震荡孵育30 min;空白样品中只含生理盐水和过氧化氢溶液;测试溶液在230 nm波长处的吸光度值。吸光度值越低代表样品具有越高的 H2O2清除活性。H2O2清除活性(%)=(Ac-As)/Acx100,Ac为空白组吸光度值,As为含样品溶液吸光度值。实验以0.1 mg/mL BHT、10 mmol/L Trolox、10%柠檬酸作为对照进行比较。
2.5 亚铁(Fe2+)离子螯合活性 参麦注射液Fe2+离子螯合活性测试参考文献[9]。流程如下:取100 μL不同浓度待测样品加入生理盐水400 μL,随后依次加入 10 μL 2 mmol/L FeCl2溶液和 20 μL 菲啰嗪溶液,混匀后室温孵育10 min,空白对照中不含待测样品。测试混合溶液在562 nm波长处吸光度值,吸光度值越低代表样品具有越高Fe2+离子螯合活性。Fe2+离子螯合活性(%)=(Ac-As)/Ac×100,Ac 为空白样品吸光值,As为含样品溶液吸光度值。实验以0.1 mg/mL BHT、10 mmol/L Trolox、10%柠檬酸作为对照进行比较。
2.6 统计学方法 使用SPSS 19.0统计软件进行分析,所有实验数据使用均数±标准差(x±s)表示。多组间均值比较采用单因素方差分析,分析前采用Levene法对多组数据进行方差齐性检验,方差齐性条件满足时采用Dunnett-t进行均值比较,方差齐性条件不满足时采用Dunnett’s T3进行两两比较,以P<0.05表示差异有统计学意义。
3 结果
3.1 总抗氧化能力 不同稀释倍率参麦注射液总抗氧化能力如图1(A)所示,显示总抗氧化能力随稀释倍率减少而增大。稀释10倍参麦注射液总抗氧化能力显著低于 BHT、Trolox抗氧化能力(P<0.01),但高于柠檬酸总抗氧化能力(P<0.01),结果如图1(B)所示。
3.2 DPPH·清除活性 不同稀释倍率的参麦注射液DPPH·清除活性如图 1(C)所示,显示 DPPH·清除活性随稀释倍率减少而增大。稀释10倍参麦注射液DPPH·清除活性显著低于BHT、Trolox抗氧化能力(P<0.01),与柠檬酸DPPH·清除活性差异无统计学意义(P>0.05),如图 1(D)所示。
3.3 NO·清除活性 不同稀释倍率的参麦注射液NO·清除活性见图1(E)所示,显示其NO·清除活性稀释倍率减少而增大。稀释10倍参麦注射液NO·清除活性显著高于BHT(P<0.05)、Trolox和柠檬酸(P<0.01),如图 1(F)所示。
3.4 H2O2清除活性 不同稀释倍率的参麦注射液H2O2清除活性见图1(G)所示,显示其H2O2清除活性稀释倍率减少而增大。稀释10倍参麦注射液H2O2清除活性与柠檬酸相当(P>0.05),显著低于BHT(P<0.01)和 Trolox(P<0.05),如图 1(H)所示。
3.5 Fe2+离子螯合活性 不同稀释倍率的参麦注射液Fe2+螯合活性随稀释倍率减少而增大,见图1(I)所示。稀释10倍参麦注射液亚铁离子螯合活性显著高于 BHT、Trolox和柠檬酸(P<0.01),如图 1(J)所示。
3.6 不同自由基清除活性比较 10倍稀释参麦注射液对不同自由基具有不同的清除能力,其中,NO·[(54.4±6.6)%]>Fe2+离子螯合[(42.6±3.2)%]>DPPH·[(36.2±2.8)%]>H2O2[(23.5±1.2)%]。
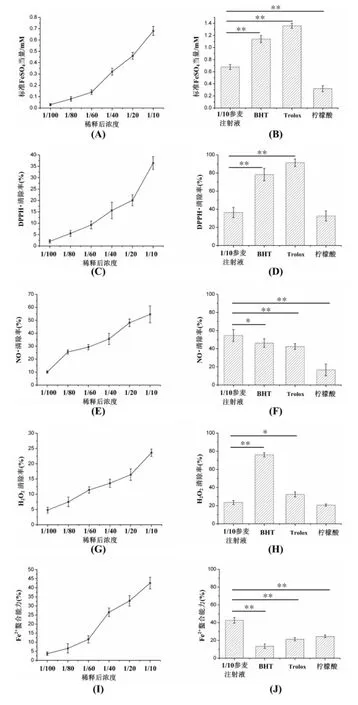
图1 参麦注射液体外抗氧化活性Fig.1 In vitro antioxidant activity of Shenmai injection
4 讨论
近年来大量研究表明生物体内过量的氧自由基及氧化应激是导致心血管系统、肿瘤及退行性病变的重要原因之一[10]。参麦注射液作为人参、麦门冬为组分制成的中药复方注射液,除具有“益气固脱、养阴生津,生脉”的中医功效外,在机体内还具有潜在的抗氧化作用,可用于临床改善缺血性脑卒中带来的氧化应激损伤[11]。为阐明临床上参麦注射液的抗氧化应激机制,本研究体外系统研究了参麦注射液抗氧化性能,并与BHT(人工合成抗氧化剂)、Trolox(维生素E类似物,抗氧化能力与维生素E相当)和柠檬酸(天然抗氧化物质)3种常用抗氧化剂的体外抗氧化性能进行比较。
参麦注射液总抗氧化能力采用FRAP法进行分析。本结果说明参麦注射液样品中的含有某种抗氧化性活性成分,且10倍稀释参麦注射液总抗氧化能力高于柠檬酸,但低于BHT和Trolox。进一步证实参麦注射液具有体内抗氧化性能的物质基础。
DPPH·是一种稳定呈紫红色的自由基,在515nm波长处有最大的吸收峰。当溶液中有抗氧化成份存在时,可向DPPH·提供氢原子和电子,使其发生褪色。溶液吸光度值降低越多,说明抗氧化成份抗氧化性越强。不同稀释倍数的参麦注射液清除DPPH·的活性结果说明参麦注射液具有一定的清除DPPH·功能,其活性与柠檬酸相当,但低于BHT和Trolox。
NO·是活性氧自由基(ROS)家族中重要成员,在人体内可作为内皮细胞松弛因子、神经信号传导逆信使参与众多的炎症反应、肿瘤、脑卒中和其它退行性病理条件[12]。在本测试中,NO·由硝普钠提供,抗氧化物质清除后剩余的NO·在水溶液中氧化形成二氧化氮(NO2),并能够与Griess试剂反应生成在540 nm波长具有最大吸收峰的反应物。样品清除NO·活性越大,混合物吸光度值越低。不同稀释倍率的参麦注射液NO·清除活性结果证实了参麦注射液具有清除NO·能力,10倍稀释的参麦注射液NO·清除活性高于BHT、Trolox和柠檬酸。
H2O2是一个弱氧化物,虽然其自身氧化反应活性不强,但H2O2可快速地跨过细胞膜,并与膜内二价铁离子和二价铜离子反应生成羟基自由基,从而产生毒性[13]。因此,H2O2的清除是细胞或人体系统中非常重要的抗氧化防御能力。不同稀释倍率的参麦注射液H2O2清除活性结果,说明参麦注射液具有一定的H2O2活性,其活性与柠檬酸相当,但低于BHT和Trolox。
过渡金属Fe2+离子能够获得或失去自由电子,具有产生新自由基的能力。大多数ROS是线粒体电子转移和其它代谢反应过程中形成的副产物,而部分ROS则来源于过渡金属催化氧化反应。研究显示过量Fe2+离子造成的ROS氧化损伤与多种神经性疾病有关,如老年痴呆症、帕金森氏病等[14]。因此,过量Fe2+离子的清除具有重要意义,而通过对Fe2+离子的螯合反应能够降低ROS形成和氧化损伤。不同稀释倍率的参麦注射液对Fe2+离子螯合活性如图(I)和(J)所示,说明参麦注射液具有能螯合 Fe2+离子的成份,且螯合Fe2+离子活性高于BHT、Trolox和柠檬酸。
5 结论
文章系统性地评价参麦注射液的体外抗氧化活性,包括总抗氧化能力、清除DPPH·、NO·、H2O2和亚铁离子(Fe2+)螯合活性。结果显示参麦注射液具有一定的体外抗氧化能力,且活性呈浓度正依赖性。同时证实了参麦注射液对不同自由基清除能力存在差异。本研究结果将为参麦注射液抗氧化应激药理学机制提供体外实验数据解释。文章不足之处在于仅采用单一厂家生产的参麦注射液产品,同时未进行量-效关系分析。

