猪繁殖与呼吸综合征病毒非结构蛋白1α多克隆抗体的制备及应用
赵慧君 赵旭阳 史西保
摘要 以真核质粒pcDNA3.1-flag-nsp1α为模板,利用PCR扩增出nsp1α基因片段,构建原核重组载体pET32a-nsp1α,转化到大肠杆菌BL21(DE3)感受态,1 mmol/L IPTG在37 ℃诱导表达6 h,成功获得以包涵体形式存在的重组蛋白,能够与小鼠抗His标签单克隆抗体反应;包涵体复性后作为抗原免疫新西兰大白兔,3次免疫后20 d获得兔多抗血清。通过间接ELISA、Western blot、间接免疫荧光、免疫组化等试验获得了高效价的兔多抗血清,该血清能够特异性地识别真核质粒表达的nsp1α以及PRRSV BJ4株。该试验成功表达了pET32a-nsp1α重组蛋白,并制备了高效价、高特异性的兔抗nsp1α多克隆抗体。
关键词 PRRSV;nsp1α;多克隆抗体
中图分类号 S 852.65+1 文献标识码 A
文章编号 0517-6611(2019)12-0115-05
doi:10.3969/j.issn.0517-6611.2019.12.031
开放科学(资源服务)标识码(OSID):
Abstract Using eukaryotic plasmid pcDNA3.1flagnsp1α as a template,nsp1α gene fragment was amplified by PCR.The prokaryotic recombinant vector pET32ansp1α was constructed and transformed the pET32ansp1α into receptor state of Escherichia coli cells BL21 (DE3) to express the nsp1α by adding 1 mmol/L IPTG at 37 ℃.The recombinant protein nsp1α was obtained in the form of inclusion body ,which could react with His tag monoclonal antibody.The inclusion bodies after renaturation was used as antigen to immunize New Zealand white rabbit,rabbit polyclonal antiserum was obtained on the 20th day after three times of immunization.The results of indirect ELISA,Western blot,indirect immunofluorescence,immunohistochemistry showed that the rabbit polyclonal antibody with high titer were obtained,which could specifically identify nsp1α expressed by eukaryotic plasmid and BJ4 strains of PRRSV.The recombinant protein pET32ansp1α was successfully expressed,highspecificity rabbit antinsp1α polyclonal antibody with high tier was prepared.
Key words PRRSV;nsp1α;Polyclonal antibody
猪繁殖与呼吸综合征病毒(PRRSV)能够引起猪繁殖与呼吸综合征(PRRS),也称“蓝耳病”,其主要特征是母猪严重的繁殖障碍以及仔猪出现呼吸困难。该病自1987年在美国报道以来,已经蔓延至全球主要的养猪国家,是造成养猪业重大经济损失的主要疫病之一[1-2]。1996年郭宝清等[3]
从流产的猪胎儿中分离出PRRSV病毒,证实了我国也存在猪繁殖与呼吸综合征。2006年我国南方暴发由变异的PRRSV引起的高致病性猪繁殖与呼吸综合征,混合感染其他病原(如猪圆环病毒、猪链球菌、猪肺支原体等),造成了巨大的经济损失[4-5]。因此,研究PRRSV的致病机理,建立有针对性的防控措施对于养猪业的发展意义重大。
PRRSV基因组编码非结构蛋白的开放阅读框约占基因组全长的80%,首先翻译为包含所有非结构蛋白的多聚蛋白前体,nsp1α具有类木瓜蛋白酶样半胱氨酸蛋白酶活性,能够自我切割,从多聚蛋白上分离出来[6];同时,它还能抑制干扰素,对PRRSV逃逸宿主免疫机制具有重要的作用[7]。目前市场上尚无商品化的nsp1α抗体,笔者利用原核表达系统制备nsp1α的重组蛋白,免疫动物后获得抗nsp1α的多克隆抗体,可以用于检测PRRSV的感染情况,也为nsp1α的进一步研究提供了有用的试验材料。
1 材料与方法
1.1 质粒和毒株
真核质粒pcDNA3.1-flag-nsp1α、pcDNA3.1-flag、原核质粒pET32a由河南省农业科学院动物免疫学重点实验室保存;PRRSV BJ-4株由中国农业大学杨汉春教授惠赠。
1.2 主要试剂
Ex Taq酶、核酸胶回收试剂盒、限制性内切酶EcoRⅠ和HindⅢ、pMD18T载体、T4连接酶、大肠桿菌DH5α感受态细胞、大肠杆菌BL21(DE3)感受态细胞均购自TaKaRa公司;质粒回收试剂盒购自杭州爱思进生物公司;IPTG和氨苄霉素购自索莱宝生物公司;小鼠抗His标签IgG购自Proteintech公司;小鼠抗flag标签IgG、HRP-羊抗兔IgG、FITC-羊抗兔IgG均购自Abbkine公司;AEC酶底物试剂盒购自北京中杉金桥生物公司;Lipofectamaine2000购自Invitrogen生物试剂公司;其他常规试剂为国产分析纯试剂。
1.3 方法
1.3.1 扩增nsp1α基因片段。
以实验室构建的真核质粒pcDNA3.1-flag-nsp1α为模板,设计nsp1α(540 bp)上游引物:5GAATTCATGTCTGGGATACTTGATCGGTGCA3(下划线为EcoRⅠ酶切位点),下游引物5AAGCTTCATAGCACACTCAAAGGGGCAAAAGT3(下划线为HindⅢ酶切位点),由上海生工生物工程有限公司合成。PCR反应程序如下:94 ℃5 min;94 ℃30 s,55 ℃30 s;72 ℃90 s,94 ℃30 s,30个循环;72 ℃10 min;等温度降至16 ℃后,110 V电压下电泳30 min,使用凝胶成像仪拍照后切取目的基因片段回收。
1.3.2 原核重组质粒pET32a-nsp1α的构建。
nsp1α基因片段和质粒pET32a同时用EcoRⅠ、HindⅢ双酶切,37 ℃水浴3 h,核酸电泳并切胶回收目的片段,T4连接酶16 ℃水浴连接过夜,转化大肠杆菌DH5α感受态细胞,涂板氨苄抗性平皿12 h后,挑取单菌落到氨苄抗性LB培养基中,待菌液浑浊后PCR鉴定,阳性结果的菌液提取质粒,双酶切鉴定阳性后送至上海生工生物工程有限公司测序。
1.3.3 重组蛋白pET32a-nsp1α的表达及Western blot试验。
取上述鉴定的pET32a-nsp1α重组质粒转化大肠杆菌BL21(DE3)感受态细胞。挑取单菌落加入氨苄抗性LB培养基摇菌,待菌液浑浊后按1∶100取适量菌液加入新鲜的LB培养基继续摇菌。当OD600 nm为0.6左右时,取1 mL菌液作为对照,添加诱导剂IPTG至终浓度为1 mmol/L,分别在诱导1、2、4、6、8 h取1 mL菌液,12 000 r/min离心菌液1 min后弃上清,加600 μLPBS重悬;其中将诱导2、4 h收集的菌液重悬后超声破碎5 min,1 200 r/min离心1 min后吸出上清,沉淀用600 μL PBS重悬;将上述收集的样品加入5×SDS上样缓冲液稀释后,100 ℃水浴7 min左右,加样15 μL SDS-PAGE电泳。同时,取0 h和6 h样品进行Western blot鉴定,蛋白质电泳结束后,半干式转膜仪15 V电压转膜1 h,5%脱脂奶4 ℃封闭过夜;PBST洗涤后加1∶1 000倍稀释的小鼠抗His标签IgG,37 ℃孵育1 h;PBST洗涤后,1∶2 000倍稀释的HRP-羊抗鼠IgG 37 ℃孵育1 h;PBST洗涤后AEC显色。
1.3.4 重组蛋白pET32a-nsp1α的制备。
取新鲜的含pET32a-nsp1α重组质粒的菌液按1∶100加入200 mL氨苄抗性LB培养基中,按照步骤“1.3.3”探索的最佳表达条件诱导。然后,菌液8 000 r/min离心20 min,弃上清,加入缓冲液A(0.88 g NaCl、0.121 g Tris、0.292 g EDTA、0.03 g DTT,再加入PMSF使终浓度达到0.5 mmol/L,单蒸水定容至100 mL,调节pH为8.0,4 ℃下保存)20 mL,重悬后在冰水中放置10 min,超声破碎20 min;8 000 r/min离心20 min后收集上清,沉淀用缓冲液B(0.58 g NaCl、0.292 g EDTA、0.6 g Tris、0.03 g DTT,加入TritonX-100使终浓度达到1%,单蒸水定容至100 mL,再调节pH为8.0,4 ℃下保存)重悬,超声破碎2 min后8 000 r/min离心20 min,收集上清,加缓冲液B重复这一步骤;加2 mol/L尿素缓冲液(2.9 g NaCl、0.3 g Tris、0.145 g EDTA、0.015 g DTT、12 g尿素,单蒸水定容至100 mL,调节pH至8.0,4 ℃保存)20 mL重悬沉淀,超声破碎2 min后8 000 r/min离心20 min,收集上清;加8 mol/L尿素缓冲液(2.9 g NaCl、0.3 g Tris、0.145 g EDTA、0.015 g DTT、48 g尿素,单蒸水定容至100 mL,调节pH至8.0、4 ℃保存)20 mL,冰水中放置30 min,8 000 r/min离心10 min,收集上清即为重组蛋白的包涵体变性液[8]。将复性液装入已处理好的透析袋中,置于透析缓冲液,在4 ℃磁力搅拌进行梯度透析,缓冲液中尿素浓度依次递减至7、6、5、4、3、2、1、0.5和0 mol/L,每次换液间隔约6 h。最后,将透析袋中复性液4 ℃4 000 r/min离心5 min,取上清液保存。
1.3.5 多克隆抗体的制备及ELISA效价检测。
选取3只2月龄的新西兰大白兔,耳静脉采血作为阴性对照。将复性后的重組蛋白pET32a-nsp1α与弗氏完全佐剂乳化后背部多点注射,每只兔子免疫重组蛋白约350 μg;21 d后用等体积弗氏不完全佐剂乳化重组蛋白,免疫方式及剂量同首免。三免后20 d心脏采血,37 ℃放置30 min后,4 ℃放置过夜,收集析出的上清。4 000 r/min离心5 min,取上清即为兔抗nsp1α多克隆抗体血清,分装后-40 ℃下保存。以复性的重组蛋白包板,间接ELISA检测血清效价。用CBS将重组蛋白稀释至10 ng/μL,50 μL/孔包被酶标板后在4 ℃下放置过夜,PBST洗涤3次后每孔加5%脱脂奶200 μL在37 ℃放置2 h;PBST洗涤3次,兔血清用5%脱脂奶从500倍稀释开始以2倍倍比稀释到8 192 000倍,每孔加样50 μL,3个重复,设置阴性血清对照、空白孔对照等,37 ℃作用50 min;PBST洗涤3次,HRP-羊抗兔IgG用5%脱脂奶1∶4 000倍稀释后每孔加50 μL,37 ℃作用50 min;PBST洗涤3次,加入TMB显色液(底物液A为四甲基联苯胺0.2 g,无水乙醇10 mL,加双蒸水定容至100 mL;底物液B为磷酸氢二钠1.46 g,柠檬酸0.933 g,30%过氧化氢0.05 mL,双蒸水定容至100 mL,pH 5.0;使用时底物液A和B按1∶1的比例混合),50 μL/孔,避光显色5 min后加入50 μL 2 mol/L H2SO4终止反应;酶标仪于450 nm波长下读数,兔血清OD值/阴性血清OD值>2.1(P/N>2.1)的最高稀释倍数即为血清效价。
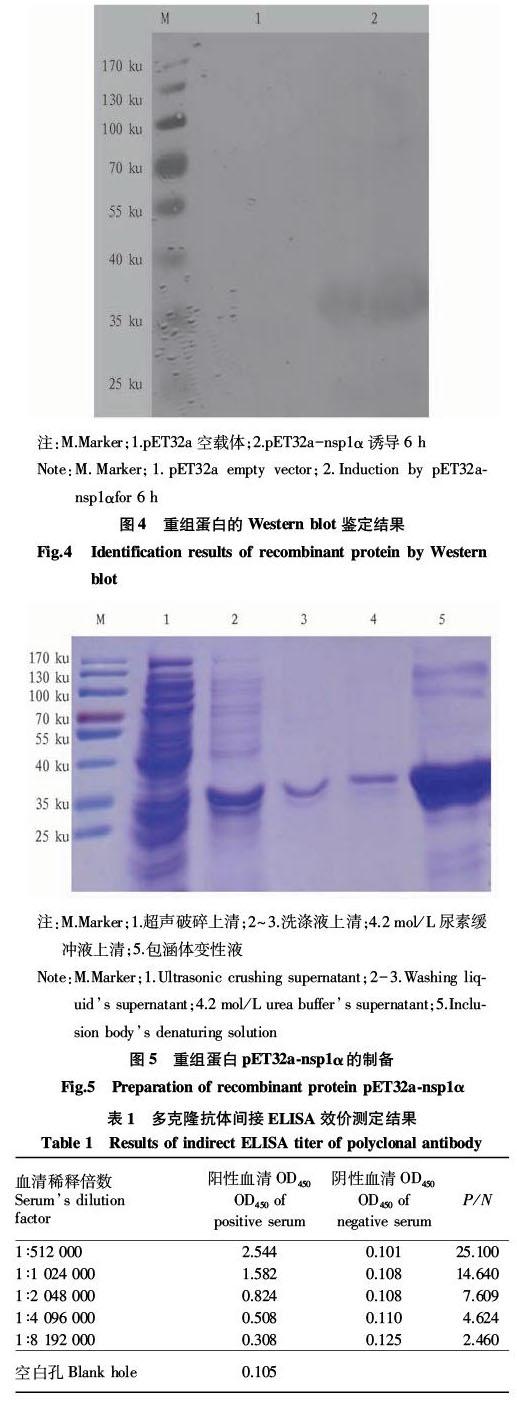
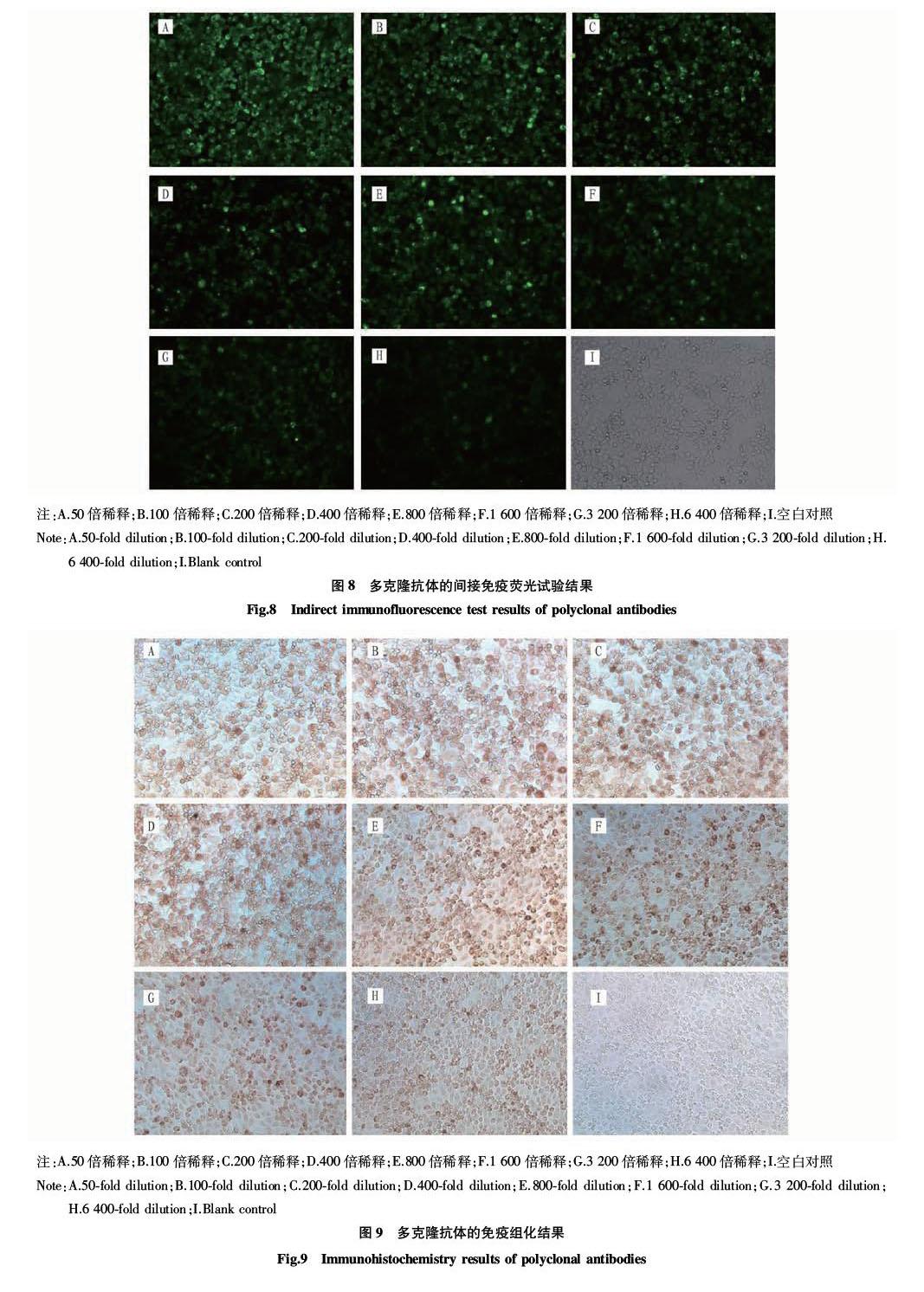
利用获得的抗nsp1α多克隆抗体进行Western blot、间接免疫荧光、免疫组化等一系列试验。试验结果验证了多克隆抗体的特异性和高效价,也显示制备的多克隆抗体能识别真核質粒表达的nsp1α以及PRRSV BJ4株。这为进一步研究nsp1α提供了有用的试验材料,并且还能用于检测PRRSV的感染情况。
参考文献
[1]GOYAL S M.Porcine reproductive and respiratory syndrome[J].Journal of veterinary diagnostic investigation,1993,5(4): 656-664.
[2] WENSVOORT G,TERPSTRA C,POL J M A,et al.Mystery swine disease in the Netherlands: The isolation of Lelystad virus[J].Veterinary quarterly,1991,13(3): 121-130.
[3] 郭宝清,陈章水,刘文兴,等.从疑似PRRS流产胎儿分离PRRSV的研究[J].中国畜禽传染病,1996(2): 3-7.
[4] TIAN K H,YU X L,ZHAO T Z,et al.Emergence of fatal PRRSV variants: Unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark[J].PLoS One,2007,2(6):e526.
[5] TONG G Z,ZHOU Y J,HAO X F,et al.Highly pathogenic porcine reproductive and respiratory syndrome,China[J].Emerging infectious diseases,2007,13(9):1434-1436.
[6] ZIEBUHR J,SNIJDER E J,GORBALENYA A E.Virusencoded proteinases and proteolytic processing in the Nidovirales[J].Journal of general virology,2000,81(4):853-879.
[7] SHI X B,ZHANG G P,WANG L,et al.The nonstructural protein 1 papainlike cysteine protease was necessary for porcine reproductive and respiratory syndrome virus nonstructural protein 1 to inhibit interferonβ induction[J].DNA and cell biology,2011,30(6):355-362.
[8] 王寅彪.猪繁殖与呼吸综合征病毒GP5截短蛋白的表达及其ELISA抗体检测方法的初步建立[D].郑州:河南农业大学,2012.
[9] TERPE K.Overview of bacterial expression systems for heterologous protein production:From molecular and biochemical fundamentals to commercial systems[J].Applied microbiology and biotechnology,2006,72(2):211-222.
[10] 董文博,陈洪栋,郝建国,等.用于药用蛋白生产的外源表达系统[J].基因组学与应用生物学,2009,28(4):793-802.

