海生红藻多管藻中2种R-藻红蛋白的分离与分析
刁海平,侯翠英,赵明日,孙 力
(烟台大学生命科学学院,山东 烟台 264000)
红藻主要分布在海洋中,以底栖大型藻类为主,富含R-藻红蛋白(phycoerythrin, PE),其含量可高达R-藻蓝蛋白(或R-别藻蓝蛋白)含量的6~8倍,这意味着在红藻藻胆体的棒结构域中,1个六聚体藻蓝蛋白对应有6~8个六聚体藻红蛋白,与蓝藻藻胆体相比,这种高比例R-藻红蛋白含量不仅给红藻藻胆体结构研究带来诸多困难[1-3],而且成为探究红藻藻胆体中R-藻红蛋白的结构特性、相互机制及其在棒结构域中的组装方式等红藻藻胆体结构功能的关键内容之一.虽然有关藻胆体的研究始于单细胞红藻紫球藻(Porphyridiumcruentum),但到目前为止关于藻胆体结构功能研究报道主要来自蓝藻[4-6],红藻尤其是大型红藻藻胆体的研究报道很有限,近些年在红藻藻胆体结构功能方面出现了一些进展性的研究报道,如紫球藻半球形藻胆体在类囊体膜上的分布及其与代谢的相关性[1,7], 藻胆体与与光反应系统的能量传递[8-9],藻胆体连接多肽[10]和以冷冻电镜为基础的红藻Griffithsiapacifica的Block-type藻胆体的模拟重构研究[11].本实验所用的材料为海生红藻多管藻,属于红藻门,真红藻纲,仙菜目,松节藻科,多管藻属,是中国黄渤海及东海沿岸常见的种类,在实验室前期研究工作中顺序进行离子交换层析和两种凝胶过滤(Sephadex G-150 (G-150), Sephacry S-300 (S-300)),从多管藻(Polysiphoniaurceolata)中分离纯化出2种分子质量相同的R-PE(R-PEI和R-PEII)[12].这一结果证明,多管藻含有在表面电荷特性上表现出差异的2种不同结构类型的六聚体R-藻红蛋白,但非变性等电聚焦分析表明含量高的R-PEII为单一窄带,而含量较小的R-PEI为一较宽的条带.R-PEI的这种宽带揭示离子交换层析所得R-PEI组分可能还没有达到完全均一的程度.
为进一步研究确定多管藻中2种R-PE的结构特性,本研究依据多维层析原理,在凝胶过滤(S-300)分离之后联合使用DEAD SepharoseFast Flow离子交换层析和Butyl Sepharose 4 Fast Flow疏水相互作用层析,借助于静电荷与疏水性这2种结构特性进行R-PE分离纯化.这一结果将为多管藻藻胆体中R-藻红蛋白之间形成复合体,实现棒结构域组装及其结构稳定性提供一定的数据与理论支持.
1 材料与方法
1.1 藻胆蛋白样品提取[13]
本实验的材料多管藻采于2月下旬烟台栈桥附近海域.将采集的多管藻浸泡在质液体积比为1∶3的50 mmol/L磷酸缓冲液(PBS,pH值7.0) 中48~72 h,抽滤、离心(15 000 ×g,8 ℃,15 min)除不溶物,收集上清液用1 000 kU和50 kU膜包,收取50~1 000 kU的蛋白并浓缩至R-PE的A498(498 nm的吸光度)约为7.0.浓缩后的藻胆蛋白提取液避光于4 ℃冰箱冷藏保存,用于进一步实验.
1.2 2种藻红蛋白的分离纯化
1.2.1 S-300凝胶过滤层析[14]参考本实验室前期工作,使用Sephacry S-300(10~1 500 kU) (Vt=5 cm×48 cm)凝胶过滤对多管藻藻胆蛋白提取液初步分离.凝胶过滤时用280 nm光吸收(A280)实时跟踪、检测洗脱曲线.以层析样品中A498/A280值为参照,按照洗脱曲线的洗脱峰收集R-PE组分,使用50 kU超滤膜包将所得藻红蛋白样品浓缩至A498约为2.避光于4 ℃冷藏保存样品,用于下一步分离纯化.
1.2.2 离子交换层析 本实验采用弱碱型阴离子交换剂 DEAE Sepharose Fast Flow (Vt=2.4 cm×4.2 cm)对凝胶过滤所得的脱盐R-PE进行分离纯化.选用50 mmol/L PBS溶解各250 mL的50 mmol/L和300 mmol/L NaCl溶液进行线性梯度洗脱,洗脱流速为30 mL/h.样品收集与凝胶过滤方法类似,根据洗脱曲线收集离子交换洗脱峰内的R-PEI、R-PEII组分备用.
1.2.3 疏水作用层析 根据蛋白疏水性不同,选用Butyl Sepharose 4 Fast Flow疏水层析对离子交换层析后的R-PEI和R-PEII组分进行纯化.离子交换层析收集的R-PEI和R-PEII组分加200 mmol/L (NH4)2SO4处理后分别进行疏水层析,选用50 mmol/L PBS溶解的各200 mL的450 mmol/L和200 mmol/L (NH4)2SO4溶液进行线性梯度洗脱,洗脱流速为24 mL/h.根据洗脱曲线收集疏水层析洗脱峰内的R-PEI、R-PEII组分.
1.3 聚丙烯酰胺凝胶电泳
1.3.1 Native-PAGE Native-PAGE选择Bis-Tris-HEPES-MES中性电泳系统,分离胶浓度8%(C 3%),pH值 7.0的Bis-Tris-HEPES-MES,浓缩胶胶浓度为4%(C 20%),pH值 5.75的Bis-Tris-MES-乙酸;正极电极液为40 mmol/L咪唑-乙酸(pH值 6.5),负极电极液为40 mmol/L Bis-Tris-Tricine(pH 6.5).
稳流方式电泳,在365 nm紫外光下观察电泳条带荧光,取胶后固定,考马斯G-250染色,观察记录结果.
1.3.2 非变性等电聚焦 非变性IEF要求有稳定的pH梯度,选择6.5%(C3%)的聚丙烯酰胺凝胶,用3% pH值 4.0~6.5的载体两性电解质做缓冲剂,正极电极液为0.25 mol/L柠檬酸溶液,负极电极液为0.25 mol/L的6-氨基己酸溶液,采用300 V稳压电泳对R-PEI和R-PEII进行等电聚焦电泳.
电泳条带不再移动时停止电泳,在365 nm紫外光下观察电泳条带荧光,取出胶条后固定,考马斯G-250染色,观察记录结果.
1.3.3 SDS-PAGE SDS-PAGE选择Tris-HCl电泳系统,分离胶浓度为T=13%(C3%),分离胶缓冲液为0.375 mol/L Tris-HCl (pH值 9.1),浓缩胶浓度为T=5% (C3%),浓缩胶缓冲液为61.75 mmol/L Tris-HCl (pH值 6.8),电极缓冲液为Tris-Gly (pH值 8.3, Gly 0.192 mmol/L),内含0.1%(W/V)SDS,用来进行R-PEI与R-PEII的多肽组成及分子质量分析.
纯化浓缩的R-PEI与R-PEII样品用三氯乙酸沉淀后离心清洗3~4次,干燥残留水分后与SDS样品溶解液溶解,60 ℃水浴保温30 min,离心后取上清液上样,以稳流方式电泳.
电泳结束后先通过锌染在365 nm紫外光下观察SDS-PAGE凝胶板含发色团的亚基荧光条带,之后进行固定,考马斯G-250染色,观察记录考染结果.
1.4 光谱测定
选用紫外可见分光光度计(UV-190型,北京普析),以50 mmol/L PBS磷酸缓冲液为空白对照,测量650 nm(R-AP特征吸收峰)、618 nm(R-PC特征吸收峰)、498 nm(R-PE特征吸收峰)及280 nm处的吸光度绘制R-PE、R-PC/AP洗脱曲线,对于各阶段的样品进行吸收光谱测定.
1.5 荧光光谱测定
将收集到的纯化的R-PEI和R-PEII样品使用荧光分光光度计(LS55)进行Ex=498 nm荧光发射和Em=615 nm激发光谱的测定,并绘制R-PEI和R-PEII的荧光光谱.
2 实验结果分析
2.1 藻胆蛋白提取液的S-300凝胶过滤分离
由R-PE的光吸收系数K498=4.80 mL/(mg·cm)知,藻胆蛋白粗提取液(A498=7.73)中R-PE的含量为1 552 μg/mL,S-300凝胶过滤的结果如图1所示, 498 nm洗脱曲线具有2个洗脱峰,这是由于六聚体R-PE和小于六聚体的R-藻红蛋白(SR-PE)在波长498 nm时均具有特征吸收,618 nm为别藻蓝蛋白特征吸收,650 nm为藻蓝蛋白特征吸收.依据分子质量的大小, R-PE、R-PC/AP、SR-PE依次被洗脱,R-PE的洗脱曲线与R-PC有部分重叠,按照A498洗脱曲线的完整洗脱峰,回收R-PE.从图2吸收光谱可以看出,在618 nm处有一小峰,综合图1洗脱曲线可知,收集的R-PE中混杂了部分R-PC,需要进一步分离纯化.
综上所述,超声心动图可以很准确、直观以及对心脏结构和功能情况进行动态观察,是评估尿毒症透析患者心脏状况比较简便敏感、安全可靠的检查方法,值得推广及应用。
2.2 R-PE组分的离子交换层析
依据多维层析原理,首先使用DEAE Sepharose Fast Flow离子交换层析,借助静电荷差异对S-300所得R-PE组分进一步分离纯化.根据洗脱的先后顺序,将先洗脱下来的组分命名为R-PEI,后洗脱下来的组分命名为R-PEII.

图1 藻胆蛋白提取液的S-300凝胶过滤
Fig.1 The gel filtration of the extracted phycobiliprotein solu-tion performed by the S-300 gels

图2 S-300后R-PE吸收光谱
Fig.2 The absorption spectra of the R-PE fraction obtained from the S-300 gel filtration
在此过程中对离子交换的洗脱条件进行探索,依次使用了0~500 mmol/L NaCl梯度和0~400 mmol/L NaCl梯度进行洗脱,洗脱曲线如图3所示.图3A中在洗脱体积为120 mL、NaCl浓度为120 mmol/L处出现一个洗脱峰,R-PEI和R-PEII未得到有效分离,分离效果较差;图3B中在洗脱体积为145 mL、NaCl浓度为116 mmol/L处出现一个肩峰,是R-PEI,在洗脱体积175 mL、NaCl浓度为140 mmol/L出现一个洗脱峰为R-PEII,R-PEI和R-PEII分离效果有改进,但不理想,因此考虑将NaCl梯度变缓,选择50~300 mmol/L的NaCl梯度洗脱对离子交换层析做进一步优化.
如图4所示,更换条件后,S-300凝胶过滤后的R-PE组分经过50~300 mmol/L NaCl梯度洗脱,依次洗脱下2个组分:R-PEI组分出峰位置在洗脱体积185 mL处,此处NaCl 浓度为142.5 mmol/L;R-PEII组分出峰位置在洗脱体积约235 mL处,此处NaCl 浓度为167.5 mmol/L.根据洗脱曲线,观察到R-PEI和R-PEII的有效分离.
分子大小相同的六聚体R-藻红蛋白R-PEI和R-PEII,在离子交换层析中的行为(图4)表明:先洗脱下来的R-PEI与离子交换剂有较弱的静电相互作用,在较低的盐浓度即可被洗脱;而后洗脱下来的R-PEII则与离子交换剂有较强的静电相互作用,需要较高的盐浓度才可被洗脱.这一结果证明,R-PEI和R-PEII是2种在表面电荷这一结构特性上有差异的六聚体R-藻红蛋白,因为蛋白质与离子交换剂的结合强弱取决于其分子表面能够与离子交换剂相互作用的静电荷数目、分布及密度.
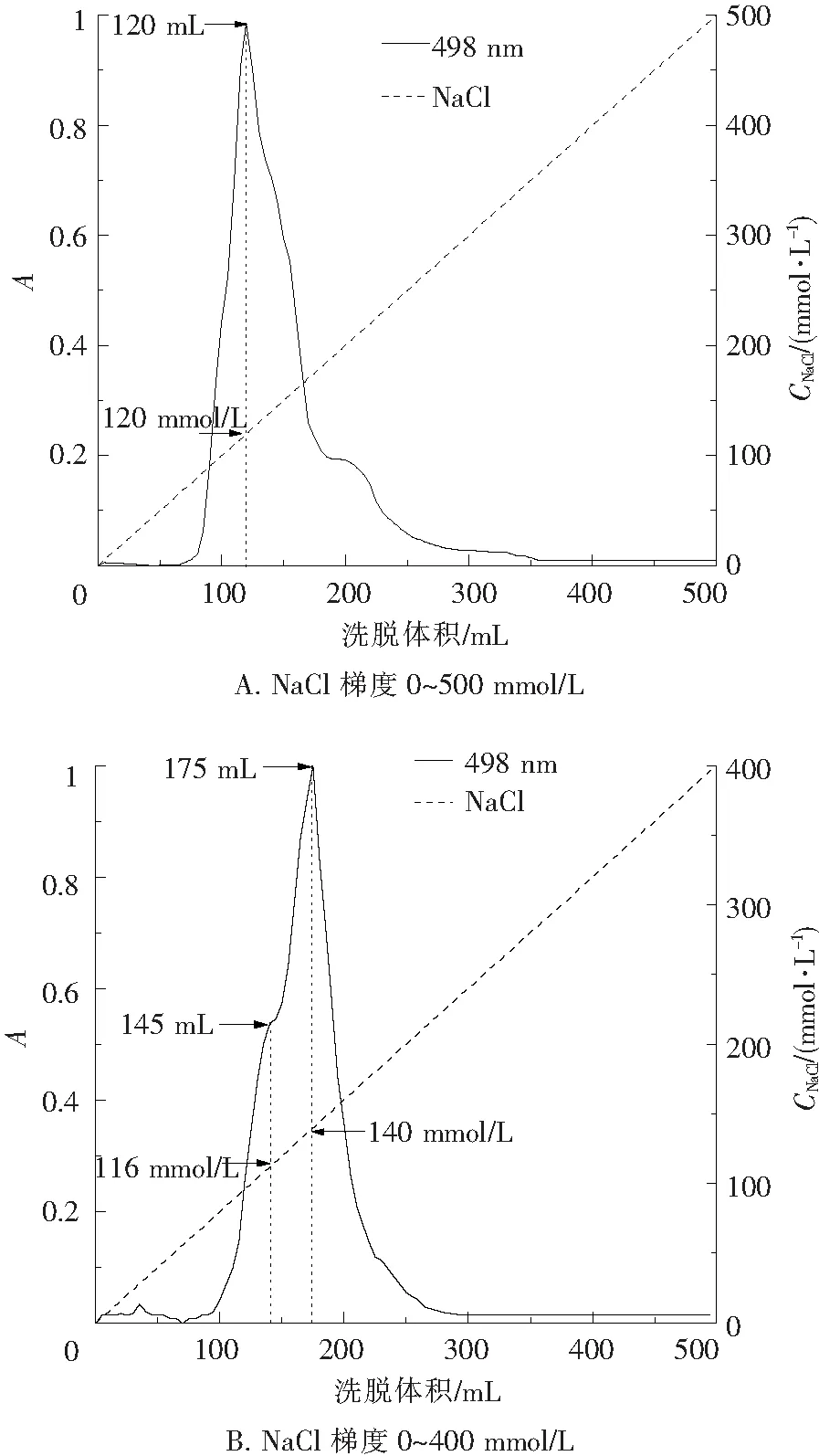
图3 R-PE组分的DEAE Sepharose Fast Flow离子交换层析洗脱曲线
Fig.3 The elution curve of the ion exchange chromatography of the R-PE fraction on DEAE Sepharose Fast Flow

图4 R-PE组分的DEAE Sepharose Fast Flow(NaCl 梯度50~300 mmol/L)离子交换层析洗脱曲线
Fig.4 The elution curve of the ion exchange chromatography of the R-PE fraction on DEAE Sepharose Fast Flow(NaCl gradient 50-300 mmol/L).
两者的吸收光谱见图5,R-PEI和R-PEII的吸收光谱并无明显差别,R-PEI在618 nm处有一小峰,为R-PC特征吸收,根据实验室前期工作可知,在离子交换层析中R-PC的洗脱曲线与R-PEI洗脱曲线有部分重叠[14],因此收集的R-PEI含有少量的R-PC.R-PEI的蛋白纯度为A565/A280=4.27,R-PEII的蛋白纯度为A565/A280=4.43,分别收集R-PEI与R-PEII,进一步探究2种R-藻红蛋白在疏水性上的差异并纯化样品.

图5 经过离子交换层析所得R-PEI与R-PEII吸收光谱
Fig.5 The absorption spectra of the R-PEI and R-PEII frac-tions obtained from the ion exchange chromatography
2.3 R-PEI和R-PEII的疏水层析
离子交换后收集的R-PEI组分和R-PEII组分分别使用Butyl Sepharose 4 Fast Flow疏水层析的方法进一步分离纯化,实验结果如图6所示.
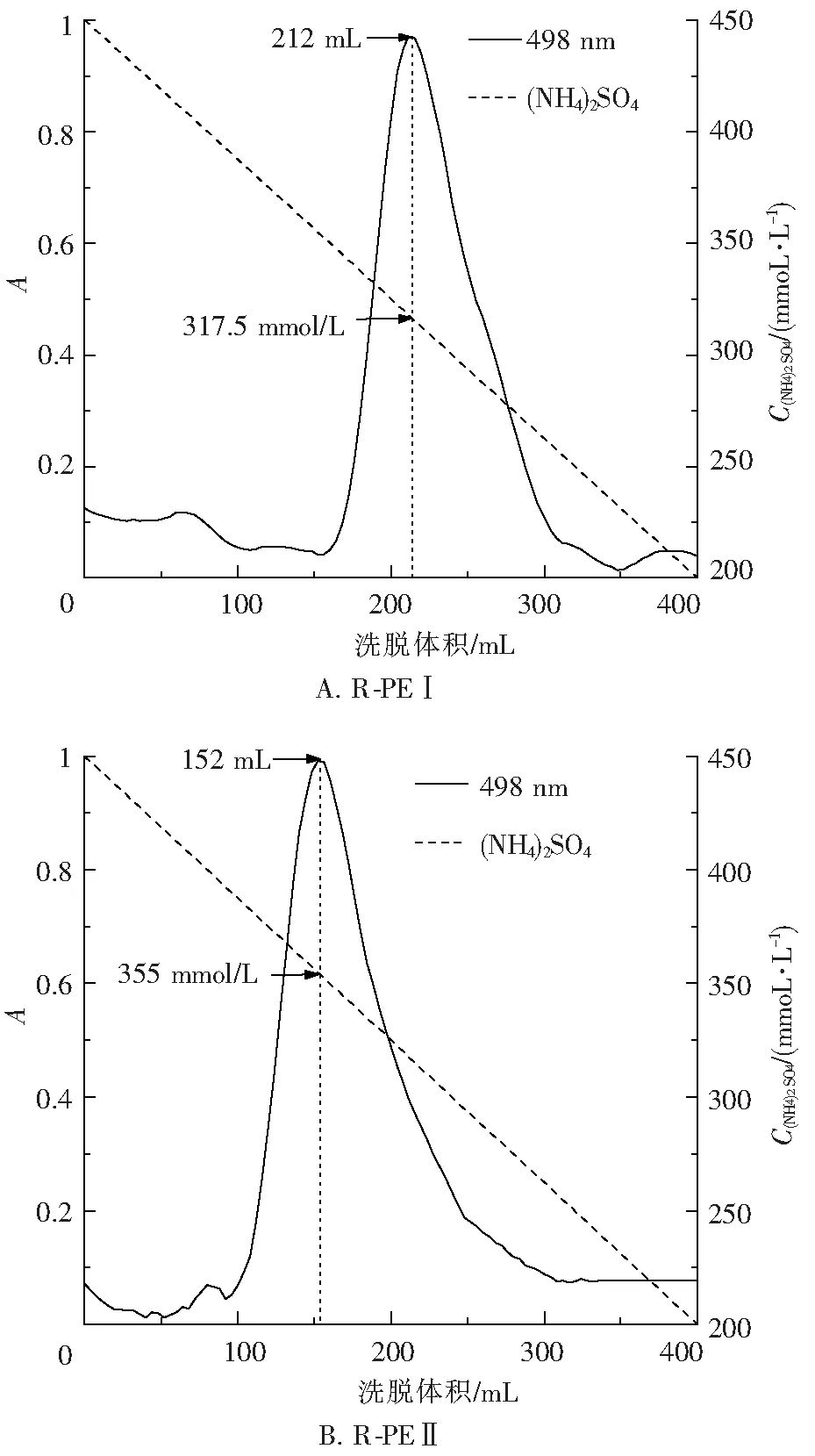
图6 R- PEI(A)、R-PEII(B)组分的Butyl Sepharose 4 Fast Flow疏水层析洗脱曲线
Fig.6 Elution curves of the hydrophobic interaction chromatog-raphy of the R-PEI(A) fraction and R-PEII(B) fraction on Butyl Sepharose 4 Fast Flow
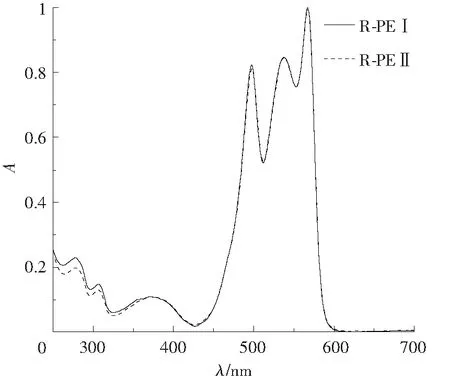
图7 经过疏水作用层析后R-PEⅠ与R-PEⅡ吸收光谱
Fig.7 The absorption spectra of the PEⅠ and PEⅡ fractions obtained from the hydrophobic interaction chromatography
2.4 R-PEI和R-PEII荧光光谱特性
图8为在498 nm波长激发疏水层析后R-PEI和R-PEII的荧光发射光谱,从图8可以看出R-PEI和R-PEII的荧光发射峰均位于577 nm处,二者并无明显区别,来自于藻红胆素.图9为疏水层析所得的R-PEI和R-PEII在615 nm发射波长下荧光激发光谱,与吸收光谱峰型相近,R-PEI和R-PEII有3个特征峰,说明能量在色基中传递是良好的,所提取的是完整的R-藻红蛋白,可用于进一步R-藻红蛋白的亚基分析.
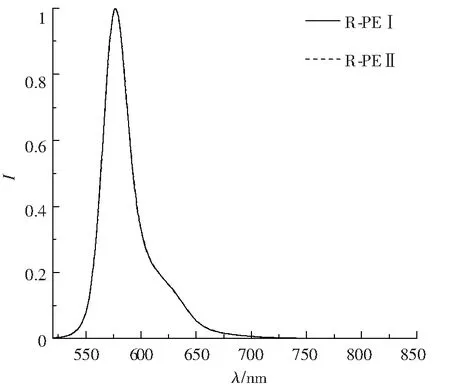
图8 疏水层析相互作用后R-PEI与R-PEII荧光发射光谱(Ex=498 nm)
Fig.8 The fluorescence emission spectra of the R-PEI and R-PEII fractions obtained from the hydrophobic interactionfigure_titlechromatography (Ex=498 nm)

图9 疏水相互作用层析后R-PEI与R-PEII荧光激发光谱(Em=615 nm)
Fig.9 The fluorescence excitation spectra of the R-PEI and R-PEII fractions obtained from the hydrophobic interac-tion chromatography purification(Em=615 nm)
图8和图9表明,R-PEI和R-PEII之间荧光光谱特性没用明显不同,其吸收光谱(图7)也仅在紫外光区(250~400 nm)表现出差异,在可见光区(400~750 nm)几乎完全相同.这些结果表明,R-PEI和R-PEII在带电性和疏水性上所表现的结构特性差异没有涉及或干扰其六聚体所携带的各发色团微环境,R-PEI和R-PEII在250~400 nm紫外光区(图7)光吸收的不同应主要来自于产生带电性和疏水性结构特性差异的多态链.
2.5 非变性PAGE和IEF
从图10结果可以看出R-PEI和R-PEII在365 nm光下只显示1条条带,考染后除了溴酚蓝也仅显示1条单一条带,制备的R-PEI和R-PEII纯度较纯,没有杂蛋白干扰.

a、c为紫外光365 nm下的荧光条带;b、d为考染条带
pH梯度4.0~6.5的非变性等电聚焦结果如图11所示,经过疏水作用层析纯化的R-PEI与R-PEII均得到了单一的条带,表明已经获得了较高的纯度,可以用于进一步的实验.通过对其等电点的测定,R-PEI的等电点在4.7,R-PEII的等电点在4.6, 2种藻红蛋白的等电点相差0.1个单位, 表明了2种藻红蛋白表面静电荷存在较小的差异.

a、c为紫外光365 nm下的荧光条带;b、d为考染条带
Fig.11 The native isoelectric focusing of R-PEI and R-PEII fractions
2.6 SDS-PAGE
纯化得到的R-PEI和R-PEII在非变性聚丙烯酰胺凝胶电泳中并无明显区别,因此选用SDS-PAGE分析2种R-藻红蛋白的多肽组成,并测定各亚基或多肽的分子质量,结果如图12所示,1、2、3、4、5、6、7、8分别为无色连接多肽、(βγ1)、(αβ)、γ1、γ2、β、α[15]和未完全解离的R-PE.

a、b、e为紫外光365 nm下的荧光条带;c、d、f为考染条带
Fig.12 The SDS-PAGE of the R-PEI and R-PEII fractions from hydrophobic interaction
R-PEI和R-PEII具有相同的α、β、γ1和γ2,分子质量分别为18.2 kU、21.5 kU、38.0 kU和33.6 kU,44.6 kU处为(αβ)复合体,52.5 kU处为(βγ1)复合体,77.2 kU处的带是在锌染时无荧光,而考染出现条带,推测其为无色连接多肽,由于上样蛋白浓度过高,因此存在不完全解离的R-PE,通过图12的结果,可以推断出在R-PEI和R-PEII在亚基组成上并无明显差别,R-PEI和R-PEII在带电性和疏水性等结构特性方面所表现出的差异与其亚基或多肽组成并不直接相关.综合R-PEI和R-PEII光谱数据,明显不同仅表现在250~400 nm 的光吸收(图7),其在400~750 nm的可见光吸收(图7)以及荧光光谱(图8、图9)几乎完全相同.显然,同时印证了R-PEI和R-PEII之间的结构特性差异并没有涉及到其所含发色团构象及其微环境.
3 结 论
海生红藻多管藻富含R-PE,本实验室借助分子质量差异,通过凝胶过滤对R-PE和R-PC/AP进行有效分离.综合本研究数据以及实验室前期工作发现R-PE与R-PC/AP在离子交换中和疏水层析中均存在静电荷的和疏水性差异[13-14,16],根据这一结果,为实现高含量R-藻红蛋白与低含量R-藻蓝蛋白和别藻蓝蛋白的联合制备提供了便利.
本实验中分离纯化的R-PEI与R-PEII在native-PAGE(图10)和非变性IEF(图11)中均表现为单一条带,表明取得了理想的分离纯化效果.层析结果表明带有较少负电荷的R-PEI具有较强的疏水性,而带有较多负电荷的R-PEII则具有相对较弱的疏水性,补充说明了多管藻中R-PEI和R-PEII不仅在静电荷上存在明显差异,在疏水性上也存在明显的差异,根据六聚体R-PE在250~400 nm 紫外光吸收差别,推测其结构特性差异应与他们的多肽链构象及其氨基酸残基相关,但产生结构特性不同的直接原因还需通过进一步研究予以证实.
目前虽然对于来自不同红藻的藻红蛋白的相关研究报道有很多,但几乎都是针对主含量藻红蛋白,对同一藻种中2种或2种以上、具有不同结构特性藻红蛋白研究却非常少.由于在同一藻种中藻红蛋白是结构与光物理特性均很相似的一类蛋白,建立可从同一红藻样品的藻红蛋白中有效分离纯化结构特性仅有细微差异的不同结构类型藻红蛋白的方法,为深化红藻藻胆体棒结构域中藻红蛋白间相互作用及其有序组装机制、藻胆体研究及红藻藻胆体棒结构域有序组装等研究提供有价值的实验技术与理论依据.

