水曲柳FmWRKY44基因克隆及表达分析
李新宇 何利明 詹亚光,2*
(1.东北林业大学生命科学学院,哈尔滨 150040; 2.东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040)
WRKYs转录因子是植物特有的一类转录因子家族,在拟南芥(Arabidopsisthaliana)中共发现了74个基因[1],在水稻(Oryzasativa)中有109个成员[2]。每个WRKY转录因子的DNA结合域中都至少含有一个WRKY结构域,该结构域是一段大约60个氨基酸所组成的多肽序列,在其氨基(N)末端含有由WRKYGQK7个氨基酸组成的保守结构域。在其羧基(C)末端有一个锌指结构[3~4]。根据WRKY结构域的数目和其锌指结构的组成可以将WRKY家族分为3个亚家族。第一类(Ⅰ)一般含有2个WRKY结构域,但只有C末端行使功能,N段的WRKY结构域辅助C端的结构域行使作用。其锌指结构的组成为CX4-5CX22-23HXH(X为非保守氨基酸)。第二类(Ⅱ)只含有1个WRKY结构域,其锌指结构仍为CX4-5CX22-23HX1H。第三类(Ⅲ)也只含有1个WRKY结构域。但其锌指结构发生了改变,为CX7CX23HX1C。不同的WRKY亚家族有着不同的与DNA的结合能力,在进化上也是从第一类亚家族进化到第二、三类亚家族[5~7]。
转录调控是通过细胞或生物有机体来控制基因表达的重要机制。WRKY转录因子作为植物中最大的转录因子家族之一,在调控植物应对非生物胁迫的响应中起重要作用[8]。最近研究中,过表达的转ZmWRKY106基因玉米植株提高了对干旱和高温胁迫的耐受性[9],菊花DgWRKY2基因可以增强其对盐胁迫的耐受性[10],虎杖PcWRKY33可以增加细胞的活性氧(ROS)水平来降低耐盐性[11],水稻OsWRKY71应对冷害胁迫中起重调控作用[12],黄瓜CsWRKY46通过ABA信号使转基因植株抗寒[13]。最新研究还显示拟南芥转录因子AtWKRY13能激活PDR8表达正向调节其对镉的抗性[14]。同时大量的研究表明,WRKY转录因子不仅参与植物对非生物胁迫的应答,同时也参与调控植物的激素信号通路以及生长发育。如转录因子WRKY18、WRKY40和WRKY60参与拟南芥对ABA信号的响应[15]。AtWRKY39可以被SA或MeJA诱导[16],并协同参与SA和JA信号通路,基因OsWRKY24,OsWRKY53和OsWRKY70对剂量依赖性调节GA和ABA信号传导的负转录调节剂起作用[17],AtWRKY75可以调节DELLA蛋白促进拟南芥开花[18]。
水曲柳是我国东北地区主要的造林树种和品质优良的用材树种,能在-40℃下存活,在抗寒方面有着优良的基因资源[19],在改良植物抗寒性的基因工程的应用上有巨大潜力。目前,关于水曲柳基因报道较少,对抗逆相关的WRKYs转录因子的报道也仅有一例[20]。为此,本研究从水曲柳转录组中克隆了FmWKRY44基因,对其进行了生物信息学分析,探索了该基因在不同组织中以及不同激素和非生物胁迫下的表达特点,为水曲柳抗寒基因资源的利用奠定了一定理论基础。
1 材料与方法
1.1 实验材料及试剂
Takara植物RNA提取试剂盒(9767),Takara LATaq(RR02MQ),Takara DL2000 Marker,全式金反转录试剂盒(AH311),全式金定量反转录试剂盒(AH341),Takara SYBR Green定量试剂盒(RR802A),OMEGA琼脂糖凝胶DNA回收试剂盒。
1.2 实验方法
1.2.1 总RNA提取与反转录
使用Takara植物RNA提取试剂盒(9767)提取水曲柳叶片总RNA。用1%琼脂糖检测所提取RNA质量,并用紫外分光光度计测定RNA的纯度和浓度。使用全式金反转录试剂盒(AH311)进行cDNA第一链合成。
1.2.2 引物设计及目的基因克隆
参照水曲柳基因转录组序列,设计FmWRKY44基因特异性引物(FmWRKY44-F:5′-TTTGCCTTCGACACTTCTCA-3′,FmWRKY44-R:5′-GGAAGTCAGTTCCTTGAGTGT-3′)。进行PCR反应,扩增目的基因,反应体系:10×LATaqBufferⅡ 2 μL,dNTPs(2.5 mmol·L-1each)1.6 μL,FmWRKY44-F(10 pmol·μL-1)1 μL,FmWRKY44-R(10 pmol·μL-1)1 μL,水曲柳cDNA 1 μL,LATaq(5 units·μL-1)0.4 μL,用ddH2O补足至20 μL。反应程序:94℃预变性4 min;94℃变性30 s,50~55℃退火30 s,72℃延伸1 min 30 s进行35个循环;72℃延伸10 min。取2 μL PCR产物,于1.0%琼脂糖凝胶电泳检测。确认目的条带后,用2.0%琼脂糖凝胶电泳分离目的条带,并用琼脂糖凝胶电泳试剂盒回收。回收产物链接pEASY-T5载体,转入大肠杆菌Trans-T1感受态细胞,37℃培养过夜,选取阳性结果菌液,送至上海生物工程有限公司测序验证。
1.2.3 FmWRKY44的生物信息学分析
运用NCBI ORF Finder在线软件分析查找基因的开放阅读框。利用DNAMAN软件对因的cDNA序列进行分析,并推测得到其蛋白质编码氨基酸序列。使用在线分析软件Protparain对蛋白的理化性质进行分析。使用在线分析软件ProtScale对蛋白进行亲水性/疏水性分析。使用在线分析工具SignalP的神经网络算法对蛋白进行信号肽的预测和分析。使用在线工具TMPred对蛋白的跨膜结构进行预测和分析。利用SOPMA在线工具分析蛋白的二级结构组成。与NCBI上其他物种同源蛋白序列进行比对分析,然后使用MEGA7软件,构建进化树。使用在线多序列比对软件PRALINE(http://www.ibi.vu.nl/programs/pralinewww/)对蛋白与其它不同物种中同源蛋白序列进行详细的多序列比对分析。使用SMART在线分析软件对WRKY44蛋白的保守结构域进行预测。
1.2.4 实验材料及处理
本研究所用的组织材料为本实验室培养的水曲柳愈伤组织和水曲柳种子组培培养30 d的幼苗。根、茎、叶取自水曲柳3年生盆栽苗。按照表1中处理方法对实验材料进行处理。

表1 实验材料处理方法及处理时间
1.2.5 实时荧光定量分析
以水曲柳种子、愈伤组织、根、茎、叶和组培苗作为材料,应用RNA提取试剂盒(minibest,9769)提取总RNA。应用全式金qRT-PCR试剂盒(AH341)将RNA反转录为cDNA。以F:5′-GGGAGGGACAACCTTATTCG-3′;R:5′-CCTTTGACTTGCTTCTGACCAT-3′为FmWRKY44引物,以FmTu(F:5′-AGGACGCTGCCAACAACTTT-3′;R:5′-TTGAGGGGAAGGGTAAATAGTG-3′)为内参基因。采用ABI PRISM7500实时荧光定量系统进行基因表达分析。反应体系:模板cDNA 1 μL(10 ng·μL-1),2×SYBR Premix ExTaq10 μL,Rox reference DyeⅡ 0.4 μL,primer F 0.8 μL,primer R 0.8 μL,加水补足至20 μL。反应程序:95℃ 1 min;95℃ 10 s,60℃ 30 s,72℃ 35 s进行40个循环。采用2-ΔΔCT法分析数据,计算FmWRKY44基因相对表达量。每个取样点设置3次生物学重复,qRT-PCR设置3次技术重复。
图1 FmWRKY44基因的RT-PCR扩增电泳结果 M.DL2000 DNA maker;1.FmWRKY44基因Fig.1 RT-PCR amplification electrophoresis results of FmWRKY44 gene M.DL2000 DNA maker;1.FmWRKY44 gene PCR product
2 结果与分析
2.1 FmWRKY44基因克隆与序列分析
以水曲柳叶片为模板,通过RT-PCR扩增获得一条长为1 383 bp的序列(图1)。经BLAST比对分析,该序列与樟子松WRKY基因(XM_023033499.1)一致性为91%。经DNAMAN翻译,该序列编码460个氨基酸。通过在线分析软件SMART对FmWRKY44蛋白分析,并绘制其结构域的位置图。结果表明,FmWRKY44在185~243位置和381~440位置共有两个WKRY保守结构域。所以推测其属于WRKY家族中的Ⅰ类蛋白质亚家族(图2)。

图2 FmWRKY44基因编码区的核苷酸序列及其推导氨基酸序列 下横线表示WRKY超家族结构域。Fig.2 Nucleotide sequence of the coding region of FmWRKY44 gene and its deduced amino acid sequence The lower horizontal line indicates the WRKY superfamily domain.
2.2 FmWRKY44编码蛋白的生物信息学分析
2.2.1 FmWRKY44蛋白一级结构分析
利用ProtParam工具在线分析,FmWRKY44编码460个氨基酸,分子式为C2190H3477N645O717S15,相对分子质量50.80 kD,等电点(pI)8.88,不稳定系数38.62,为稳定蛋白,平均亲水系数(GRAVY)-0.878,为亲水蛋白。利用ProtScale计算FmWRKY44亲疏水性图谱,结果显示FmWRKY44蛋白中疏水氨基酸占20.4%,亲水氨基酸占87.4%,亲水区域分布面广,所占比高;疏水区域较少,所占比低。表明FmWRKY44蛋白为亲水蛋白(图3A)。利用SignalP4.1 Server和TMPred分析预测发现,FmWRKY44没有跨膜结构区域(图3B),未发现信号肽结构,推断该蛋白为非分泌蛋白,表明蛋白在细胞质中合成后不能被转运。利用WOLFPSORT预测FmWRKY44亚细胞定位,结果表明,FmWRKY44主要分布在细胞核中,占78.3%,细胞质、线粒体和过氧化物酶体分别占8.7%、8.7%和4.3%。
2.2.2 FmWRKY44蛋白的二级结构预测
利用SOPMA在线工具分析FmWRKY44蛋白的二级结构组成,结果显示蛋白二级结构主要由70.22%(323aa)的无规则卷曲,16.30%(77aa)的α螺旋结构(Alpha helix),10.22%(47aa)的扩展长链(Extended strand),3.26%(15aa)的β转角结构(Beta bridge)构成(图4)。
2.2.3 FmWRKY44蛋白的活性位点分析
利用PROSCAN在线分析工具对FmWRKY44蛋白进行活性位点分析,结果表明该蛋白包括4个N-糖基化位点,6个蛋白激酶C磷酸化位点,10个酪蛋白激酶Ⅱ磷酸化位点,4个N-豆蔻酰化位点。

图3 水曲柳FmWRKY44蛋白的亲/疏水性(A)、跨膜区域(B)分析预测Fig.3 Analysis of pro-/hydrophobic(A) and transmembrane region(B) of FmWRKY44 protein

图4 水曲柳FmWRKY44蛋白的二级结构预测 横轴表示氨基酸位置;蓝色表示α螺旋;绿色表示β转角;紫色表示无规则卷曲;红色标会延伸链Fig.4 Prediction of secondary structure of FmWRKY44 protein The horizontal axis represents the amino acid position; the blue represents the alpha helix; the green represents the beta turn; the purple represents the random curl; the red marker extends the chain

图5 不同植物WRKY44蛋白系统进化树分析Fig.5 Phylogenetic analysis of WRKY44 from different plants
2.2.4 FmWRKY44蛋白的系统进化分析
采用MEGA7.0.2中的NJ方法构建蛋白的系统发育进化树,结果显示数水曲柳FmWRKY44与芝麻SiWRKY44[21]亲缘关系较近(图5)。
2.3 FmWRKY44同源蛋白的多序列比对分析结果
利用在线多序列比对软件PRALINE对FmWRKY44蛋白序列与NCBI数据库中一些其它物种的WRKY44蛋白序列进行同源性比较,结果表明,FmWRKY44与其它WRKY44蛋白序列的保守区主要集中在2个WRKY结构域,其锌指结构为CX4~5CX22~23HXH(X为非保守氨基酸),与前人研究相符合(图6)。
2.4 FmWRKY44的表达特性
以水曲柳种子、叶、叶柄、根、茎和愈伤分别为模板,通过qRT-PCR检测分析FmWKRY44在水曲柳不同部位的相对表达量。结果显示FmWKRY44在种子中高度表达,是叶片表达量的4.83倍(图7A)。
为了分析水曲柳FmWRKY44对非生物胁迫的表达模式,我们分析了低温、高温、100 mmol·L-1NaCl和10%PEG-6000逆境条件下FmWKRY44的表达情况。在低温胁迫下FmWRKY44基因表达量在0~12 h基本持平,在24 h达到最高,为0 h表达量的2.61倍,随后表达量降低,在96 h达到最低,为0 h表达量的0.41倍(图7B)。在高温胁迫下,FmWRKY44表达量在0.5 h时立即下降,其表达量为0 h表达量的0.23倍,随后1~2 h内逐渐上升(图7C)。在NaCl盐胁迫下,FmWRKY44在0~6 h内基因表达量呈现先上升在下降的趋势,3 h表达量达到最高并为0 h表达量的1.78倍,12 h基因表达量恢复并持平(图7D)。PEG模拟干旱处理下,FmWRKY44基因表达量在12和72 h出现峰值分别是0 h表达量的1.98和1.66倍,其他时间较0 h表达量降低(图7E)。由此,FmWRKY44基因可以参与低温、高温、高盐以及干旱非生物胁迫影响的响应,且高度响应低温、高温逆境。
为了分析水曲柳FmWRKY44对不同激素的响应情况,我们用激素NAA、ABA、GA3、JA处理水曲柳实生苗分析其FmWRKY44基因表达情况。结果显示,在NAA处理下FmWKRY44基因表达量在0~24 h内FmWRKY44基因表达量降低,在6 h达到最低峰值,其表达量是0 h表达量的0.29倍,在72 h是表达量升高并达到最高峰值,为0 h表达量的2.08倍(图7F)。ABA处理下FmWRKY44基因表达量在13和12 h出现峰值分别是0 h表达量的1.96和1.65倍,其他时间较0 h表达量降低(图7G)。GA3处理下前1~6 h内FmWRKY44基因表达量降低,12~72 h表达量逐渐升高,72 h达到峰值,其表达量是0 h表达量的1.3倍(图7H)。JA处理下FmWRKY44基因表达量在1~24 h较低,在72 h时表达升高并达到最高峰值,其表达量是0 h表达量的1.64倍(图7I)。因此,FmWRKY44基因可以响应NAA、ABA、GA3、JA信号。
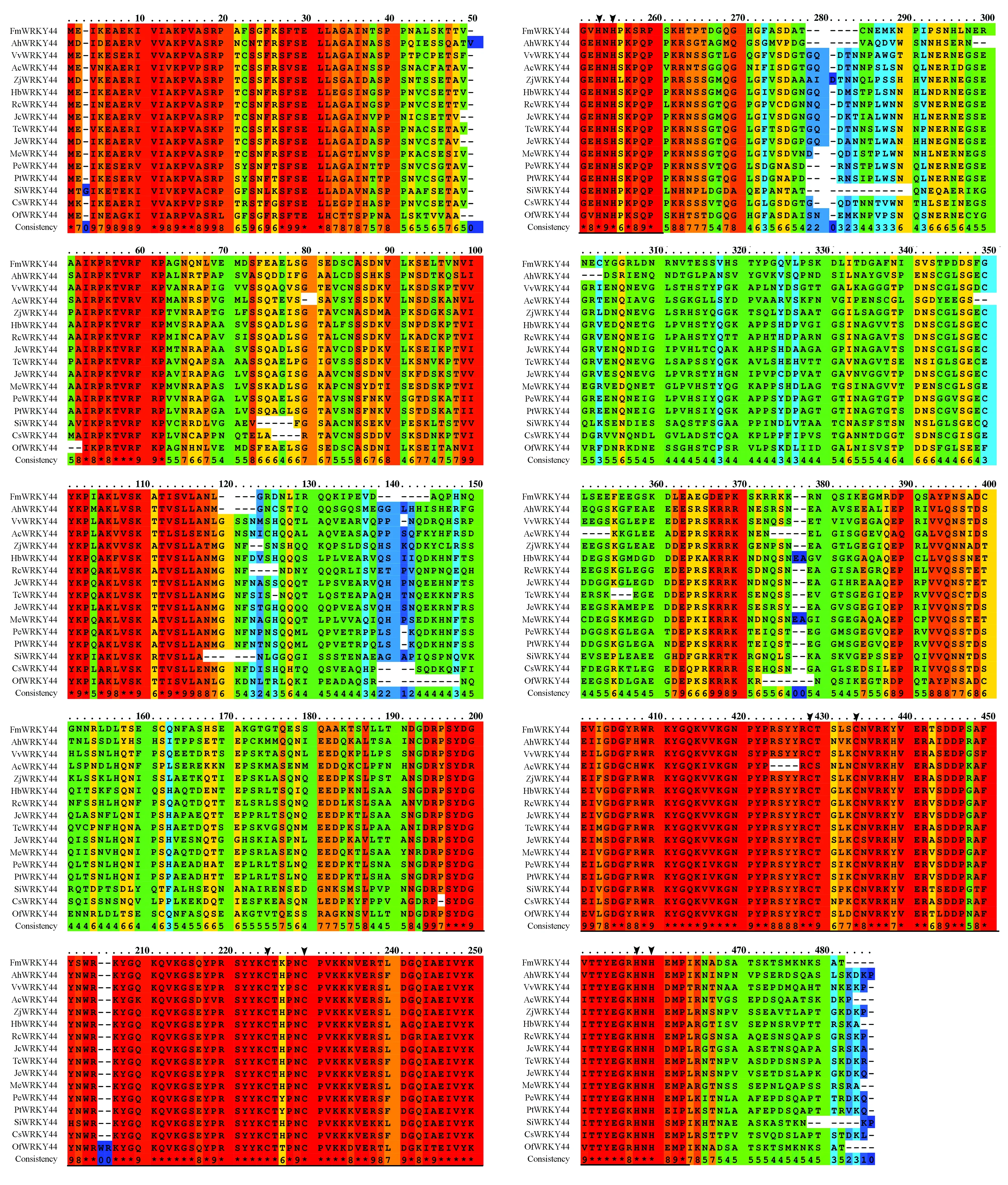
图6 FmWRKY44与其它植物WRKY蛋白序列比对 粗线表示WRKY结构域;箭头表示锌指结构Fig.6 Multiple-alignment of FmWRKY44 with other WRKY proteins Thick lines indicate WRKY domains;Arrows indicate zinc finger structures

图7 水曲柳不同组织及不同处理下FmWRKY44表达分析 A.不同组织部位;B.低温处理;C.高温处理;D.NaCl处理;E.PEG处理;F.NAA处理;G.ABA处理;H.GA3处理;I.JA处理Fig.7 Expression analysis of FmWRKY44 in different tissues and different treatments A. Different tissue parts; B. Low temperature treatment; C. High temperature treatment; D. NaCl treatment; E. PEG treatment; F. NAA treatment; G. ABA treatment; H. GA3 treatment; I. JA treatment
3 讨论
干旱、高盐、低温、高温等极端条件,是植物生长过程中所面临的的主要逆境非生物胁迫因素。在逆境条件下,许多植物所特有的转录因子家族如WRKY、AP2/ERF和NAC等,它们在植物的生长抗逆调节控制中起着重要而独特的作用。WRKY转录因子是其中发现较早的一种转录因子,其主要结构是所包含的WRKY结构域[22],是具有60个氨基酸长的DNA结合结构域,特征在于N端具有一个高度保守的WRKYGQK核心基序,根据WRKY结构域的数目和锌指结构的类型[8,23],可以区分WRKY转录因子的类型。本研究获得FmWRKY44基因,发现该基因含有2个WRKY保守结构域,且锌指结构符合CX4-5CX22-23HXH结构,通过保守域和与其他物种WRKY44蛋白序列比较分析证明该基因属于第一类WRKY家族。
在植物胁迫反应中,WRKY蛋白促进了植物复杂信号网络的建立和在植物非生物胁迫反应中重要作用的WRKY蛋白使潜在的基因发挥传递逆境胁迫的作用[24~25]。先前研究发现植物受到逆境胁迫时,胞外信号MAPK激酶等逐级传递调控信号进入胞内,激活WRKY及其他转录因子与下游靶基因结合[26~27],并在ABA、SA、JA、ET以及其他WRKY转录因子等信号途径的调控下,在转录水平上促进该基因的表达,从而影响植物非生物胁迫应答[28]。本研究通过测定30天组培苗在低温、高温、盐和干旱条件下的基因表达量,分析发现FmWRKY44可以受到温度调节,并低温促进其表达,高温抑制其表达FmWRKY44,并对盐、干旱胁迫也有剧烈响应。植物内源激素如ABA、SA、JA、ET等不仅参与胁迫反应,而且还在植物生长发育、种子发育及衰老等一系列生命活动期中发挥着重要的调节作用。所以我们进一步测定了FmWRKY44在NAA、ABA、GA3、JA处理下的表达水平。分析发现,FmWRKY44在NAA、GA3和JA处理下都基本呈现先下降后上升的趋势,说明FmWRKY44可能受3种激素负向调控。我们发现FmWRKY44在种子中的表达水平,远高于在其他器官中的表达水平是其在叶片表达量的4.83倍,说明FmWRKY44积累对于种子萌发与休眠过程起到重要作用。此外,ABA信号对种子萌发,以及应对干旱等非生物胁迫有着重要作用。现研究发现许多WRKY转录因子如AtWKRY43[29]、ZmWRKY40[30]均响应ABA信号,进而调控种子萌发和应对高盐、干旱和低温胁迫。AtWRKY44在干旱胁迫下受GI-miRNA172信号响应,并进一步实验分析认为其响应过程可能是干旱使得ABA水平增加,进而激活级联响应[31]。在本研究中FmWKRY44对ABA、干旱、盐、低温以及种子萌发过程中均有剧烈响应,说明其可能也参与ABA信号通路,但其具体作用机制仍不明确,仍需未来进行实验验证及讨论分析。

